一种高亲和结合I型胶原蛋白的GST融合蛋白表达分析
2019-10-16董育红李遂焰陈渝萍
董育红, 李遂焰, 陈渝萍
(1. 西南交通大学 生命科学与工程学院, 成都 610031; 2. 西南交通大学 材料科学与工程学院, 成都 610031; 3. 南华大学 药学与生命科学学院, 衡阳 421001)
当前临床治疗亟待解决的难题是如何提高药物治疗疗效并降低乃至去除其毒副作用,药物的靶向性研究越来越受到重视[1-2]。纤维化疾病(包括系统性硬化、肺纤维化、肝硬化、进展性肾病、骨髓纤维化等)病人的组织中异常沉积细胞外基质蛋白(ECM),使组织变硬、顺应性降低,破坏组织器官的结构和功能,危害人们的健康乃至生命[3-7]。其中,I型胶原蛋白的增多极为显著[8-12]。人类胎盘生长因子2(Placental Growth Factor,PlGF-2)的氨基酸123~144肽段(PlGF-2123-144)介导其对多种ECM蛋白尤其是对I型胶原蛋白的高亲性[13]。这些研究结果启发我们利用该短肽去修饰抗纤维化药物,可使其获得和I型胶原蛋白结合的能力,更易于为I型胶原蛋白丰富的纤维组织捕捉和留滞,进而提高其疗效。本研究对人PlGF-2123-144的编码DNA序列进行修改、构建了GST-PlGF-2123-144融合蛋白的原核表达质粒,采用E.coliBL21原核系统进行大量表达,亲和纯化获得了具备和I型胶原蛋白高亲性结合的GST-PlGF-2123-14融合蛋白,为进一步研发靶向治疗各种纤维化疾病的药物奠定了基础。
1 材料与方法
1.1 材料
大肠杆菌DH5α和BL21购自北京擎科公司;pMD19-T连接试剂盒和1 kb DNA Marker购于大连宝生;PCR试剂盒,购自天根或NEB-北京;DNA内切酶和连接酶购自NEB-北京;质粒提取试剂盒购自北京庄盟;胶回收试剂盒购自Axygen, SDS-PAGE蛋白电泳试剂耗材膜和ECL化学发光试剂盒均购自BioRad。GST鼠单克隆抗体和HRP标记的羊抗鼠IgG分别来自Affinity Biosciences和Invitrogen;pGEX-4T-1质粒和Glutathione Sepharose 4B购自GE Healthcare,L-还原性谷胱甘肽来自TOCRIS;溶菌酶、I型胶原蛋白购自Sigma-Aldrich;引物由上海生工合成。其他国产化学试剂均为分析纯。
1.2 方法
1.2.1PlGF-2123-144基因片段的获得
采用“JCat”软件对人PlGF-2第123~144位氨基酸所对应的DNA序列进行修改、融入大肠杆菌偏爱密码子,设计出PlGF-2123-144序列。所用引物序列如下。 F:5′-GAATTCCGTCGTC GTCCGAAAGGTCGTGGTAAAC GTCGTCGTGAAAAACAG-3′和R:5′-GTCGACCAGGTGGCAGT CGGTCGGACGCTGTTTTTCACGACGACGTTTACC-3′。 以常规PCR反应扩增后将PCR产物与pMD19-T线性载体连接、转化DH5α感受态细胞。阳性菌落经蓝白筛选、克隆PCR和碱裂解法提取质粒并以Hind Ⅲ 单酶切和最后的阳性pMD19-PlGF-2123-144质粒测序鉴定。克隆PCR上游引物(5′-3′):ATGCAGAATTCCGTCGTCGT(画线部分为EcoR I酶切位点);下游引物(5′-3′):ACGTACTCGAGCAGGTGGCAGTCG(画线部分为XhoI酶切位点)。
1.2.2 GST-PlGF-2123-144重组表达载体的构建和鉴定
以pMD19-PlGF-2123-144为模板,采用上述克隆PCR引物扩增PlGF-2123-144基因片段。以EcoR I和XhoI分别对回收的PCR产物和pGEX-4T-1空质粒进行双酶切、再分别以12% PAGE胶和0.8%琼脂糖胶电泳分离和回收,T4DNA连接酶4 ℃连接过夜后转化DH5α大肠杆菌。采用引物(上游引物(5′-3′):GGGCTGGCAAGCCACGTTTGGTG,下游引物(5′-3′):CCGGGAGCTGCATGTGTCAGAGG)进行菌落PCR筛选阳性细菌,最后经测序鉴定获得GST-PlGF-2123-144融合蛋白表达质粒。分别将pGEX-4T-1质粒和重组pGEX4T1-PlGF-2123-144质粒转化BL21大肠杆菌,获得GST融合蛋白的工作菌种。
1.2.3 GST、GST-PlGF-2123-144蛋白的诱导表达和纯化
BL21单菌落接种于Amp+/LB液体培养基中,37 ℃振摇过夜后,1∶1000稀释到Amp+/2XYT培养基中,37 ℃振荡培养至对数生长期OD550=0.8。加入IPTG于30 ℃、250 r/min继续震荡培养。对不同IPTG终浓度(0.1、0.5、1.0、2.0和4.0 mmol/L,诱导6 h)和不同诱导时间(2、4和6 h,1 mmol/L IPTG)的培养菌液进行收集、裂解和Western Blot分析检测,对阳性条带进行光密度扫描分析,确定最优表达条件。
使用最优条件大量诱导蛋白表达,收集细菌以溶菌酶裂解,离心取上清。上清(相当于20 mL菌液)中的目的蛋白经Glutathione Sepharose 4B胶泥亲和吸附和10 mmol/L还原性谷胱甘肽(pH 8.0)洗脱。以考马斯亮蓝染色和Western Blot分析追踪GST融合蛋白的纯化情形。洗脱的目的蛋白以含10%甘油及0.01 mmol/L DTT的PBS溶液进行透析并以BCA方法定量。
1.2.4 融合蛋白对I型胶原蛋白的亲和活性的ELISA实验测定
按照图1所示流程进行ELISA实验。ELISA孔板首先用100 μL I型胶原蛋白包埋4℃ 过夜、干燥过夜,随后脱脂牛奶进行封闭。孔板漂洗后再分别加入 GST融合蛋白和胶原蛋白共孵育。漂洗后加入GST一抗(1∶5000)4 ℃孵育过夜检测滞留的GST蛋白。二抗孵育后,加入0.3% H2O2甲醇溶液封闭、进行常规显色。读取各孔450 nm处OD值并计算GST信号。
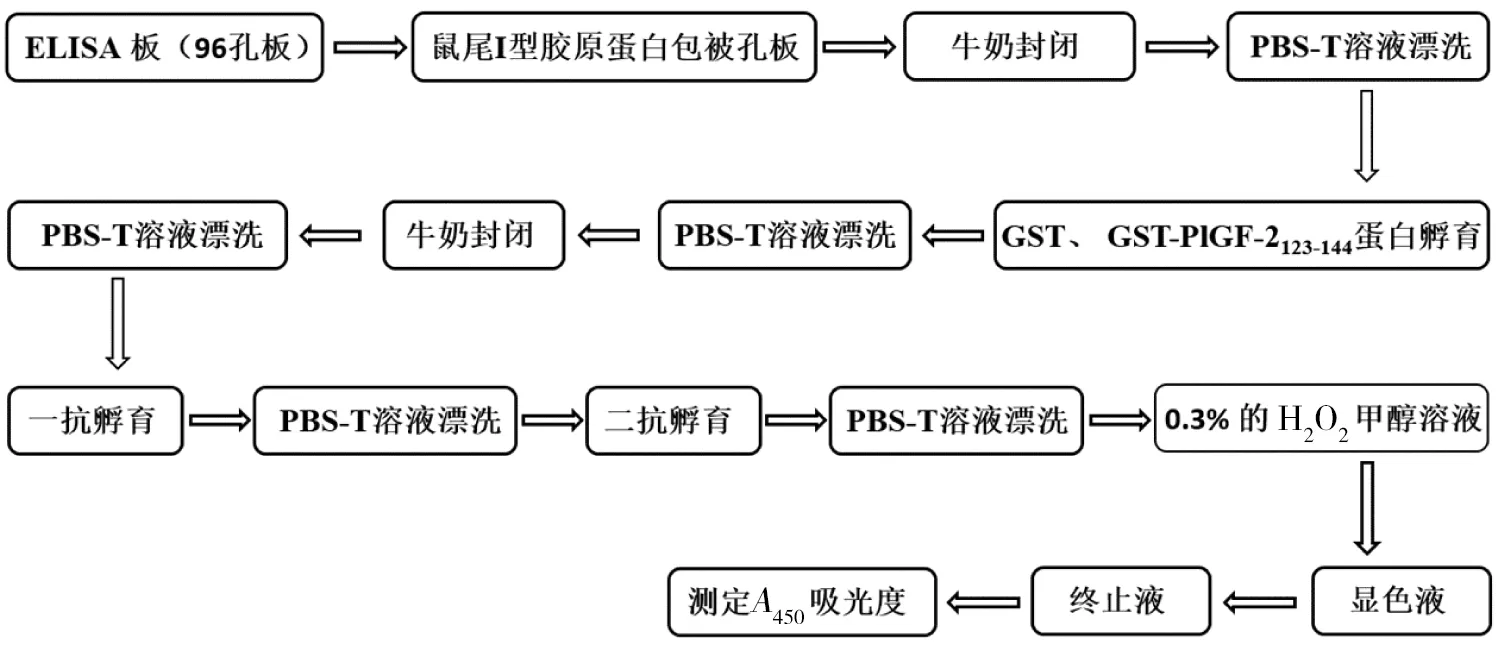
图1 ELISA实验流程示意图
1.2.5 统计学分析
实验数据均以平均值±标准差(x±s)表示。采用TTEST检验方法比较同等摩尔数的GST和GST-PlGF-2123-144蛋白的组间差异,P< 0.05表示组间有显著性差异。
2 结果与分析
2.1 PlGF-2123-144基因片段的获得
采用各含部分PlGF-2123-144DNA序列的两段引物进行退火和PCR扩增,获得含PlGF-2123-144序列的扩增产物(图2-A);随后与pMD19-T载体连接,转化E.coliDH5α感受态细胞。挑选白色菌落进行菌落PCR,2%琼脂糖凝胶电泳显示100 bp处有一条特异性条带,与PlGF-2123-144(88 bp)片段大小基本相符(图2-B)。提取阳性细菌质粒,使用Hind Ⅲ 进行单酶切。图2-C的0.8%琼脂糖电泳结果显示,1泳道1.9 kb 的未线性化质粒在单酶切后产生约2.7 kb的片段,和pMD19-PlGF-2123-1442770 bp的大小符合(2号泳道)。测序结果显示PlGF-2123-144目的DNA序列成功克隆到pMD19质粒(图2-D)。
2.2 重组表达载体的构建和鉴定
以pMD19-PlGF-2123-144为模板扩增PlGF-2123-144片段,酶切后插入pGEX4T1表达质粒。图3-A是pGEX4T1-PlGF-2123-144质粒菌落PCR的琼脂糖凝胶电泳检测结果。与阴性对照对比,阳性重组质粒扩增结果产生了一条单一扩增条带,位置非常接近229 bp目标片段。图3-B的测序结果证实了PlGF-2123-144的DNA序列被成功克隆到pGEX4T1质粒。图3-C和D分别是pGEX4T1和pGEX4T1-PlGF-2123-144转化E.coliBL21后质粒酶切的鉴定结果:EcoR I单酶切产生的约5 kb单一片段在结合EcoR V进行双酶切后,可被断裂为2和3 kb大小的两个片段,表明两种pGEX4T1质粒均被成功导入E.coliBL21。
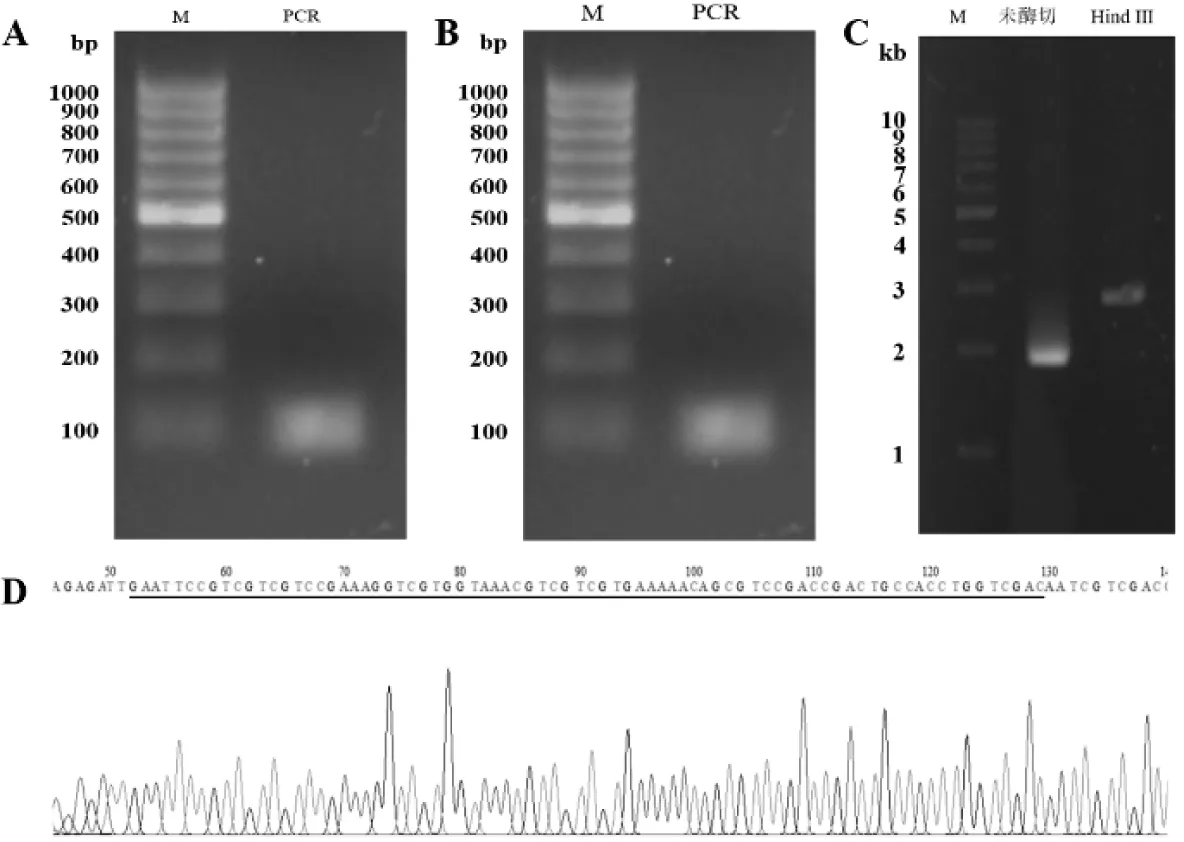
A:PlGF-2123-144序列的PCR扩增;B:pMD19-PlGF-2123-144菌落PCR;C:pMD19-PlGF-2123-144质粒单酶切;D:pMD19-PlGF-2123-144测序
图2pMD19-PlGF-2123-144质粒构建和鉴定
Figure 2 Construction and characterization of pMD19-PlGF-2123-144plasmid
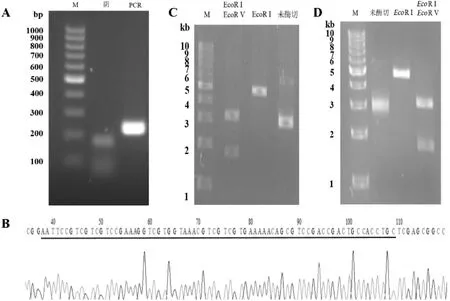
A:菌落PCR;B:测序结果;C:pGEX-4T-1转化BL 21酶切结果;D:pGEX4T1-PlGF-2123-144转化BL 21酶切鉴定结果
图3重组质粒pGEX4T1-PlGF-2123-144质粒鉴定和转化BL21鉴定结果
Figure 3 Identification and transformation of BL21 by recombinant plasmid pGEX4T1-PlGF-2123-144
2.3 GST和GST- PlGF-2123-144蛋白的诱导表达
以30 ℃为诱导温度,探索IPTG诱导浓度(0.1~4 mmol/L)和诱导时间(1~4 h)对两种GST蛋白诱导表达的影响。如图4-A所示,1 mmol/L IPTG诱导6 h后,GST的蛋白产量和在细菌裂解上清中的所占比例都已达到较好水平。图4-B的Western Blot分析结果则显示了GST-PlGF-2123-144蛋白在不同条件下都有较好的诱导表达。进一步对目的蛋白阳性条带进行光密度扫描定量分析,发现1 mmol/L IPTG时,不同诱导时间样品的光密度分别为3734.95、5358.32、7231.04和7681.65,说明蛋白产量随诱导时间延长而增多。当设定诱导时间6 h,不同IPTG浓度下样品的光密度分别为8895.96、7990.42、7681.65、6246.76和8078.79,蛋白产量在0.1 mmol/L IPTG时最高,0.5和1 mmol/L时降低10%,2 mmol/L时则降了近30%,表明IPTG过高对GST-PlGF-2123-144蛋白产量有负面影响。进一步分析诱导6 h后目的蛋白在裂解上清和沉淀中的分配比例,发现在诱导IPTG浓度为0.1、0.5、1、2 和4 mmol/L时,目的蛋白的分配比例依次为1.21、1.07、1.08和1.00(其中4 mmol/L沉淀样品不具备分析性未进行分析)。因此,在30 ℃、0.1 mmol/L IPTG和6 h的诱导条件下,可溶性GST-PlGF-2123-144蛋白产量可达最高。
通过对细菌总蛋白进行考马斯亮蓝染色,我们比较了GST和GST-PlGF-2123-144融合蛋白表达产量。图5-B为来自相同诱导培养条件(1 mmol/L IPTG,6 h)下等量菌液中两种蛋白的表达结果。占细菌总蛋白41%的是GST蛋白,GST-PlGF-2123-144蛋白所占比例有所下降,约为34%;而GST-PlGF-2123-144蛋白表达量约为GST蛋白的83%。

A:GST蛋白;B:GST-PlGF-2123-144蛋白
图4GST和GST-PlGF-2123-144蛋白的最适诱导表达条件的WesternBlot分析
Figure 4 Western Blot assay for optimization of the induced GST and GST-PlGF-2123-144proteins
2.4 GST和GST- PlGF-2123-144蛋白的纯化
大量诱导表达GST和GST-PlGF-2123-144蛋白后,采用Glutathione Sepharose 4B亲和性胶泥纯化可溶性目的蛋白,并在每个纯化步骤完成后取少量样品、进行了SDS-PAGE和Western Blot分析。图5考马斯亮蓝染色定量分析,GST洗脱液的纯度分别为96%、98%和99%。GST-PlGF-2123-144的纯度从72%、86%到97%。Western Blot结果显示,胶泥亲和吸附的GST蛋白在3次洗脱后已经从胶泥上脱吸附,而GST-PlGF-2123-144则需要更多的洗脱操作来保证充分回收。通过Glutathione Sepharose 4B胶泥亲和吸附,我们很好地纯化两种目的蛋白。

A:GST蛋白;B:GST- PlGF-2123-144蛋白
图5纯化的GST和GST-PlGF-2123-144蛋白的考马斯亮蓝染色和WesternBlot分析
Figure 5 Coomassie blue staining and Western Blot analysis of the prepared GST and GST-PlGF-2123-144
2.5 ELISA实验测定GST- PlGF-2123-144融合蛋白对I型胶原蛋白的亲和活性
往I型胶原蛋白充分包被的96孔ELISA孔板中分别加入摩尔数相同的GST和GST-PlGF-2123-144两种蛋白与I型胶原蛋白孵育,检测目的蛋白活性。如图6所示,和胶原蛋白孵育的GST蛋白即使从0.5 μmol增加到了6 μmol,孔板中GST的ELISA信号强度没有改变;而当GST-PlGF-2123-144加入量增加到3 μmol和6 μmol时,孔板中GST的ELISA信号强度高出同等摩尔数GST蛋白组5.1倍(P=0.0291)和5.75倍(P=0.0131)。这个结果证实,GST-PlGF-2123-144融合蛋白的确具有良好的和I型胶原蛋白结合的活性。
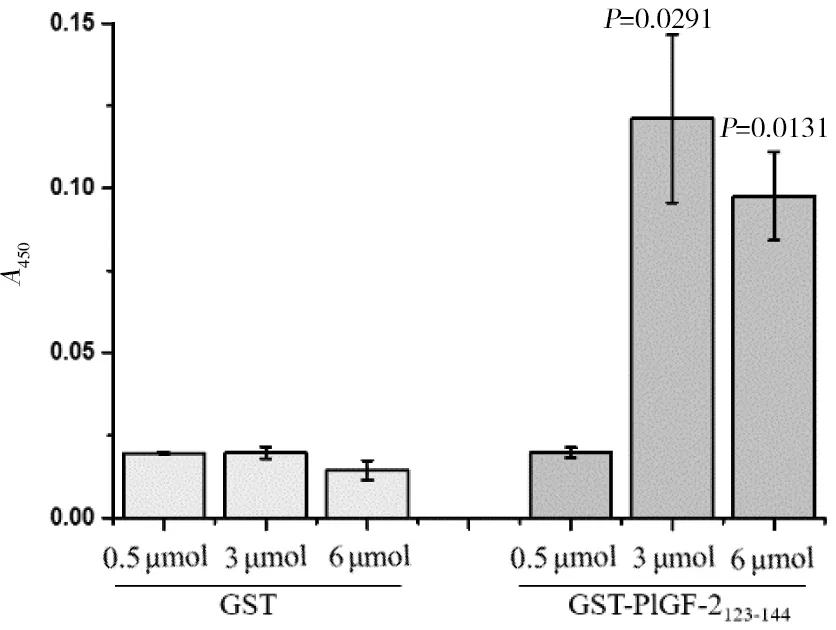
图6 ELISA实验测定GST-PlGF-2123-144融合蛋白对I型胶原蛋白的亲和活性
3 讨论
纤维化的组织中,转化生长因子-β刺激纤维母细胞和炎症细胞等[14]大量分泌I型胶原蛋白,同时产生基质金属蛋白酶抑制剂抑制胶原蛋白酶,使得I型胶原蛋白大量沉积[7-12]。这一特点使得I型胶原蛋白可以作为一个很好的靶向纤维化组织的靶点。近来研究显示,PlGF-2123-144肽段对多种ECM蛋白(尤其是I型胶原蛋白)具有很强的亲和结合活性,可使与其融合的细胞因子在组织中滞留、富集,提高细胞因子功效。已有研究表明,与PlGF-2123-144肽段融合后的PDGF-BB和VEGF-A细胞因子在治疗小鼠的体外创伤上显示出更加明显的疗效[13]。最近有人将IFNα与PlGF-2123-144肽段进行融合,获得了抗癌活性高的IFNα[15]。
因此将PlGF-2123-144肽段用于改造抗纤维化药物可赋予它们与I型胶原蛋白的高亲和性,可以提高药物对纤维化组织的靶向、增加药物的有效治疗浓度,还有助于药物的缓释。本研究所获得的蛋白拥有较好的产量和纯度,并很好地维持了同I型胶原蛋白结合的高亲性,为进一步研究PlGF-2123-144对抗纤维化药物改性,寻找更有效、副作用更小的抗纤维化药物奠定了基础。
