肠道驻留病毒调控宿主免疫稳态的研究进展
2019-10-16刘蕾,江维
刘 蕾, 江 维
(中国科学技术大学 生命科学学院, 合肥 230031)
免疫稳态是指机体免疫系统达到的一种平衡状态,这种平衡既可以保证机体对有害入侵病原微生物的有效识别及免疫反应的启动,又可以对自身成分或共生微生物形成免疫耐受。免疫稳态的失调(免疫反应过强或过弱)会导致体内平衡被打破,进而诱发疾病。例如,免疫反应过强容易罹患自身免疫性疾病,而免疫反应过弱则容易罹患感染性疾病和肿瘤[1]。肠道共生微生物主要由细菌、病毒以及真菌组成,它们从新生期开始出现,在幼年逐渐成熟并形成稳定的微生物组成[2-3]。已有大量研究显示,肠道共生菌具有多种生物学功能,它们不仅能够帮助宿主获取基本的营养物质和能量,维持肠道屏障的完整性[4],还能诱导多种淋巴细胞(例如T、B淋巴细胞)的发育分化成熟,维持免疫系统稳态[5-8]。此外,肠道共生菌还与一些炎症性疾病,如肥胖、2型糖尿病、动脉粥样硬化、克隆恩氏病以及溃疡性肠炎等息息相关[9-14]。
近年来研究人员运用噬菌斑实验、电镜观察、聚合酶链式反应(PCR)以及宏基因组测序的方法,发现人和动物的肠道中不仅驻留有大量共生菌,同时还存在大量驻留病毒[15]。显微镜计数结果显示,每克人类粪便中约含有108~109个病毒样颗粒(Virus like particles,VLPs)[16]。随着宏基因组测序技术的发展,研究发现人类和动物的肠道存在DNA病毒和RNA病毒基因组[13, 16-17]。根据病毒寄居类型,即细菌或真核细胞,病毒可分为原核生物病毒(即噬菌体)和真核生物病毒[17]。肠道中的噬菌体可直接影响宿主菌的组成[18],也可被肠道中的模式识别受体直接识别,调控免疫细胞的功能[19]。相比肠道噬菌体,肠道真核病毒的数量较少且主要通过饮食摄入[20]。研究发现,与健康人群相比,肠道疾病患者粪便样本中多种真核病毒丰度增加[21-22],它们可被多种模式识别受体直接识别,调控机体免疫反应。在炎性肠病、结肠癌以及2型糖尿病等疾病发生过程中,伴随着肠道驻留病毒失调,提示肠道驻留病毒与共生菌类似,影响疾病的发生发展[22-26]。本文就肠道驻留病毒对机体免疫稳态的影响及其调控机制作一综述。
1 肠道驻留病毒概述
病毒在进入机体后通过快速的演化,维持其多样性[27]。病毒不仅能潜伏于宿主细胞内稳定地进行复制,有的病毒还能将基因组整合到宿主染色体中或作为附加体,直到重新激活才变得具有传染性,这种生活方式允许病毒复制、存活、逃避防御,且与机体保持共生关系[27]。早期,对于肠道驻留病毒的研究主要运用显微观察法和体外培养的方法[15],由于99%的肠道共生菌都难以培养,这也导致很难将特定的肠道噬菌体进行体外分离培养[28]。荧光显微镜法可直接对病毒进行观察和数量统计,它不依赖于病毒的体外培养,缺点是无法对病毒结构进行观察。与之相比,电镜技术可更好地帮助研究人员观察病毒结构以及区分病毒类型[13, 29]。 2003年,人们首次使用鸟枪法检测到人类肠道中约有1200种病毒[13];随着宏基因组测序技术的发展,Phan等发现野鼠粪便中存在大量真核DNA病毒和RNA病毒[30];随后,对鼩鼱、猫等粪便分析发现多种常见病毒甚至新型病毒的存在[12, 31-32];而Zhang等研究显示健康熊猫粪便中包含种类繁多的真核病毒且患病熊猫病毒组成改变,提示肠道驻留病毒影响熊猫身体健康[33]。肠道驻留病毒根据其宿主不同,可分为原核病毒和真核病毒(表1)。
原核病毒是专一性感染细菌的病毒,即噬菌体(phage),它们是肠道驻留病毒的重要组成部分。研究表明人体肠道共生菌与噬菌体数量比例约为1∶1[17, 34]。按照裂解细菌的方式不同,这些噬菌体又分为溶原性噬菌体(温和噬菌体)和溶菌性噬菌体(毒性噬菌体)。溶原性噬菌体可稳定地插入到宿主染色体中,当受到外界环境应激或营养刺激时,产生裂解菌体的噬菌体颗粒;溶菌性噬菌体则具有直接感染和裂解细菌的能力[35]。研究显示人类和啮齿动物肠道中的噬菌体主要为dsDNA有尾噬菌体目噬菌体(Caudovirales),主要包括肌尾噬菌体科噬菌体(Myoviridae)、长尾噬菌体科噬菌体(Siphoviridae)、短尾科噬菌体(Podoviridae)以及ssDNA微小噬菌体科噬菌体(Microviridae)和丝状噬菌体科噬菌体(Inoviridae)[16-17, 22]。
在人类、啮齿动物以及猫科动物等肠道存在少量真核病毒,主要由ssRNA 病毒、dsRNA病毒、ssDNA病毒、dsDNA病毒以及逆转录病毒等组成[17, 30-31]。通过宏基因组分析,发现肠道中驻留的真核病毒主要包括:哺乳动物病毒,如圆环病毒科病毒(Circoviridae)、小双节病毒科病毒(Picobirnaviridae)、小核糖核酸病毒(Piconaviridae)、星状病毒(Astroviridae)、乳头瘤病毒(Papillomaviridae)、逆转录病毒科病毒(Retroviridae)以及冠状病毒(Coronaviridae)等;昆虫病毒,如彩虹病毒科病毒(Iridoviridae)和多瘤病毒科病毒(Polydnaviridae)等;以及植物病毒,如矮化病毒科病毒(Nanoviridae)、联体病毒科(Geminiviridae)和藻类DNA病毒科病毒(Phycodnaviridae)等[16, 30-32, 36]。其中哺乳动物病毒,如乳头状瘤病毒(Papillomaviruses)、疱疹病毒(Herpesviruses)和多瘤病毒(Polyomaviruses)等具有病原性,在感染过程中不能被免疫系统完全清除,甚至可潜伏于体内,伴随人体一生[37]。这些肠道驻留病毒与机体保持共生关系,对于机体健康的影响不容小觑。
表1肠道病毒种类以及核酸类型

Table 1 The species and types of gut viruses
2 肠道驻留病毒与机体免疫稳态
虽然肠道驻留病毒广泛存在于哺乳动物体内,但其对机体的影响主要集中以小鼠为动物模型展开研究。肠道驻留病毒可通过多种方式对机体免疫稳态产生积极或消极的影响。
2.1 肠道噬菌体对机体免疫稳态的影响
肠道驻留病毒通过共生菌间接地影响机体稳态。一方面,肠道噬菌体可将其基因插入到宿主菌的基因组,改变宿主菌多种基因的表达(例如抗生素特性基因、毒力因子基因以及代谢相关基因)[38],从而影响菌群功能或组成间接地调控机体代谢以及免疫系统[39]。例如,STX噬菌体将产志贺毒素的Stx基因插入到非致病菌内,使其具有致病性并引起产志贺毒素埃希氏菌感染[38, 40]。另一方面,噬菌体可在适当环境下通过扩增并直接裂解宿主菌影响肠道共生菌组成,从而调控机体稳态。例如,人类肠道共生菌屎肠球菌(Enterococcusfaecalis)V583株一定营养条件下,可促进噬菌体φV1/7产生,该噬菌体通过感染并裂解其他类型的E.faecalis菌株,使得V583菌株在肠道菌群中占据优势生态位[18]。此外,研究显示在人、小鼠等黏膜表面噬菌体荷载量远高于周围环境,利用T4噬菌体预处理T84、A549细胞可有效抑制大肠杆菌黏附[41]。进一步研究发现肠道噬菌体通过免疫球蛋白样结构域与黏蛋白O-聚糖残基结合,提示肠道噬菌体可黏附于肠道黏液层,形成抗菌层,阻止病原细菌黏附与定植,从而减少肠上皮细胞死亡,维持宿主肠上皮层动态平衡[41]。
肠道噬菌体可直接被机体识别,影响机体免疫稳态。最近的研究指出肠道乳酸杆菌噬菌体、大肠杆菌噬菌体和拟杆菌噬菌体及其噬菌体DNA可直接被机体树突状细胞上的TLR9识别,促进CD4+T细胞和CD8+T细胞扩增,并诱导CD4+T细胞产生IFNγ,进而加重DSS诱导的肠炎[19]。最后该研究发现对溃疡性肠炎患者进行粪便微生物移植(FMT)治疗,肠道有尾目噬菌体增加的受体者对FMT治疗不敏感,说明肠道噬菌体不仅能直接加重肠道疾病的发生还能影响粪便微生物治疗效果[19]。有研究报道灌喂大肠杆菌T4噬菌体后,在肠道中检测到IgA以及血清中检测到IgG抗体。T4噬菌体表达如gp23、gp24、Hoc、Soc以及gp12被机体识别,揭示噬菌体也可刺激机体产生适应性免疫应答[42];随后的研究发现,T4噬菌体表达黏附蛋白gp12能与LPS结合,从而减轻LPS诱导的炎症[43]。
2.2 肠道真核病毒对机体免疫稳态的影响
相比肠道噬菌体,肠道真核病毒数量较少,但有的真核病毒具有潜在致病性,如腺病毒、冠状病毒、微小核糖核酸病毒科病毒以及星状病毒等[21, 44]。当它们大量入侵机体时,被机体模式识别受体并引起抗病毒反应的发生。参与识别病毒的模式识别受体主要有RIG-I样受体、Toll样受体、DNA感受器以及NOD样受体[45-46]。肠道中的模式识别受体识别病毒后,通过接头蛋白分子,活化下游的NF-κB、IRF3以及IRF7等多种转录因子,进而促进产生干扰素、促炎症因子(如IL-1β、IL-18)以及趋化因子(如IL-8、CXCL10)的表达,启动适应性免疫反应,有助于机体清除病毒。
肠道病毒感染也可能对机体免疫系统具有积极作用。早期研究发现,幼年时期反复的病毒感染可减轻TH2型免疫应答反应,从而减少过敏的发生[47];随后Kernbauer等研究显示外源给予鼠诺如病毒可减少无菌小鼠肠道ILC2细胞数量,提示肠道驻留病毒也可能调控过敏反应的发生[8]。该研究还发现鼠诺如病毒(Norovirus)可代替共生细菌刺激肠上皮细胞增殖,促进潘氏细胞产生溶菌酶和分泌颗粒并恢复无菌小鼠肠道免疫细胞数量,同时诱导IgA和IFNγ产生,进而保护肠道抵抗化学损伤和细菌感染[8]。此外,Barton等指出γHV68病毒(murinegammaherpesvirus68)或MCMV病毒(murineCytomegalovirus)潜伏期的小鼠在李斯特菌和鼠疫杆菌感染过程中,IFNγ产生以及巨噬细胞活化增强可显著提高小鼠抗菌能力,提示潜伏期的病毒与宿主形成有利的共生关系[48]。最近Yang等发现肠道驻留病毒通过活化浆细胞样树突状细胞上的模式识别受体TLR3和TLR7,促进IFN-α产生,同时减少传统树突状细胞产生如IL-6、TNF-α等炎性因子,保护炎性肠炎的发生发展[49]。但具体是何种肠道驻留病毒被机体识别,参与保护肠炎的发生尚不清楚。
3 肠道驻留病毒紊乱与疾病相关性
3.1 肠道驻留病毒与糖尿病
肠道噬菌体作为影响肠道共生菌组成以及机体代谢的重要因素,与代谢性疾病的发生发展具有一定联系。Yadav等发现肥胖小鼠肠道DNA病毒和RNA病毒核酸均显著增加[14];随后,Ma等研究显示肠道噬菌体数量在2型糖尿病患者中显著增加,其中有7个噬菌体分类单元与二型糖尿病相关,该研究还指出肠道噬菌体与糖尿病患者肠道菌群改变存在复杂关系[26]。Zhao等通过分析1型糖尿病易感儿童样本发现肠道环状病毒和噬菌体丰度均显著高于正常儿童,进一步分析发现这些疾病相关的噬菌体主要影响了肠道拟杆菌属和双歧杆菌属细菌丰度,揭示肠道病毒组与人类自身免疫病密切相关[50]。探究肠道噬菌体对糖尿病的影响,为人们研究代谢性疾病提供了新视角,但肠道噬菌体是通过何种机制参与糖尿病的发生过程尚不清楚。
3.2 肠道驻留病毒与炎性肠病、肠炎以及肠癌
炎性肠病是一种慢性肠道炎性疾病,本病主要包括克隆恩氏病和溃疡性肠炎。已有大量文章报道指出炎性肠病发生过程中,肠道Caudovirales噬菌体丰度明显增加,肠道细菌种类减少[11, 22-23, 51];最近,Zuo等通过宏基因组分析国内溃疡性肠病患者样本发现,肠道Caudovirales噬菌体显著增加,其物种多样性降低,并伴随着埃希氏噬菌体和肠杆菌噬菌体显著增加[52]。肠道驻留病毒功能紊乱,导致肠道菌群结构的改变,影响共生菌致病性以及抗生素耐药性,提示肠道驻留病毒通过共生菌影响与溃疡性肠炎发生[52]。研究人员利用CD4+CD45RBHighT细胞诱导结肠炎模拟炎性肠病的发生,研究显示厚壁门菌噬菌体在肠炎发生过程中丰度显著降低。与炎性肠病病人研究结果一致,T细胞诱导的肠炎也会导致Streptococci噬菌体丰度增加,提示Spounavirinae亚科噬菌体可能作为肠道相关疾病诊断的标志[22, 53]。此外,研究发现复发性艰难梭菌感染引起Caudovirales噬菌体丰度增加但其多样性以及均匀度均显著降低,并伴随着微小噬菌体科噬菌体丰度降低。当患者通过接受健康人粪便移植治疗后,可显著地提高其体内有尾目噬菌体和菌群多样性,并且供体者有尾目噬菌体丰度与患者预后效果呈正相关[54]。
肠道真核病毒也被广泛报道与肠道疾病的发生有一定关系,研究人员收集1010例急性肠炎样本并对其进行了分析,结果显示儿童病毒性腹泻主要由轮状病毒、诺如病毒、沙波病毒、星状病毒以及腺病毒等感染引起[55]。还有研究揭示肠癌患者肠道驻留病毒丰度显著高于健康人群,细菌种类却显著降低;并且在发病过程中,肠道噬菌体对不同种属链球菌具有调节作用,而链球菌引发的心内膜炎也被报道与结肠癌发生有关[24, 56- 57]。此外,研究还发现结肠癌患者肿瘤组织中HPV病毒呈阳性,提示HPV病毒可能影响结肠癌的发生发展进程[56, 58]。虽然已有大量文献揭示在肠道相关疾病的发生过程中均伴随着肠道驻留病毒组的改变,但是这一过程是诱导疾病发生的病因亦或者是结果以及其中具体机制均有待探究。
3.3 肠道驻留病毒与移植物抗宿主病
移植物抗宿主病是一种多系统疾病,其为造血干细胞移植的并发症。有研究报道患者接受造血干细胞移植(HSCT)后,处于潜伏期的肠道DNA病毒(疱疹病毒科病毒以及腺病毒科病毒)被重新激活,提示肠道驻留病毒与移植物抗宿主排斥病(GVHD)有密切联系[59-60]。随后Legoff等通过分析44位接受造血干细胞移植患者的肠道病毒组发现,肠道DNA病毒(如指环病毒、疱疹病毒、乳头瘤病毒以及多瘤病毒)检出率以及数量显著增加并伴随着肠道噬菌体丰度降低[61]。其中18位患者检测到小双节RNA病毒(Picobirnaviruses),该病毒在移植治疗前或治疗后一周内检出率高于移植治疗后期。Picobirnaviruses病毒检出率与GVHD疾病标志物(钙网蛋白及α1-抗胰蛋白酶)呈正相关,提示Picobirnaviruses病毒检测可用于早期移植物抗宿主病的诊断[61]。
虽然研究者不断发现,在肠道驻留病毒与机体多种疾病发生发展过程中,均伴随着肠道驻留病毒失调,但其中具体机制尚有待探究。明确疾病发生过程中肠道驻留病毒组的变化对疾病诊断和治疗有着重要意义。
3.4 驻留病毒与肠道免疫
在机体稳态的情况下,肠腔中的噬菌体可形成噬菌体层,防止共生菌入侵肠道;此外,肠道驻留病毒还能被肠道浆细胞样树突状细胞识别,促进抗病毒信号通路的活化产生IFNα,维持机体固有免疫应答;也有报道指出,树突状细胞识别肠道噬菌体后可促进CD4+T细胞和CD8+T细胞的增殖以及IFNγ产生。当稳态破坏时,肠道中的有尾目噬菌体丰度增加而微小噬菌体科噬菌体减少,并伴随着肠道菌群结构改变,肠道驻留病毒可通过直接或间接的方式影响肠道炎症的发生。一方面,肠道树突状细胞识别噬菌体刺激T细胞产生大量IFNγ;另一方面,肠道传统树突状细胞识别肠道共生菌可产生大量IL-6和TNF-α,这些过量产生的炎性因子均可能加重肠炎的发生(见图1)。
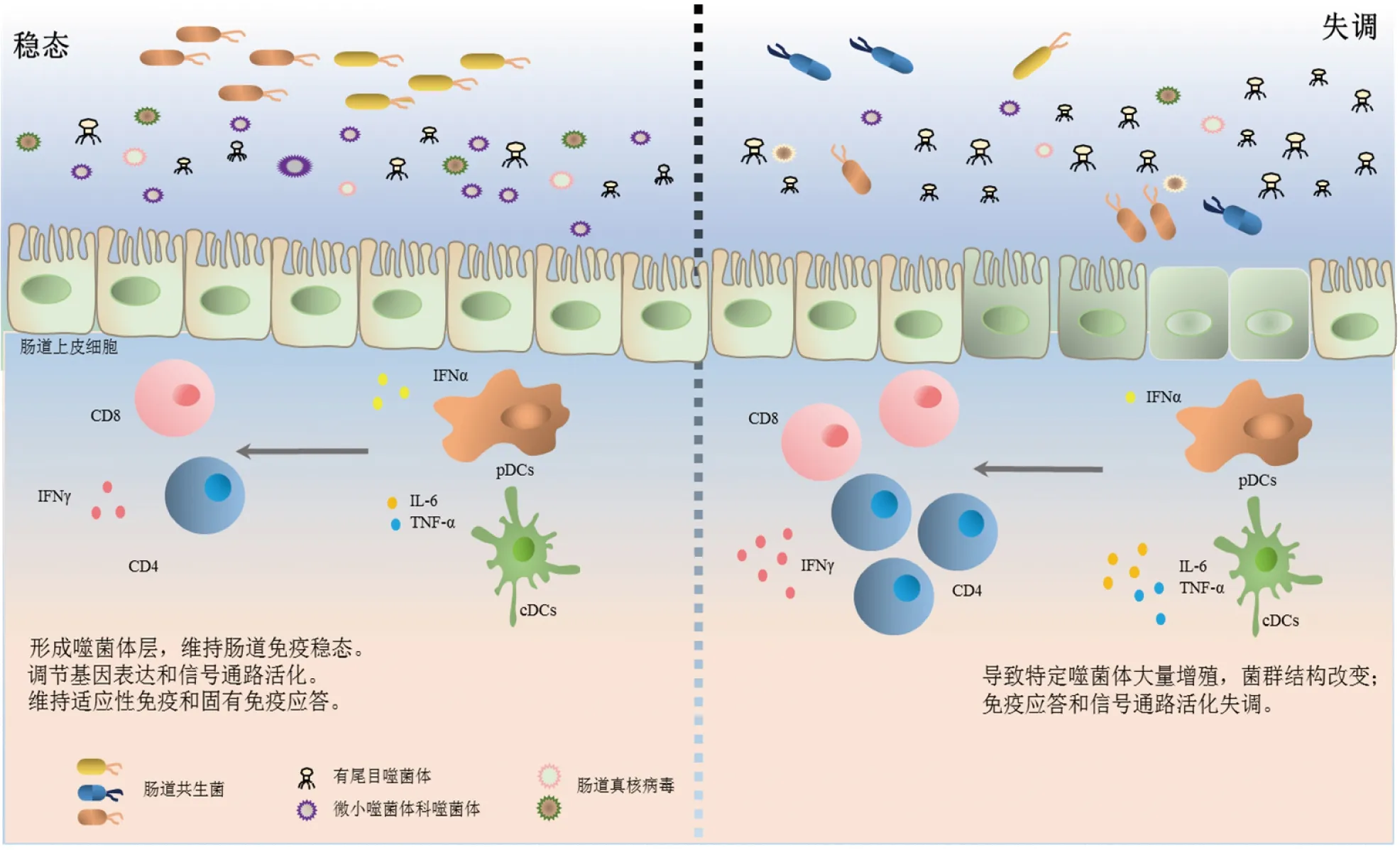
图1 驻留病毒与肠道免疫
4 总结与展望
肠道驻留病毒作为共生微生物的重要组成部分,数量丰富,种类繁多。它们对宿主的影响日益受到关注。研究显示,在肠道稳态的情况下,噬菌体可能在肠道形成噬菌体层,防止共生菌入侵肠道;此外,肠道驻留病毒还能被机体识别,进而调控基因表达以及抗病毒信号通路活化,维持适应性免疫和固有免疫的应答。当稳态破坏时,肠道中有尾目噬菌体丰度增加,肠道菌群结构改变,并伴随着机体免疫应答和信号通路活化失调(图1)。已有大量研究指出,炎性肠病、糖尿病等多种人类重大疾病的发生发展过程中,均伴随着肠道驻留病毒组成紊乱。然而其维持机体免疫稳态及调控疾病进程机制尚有待研究。探究肠道驻留病毒影响机体免疫稳态的作用和机制,明确某些特定种类病毒在上述疾病发生中的变化,可以为相关疾病的诊断和治疗提供靶点,具有良好的应用前景。
