环孢菌素A早期应用改善脑出血大鼠的神经细胞坏死
2019-10-16张海旺陈礼刚王艺明孙素影张海霞周长臣郑新安李修龙
张海旺,陈礼刚,张 苓,王艺明,孙素影,张海霞,周长臣,郑新安,李修龙,李 松
脑出血(intracerebral hemorrhage;ICH)是致残率和致死率较高的卒中类疾病,发病后1 m内的病死率高达30%~50%,幸存者通常伴有严重的神经功能缺失等后遗症,每年全球约有新发200万ICH患者[1]。目前,国内外尚无有效治疗措施,出血性脑损伤不仅是血肿本身的占位效应和血肿周围组织直接破坏的原发性损伤,继发性脑损伤也扮演着重要的角色。本研究探讨环孢菌素A(Cyclosporin A;CsA)早期应用能够改善ICH大鼠的神经功能缺陷,提高ICH大鼠的生活质量。
1 材料和方法
1.1 材料
1.1.1 实验动物 SD雄性大鼠96只,体重260 g~280 g,实验动物被随机分为假手术组(Sham)、脑出血+溶剂组(ICH+Vehicle)、脑出血+CsA 5 mg组(ICH+CsA 5 mg)和脑出血+CsA 10 mg(ICH+CsA 10 mg)共4组,每组各24只。
1.1.2 实验药品及试剂 碘化丙啶染色(PI)细胞核荧光染料购自美国ABcam公司;伊文思蓝购自上海国药集团化学试剂公司;CsA购自美国安迪生物R&D Systems。
1.1.3 实验仪器 脑立体定位仪(淮北正华生物仪器公司);透射电子显微镜Hitachi-7500(日本HITACHI公司);BX41型光学显微镜(日本Olympus公司)。
1.2 方法
1.2.1 动物模型的制备及给药方式 采用动物脑立体定向自体血脑内注入法,SD雄性大鼠均经10%水合氯醛(4 ml/kg)经腹腔注射麻醉,动物俯卧固定于立体定位仪上,头部备皮消毒后,正中矢状切开,切口长约1.0 cm,充分暴露前囟,前囟右旁3.5 mm、前0.2 mm处用牙科钻钻一直径约1 mm小孔,微量注射器抽取右股动脉血100 μl,沿孔道垂直进针5.5 mm后,注入100 μl自体血,缝合头部后缝合右股部,回笼饲养,假手术组只进针不注血。脑出血+溶剂组、脑出血+CsA 5 mg组、脑出血+CsA 10 mg大鼠于术后15 min分别经尾静脉注射生理盐水、CsA 5 mg/kg、CsA 10 mg/kg,观察时间超过24 h,每天给药1次。
1.2.2 电镜检测 SD雄性大鼠术后24 h,10%水合氯醛经腹腔注射大鼠麻醉,打开胸腔暴露心脏,剪开右心房,左心室灌注150 ml生理盐水,4%多聚甲醛和1%戊二醛350 ml~400 ml固定;快速将待检部位的脑组织用锋利洁净的双面刀片修切成大小1 mm3待检组织块;快速将待检组织块放入4%戊二醛固定液4℃固定2 h;0.1 mol/LPBS清洗3次;经1%四氧化锇固定2 h;常规乙醇及丙酮梯度脱水;环氧树脂浸透、包埋、聚合;制备0.5 μm厚度半薄切片光镜定位后在制备60 nm厚度超薄切片;醋酸铀和枸橼酸铅染色;行透射电子显微镜Hitachi-7500观察神经元及线粒体情况。
1.2.3 脑水含量测定 术后24 h处死大鼠,迅速断头取脑,取血肿周围脑组织于分析天平称湿重,测重精确到0.1 mg。置烤箱于110 ℃下烘烤24 h取出,根据Elliott公式(%)=(湿重-干重)/湿重×100%。
1.2.4 血脑屏障通透性检测 术后24 h时经股静脉注入2%EB溶液(5 ml/kg)1 h后,打开胸腔暴露心脏,通过左心室灌注生理盐水,剪开右心耳,直到右心耳流出的液体为清亮为止,迅速断头取脑,清洗脑表面杂质,滤纸吸干脑表面水分,取血肿周围脑组织,称湿重后置入PBS溶液中研磨,15000 r/min离心30 min,取1 ml上清,加入等体积三氯乙酸乙醇(1∶3)溶液,于4 ℃过夜孵育后,再于4 ℃下15000 r/min离心30 min,取上清液采用分光光度计测定吸光度,测定波长定为620 nm,计算EB的含量。
1.2.5 PI染色 术后24 h,动物麻醉后仰卧固定,取自体血与PI溶液2 μl混匀,快速注入心脏10 min,开胸暴露心脏,从左心室把尖端磨平的16号针头插至主动脉根部,用丝线结扎,防止脱落,剪开右心耳放血。生理盐水冲洗至流出液变澄清为止,再以4 ℃的4%多聚甲醛溶液灌注固定。当肢体变硬,肢端及尾部的震颤消失时终止灌注。将脑置于4 ℃上述固定液中避光固定24 h,取出放入30%蔗糖中避光脱水,冰冻切片,片厚10 μm,荧光显微镜下观察。
1.2.6 行为学评分 术后72 h,采用Hua等[2]评分法进行神经功能评分,每只大鼠均进行前肢放置反射试验(Forelimb Placing Score)、前肢使用不对称试验(Forelimb Use Asymmetry Score)、转角试验(Corner turn Score)等3项神经功能测评。分值越高代表神经功能损害越轻,反之损伤越重。
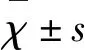
2 结 果
2.1 脑水肿观察和脑水含量检测 术后24 h电镜观察,ICH+Vehicle组血肿周围脑组织线粒体肿胀较Sham组明显,ICH+CsA 10 mg组血肿周围组织线粒体肿胀较ICH+Vehicle组、ICH+CsA 5 mg组轻,ICH+CsA 5 mg组血肿周围脑组织线粒体肿胀较ICH+Vehicle组轻(见图1)。术后24 h脑水含量检测,ICH+Vehicle组(79.32±0.17)血肿周围脑组织脑水含量较Sham组(77.55±0.12)高(P<0.05),ICH+CsA 10 mg组(78.57±0.06)血肿周围组织脑水含量显著较ICH+Vehicle组、ICH+CsA 5 mg组(78.96±0.10)低(P<0.05),ICH+CsA 5 mg组血肿周围脑组织脑水含量显著较ICH+Vehicle组降低(P<0.05)(见图2)。
2.2 血脑屏障通透性检测 术后24 h,ICH+Vehicle组(5.53±0.26)血肿周围脑组织血脑屏障破坏程度较Sham组(2.55±0.13)显著增高(P<0.05),ICH+CsA 10 mg组(3.24±0.16)血肿周围脑组织血脑屏障破坏程度较ICH+Vehicle组、ICH+CsA 5 mg组(4.12±0.12)显著降低(P<0.05),ICH+CsA 5 mg组血肿周围脑组织血脑屏障破坏程度较ICH+Vehicle组显著降低(P<0.05)(见图3)。
2.3 坏死细胞计数 术后72 h PI染色计数,ICH+CsA 10 mg组(69.33±11.31)血肿周围组织坏死细胞数显著较ICH+Vehicle组(399.00±12.43)、ICH+CsA 5 mg组(97.00±8.99)减少(P<0.05)(见图4)。
2.4 神经功能评分 术后72 h 3项神经功能测评方法的结果均提示:假手术组较ICH+Vehicle、ICH+CsA 5 mg、ICH+CsA 10 mg神经功能评分显著增高(P<0.05),ICH+Vehicle较ICH+CsA 5 mg、ICH+CsA 10 mg神经功能评分显著降低(P<0.05)(见图5)。

图1 术后24 h电镜扫描,A:Sham组;B:ICH+Vehicle组;C:ICH+CsA 5 mg组;D:ICH+CsA 10 mg组
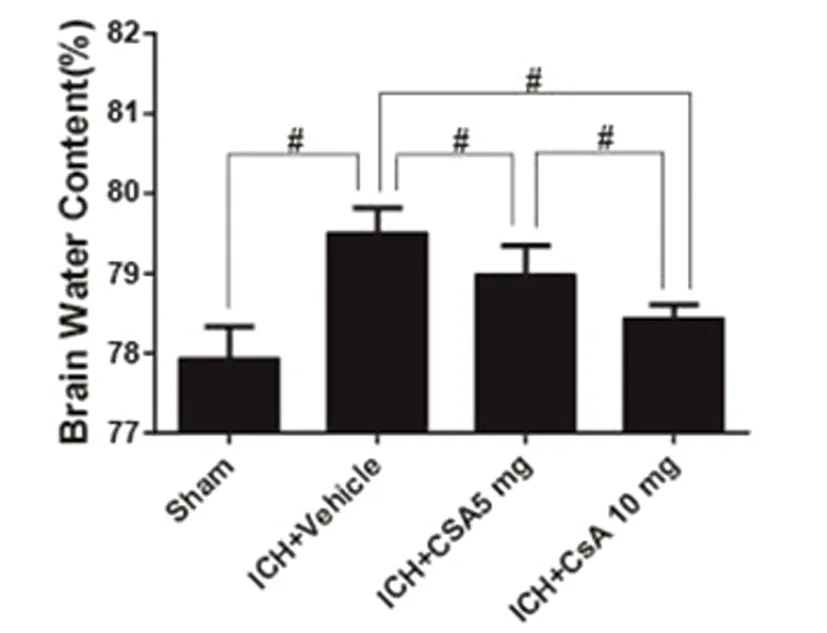
图2 术后24 h脑水含量变化示意图,ICH+Vehicle组显著较对照组高,药物处理组显著较ICH+Vehicle组低。#号代表两组比较有统计学意义(P<0.05)
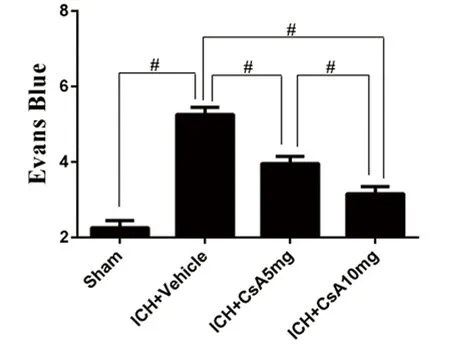
图3 术后24 h伊文思蓝变化示意图,ICH+Vehicle组显著较Sham组差,药物处理组显著较ICH+Vehicle组佳。#号代表两组比较有统计学意义(P<0.05)

图4 术后72 h PI染色示意图及结果示意图,A:Sham组;B:ICH+Vehicle组;C:ICH+CsA 5 mg组;D:ICH+CsA 10 mg组;A、B、C、D黑色箭头指示坏死细胞。药物处理组显著较ICH+Vehicle组坏死细胞少。**号代表两组比较有统计学意义(P<0.05)
3 讨 论
本实验研究发现,在大鼠脑出血早期,血肿周围脑组织含水量显著增加、血脑屏障显著破坏、坏死细胞显著增多,导致大鼠神经功能评分显著降低;而在脑出血后CsA早期应用能够降低脑组织含水量、改善血脑屏障通透性、抑制细胞坏死、从而改善大鼠的神经功能评分。这些结果表明,CsA早期应用能够减轻血肿周围脑组织的受损程度,改善大鼠脑出血后的生活质量。
在大鼠脑出血实验中,细胞坏死在早期脑损伤的发病机制中发挥关键作用[3]。脑损伤早期坏死会涉及脑细胞(神经元、星形胶质细胞、少突胶质细胞)和脑血管(平滑肌细胞、内皮细胞)的改变[4]。本实验在脑出血早期血肿周围脑组织中观察到细胞坏死的现象(见图4),PI染色发现脑出血+溶剂组血肿周边细胞坏死细胞显著增加,CsA早期应用后能够显著减少坏死细胞数,其中脑出血+CsA 10 mg组减轻效应较脑出血+CsA 5 mg组更明显,表明细胞坏死与早期脑损伤有密切联系。在神经系统疾病中。细胞坏死程度和脑水肿被视为脑出血预后不佳的两个主要因素[5]。本实验中脑出血+溶剂组术后24 h血肿周围脑水肿明显加重、脑组织含水量显著增加、血脑屏障通透性显著破坏[6]。而CsA早期应用能够显著减轻脑水肿、降低脑组织含水量、改善血脑屏障通透性,其中脑出血+CsA 10 mg组减轻脑水肿、降低脑组织含水量、改善血脑屏障破坏的作用均较脑出血+CsA 5 mg组更明显(见图2、图3),即高剂量组能够达到更佳的治疗效果。
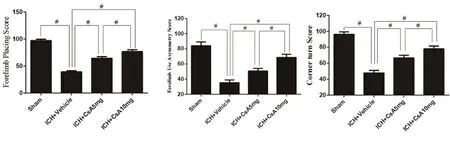
图5 前肢放置反射试验(F=18.92,P=0.00);前肢使用不对称试验(F=117.210,P=0.00);转角试验(F=116.960,P=0.00)
CsA通过结合细胞亲环蛋白D(Cyclophilin D;CYPD)抑制线粒体膜通透性转换孔(mitochondrial permeability transition pore,mPTP)的开放,阻止诱导凋亡因子核转位而诱发染色质凝集、变性、坏死,进而导致神经元坏死。因此,这些级联反应事件发生,脑实质和脑血管的坏死,最终导致细胞坏死[7]。本实验电镜观察ICH后血肿周围脑组织神经元中线粒体明显肿胀(见图1),CsA早期应用后,治疗组线粒体肿胀程度显著减弱,但高剂量组仍优于低剂量组,表明CsA可能还具有剂量依赖性的相关特性的特点[8]。
CsA作为线粒体靶向保护剂,不同于其他凋亡和坏死抑制剂,它能够直接结合CypD。CypD是位于线粒体mPTP的一个重要的调节分子,可能是细胞坏死下游的一个靶点分子[9]。CsA通过结合CypD抑制mPTP开放,从而维持线粒体内稳态平衡,保护线粒体膜的完整性[10,11],抑制坏死相关蛋白释放从而抑制细胞坏死,进而降低血脑屏障通透性,改善脑水肿和神经行为缺陷,达到神经保护作用。
本研究表明CsA早期应用能够减轻实验性脑出血大鼠脑水肿,改善血脑屏障通透性,抑制细胞坏死,改善神经功能评分。CsA对脑出血后早期脑损伤的神经保护作用,可能是CsA通过结合CypD抑制mPTP的开放,阻止神经细胞坏死。随着对这一机制进一步深入的研究,相信对脑出血改善早期脑损伤带来新的希望。
