ULK1基因调节氧糖剥夺所致的SH-SY5Y细胞自噬性死亡
2019-10-16郭文旭尹昌浩葛鹏飞关亚新
郭文旭,尹昌浩,葛鹏飞,关亚新
缺血性脑卒中是导致成年人死亡和长期残疾的主要原因之一[1,2],约占所有卒中患者的87%[3]。目前,静脉溶栓是改善急性缺血性卒中后果的最有效的药物治疗方法。然而,溶栓治疗具有一定的时间窗限制并且可能诱发多种并发症。因此,治疗缺血性卒中需要更好的方法,减少缺血性损伤被认为是治疗它的有效措施。
自噬是生物体在进化上相当保守且对细胞稳态具有高度调节作用的一种过程,通过该过程细胞内的大分子物质及受损的细胞器被溶酶体系统进行降解[4]。自噬在细胞命运的调节中可能起着双重调节作用。一方面,在细胞内部或外部的压力下,自噬过程促使细胞存活下来,如自噬通过保护脑组织免受癫痫、神经退行性疾病及阿尔兹海默病引起的损害[5~7]。另一方面,过度的细胞自噬通过细胞内相关蛋白及重要细胞器的过度自我降解触发了非凋亡的程序性死亡(即自噬性死亡),如海藻糖通过抑制活性氧(ROS)依赖性的内质网应激和AMPK的激活,阻止了SH-SY5Y细胞自噬性死亡[8]。海藻糖通过保护蛋白酶体的活性抑制SH-SY5Y细胞免受OGD诱导的自噬损伤[9]。尽管越来越多的证据表明自噬与缺血性脑卒中、头部损伤及短暂性脑缺血引发的脑损伤病理过程有关[10~12],但对于死亡性自噬的具体机制并未完全阐明,考虑到自噬性死亡是导致神经元缺血性损伤的一种途径[9],本研究将引用自噬流这一概念,应用siRNA技术体外模拟脑缺血引起的神经元损伤来进一步阐述自噬的具体机制,从而为临床上减轻缺血性脑损伤提供了一个新的理论依据。SH-SY5Y细胞是人源多巴胺能神经母细胞瘤细胞,在形态学、神经化学和电生理学特性方面与神经元极为相似,并已被广泛应用于评估神经退行性疾病,脑缺血/再灌注及癫痫引起的神经元损伤或死亡[13]。
1 资料与方法
1.1 试剂 3MA(3-甲基腺嘌呤)(selleck公司 美国),细胞缺氧培养装置(比卢普斯罗森堡公司,美国),MTT购买(碧云天,中国),小RNA干扰 ULK1(siRNA ULK1)(吉玛基因 中国上海)。stubRFP-sensGFP-LC3 Lentivirus试剂(吉凯基因化学技术有限公司 中国上海),抗P-ULK1抗体、抗ULK1抗体、抗Beclin1抗体(CST公司 美国)、抗LC3抗体(sigma公司 美国)、抗P62抗体(abcam公司 美国)、β-actin抗体(Santa Cruz公司)。
1.2 细胞系及细胞培养 SH-SY5Y细胞获自中国科学院上海细胞生物学研究所(中国上海)。细胞培养使用10%胎牛血清、青霉素(100 U/ml)和链霉素(100 μg/ml)的DMEM中培养,并置于在37 ℃和5% CO2潮湿的孵箱中,每周更换培养基两次。
1.3 MTT法检测细胞生存率 将对数期生长的SH-SY5Y细胞以每孔(4~5)×103接种到96孔板中,待细胞贴壁后依次加入不同的抑制剂并进行OGD相关处理。于每孔加入20 μl的MTT溶液,培养4 h,弃去培养基加入150 μl二甲基亚砜(DMSO),摇匀并使用于酶标仪设置参数为OD 490 nm处读取每个样品的吸光度值。计算细胞存活率公式:细胞存活率%=样品组吸光度/对照组吸光度×100%。
1.4 使用SiRAN沉默ULK1基因 将对数期生长的SH-SY5Y细胞(1×104)接种到6孔板中。待次日细胞完全贴壁,更换为无双抗、无血清的培养基饥饿处理6 h,再使用已配置好的Lipofectamine 3000(Invitrogen,USA)、siRNA ULK1转染试剂处理48 h,随后将细胞进行氧糖剥夺24 h并用于随后的实验。
siRNA序列信息为:
ULK1-homo-511:-GGUACCACCAGAGCAACAU-
TT-(5’-3’)
Negative Control:-AUGUUGCUCGGGAGGGACCTT-(5’-3’)
1.5 慢病毒转染SH-SY5Y细胞 选择状态良好的SH-SY5Y细胞,严格遵循试剂说明书将密度为(3~5)×104个/ml的细胞悬液种植于2.5 cm的培养皿中,置于细胞孵箱中常规培养。参考说明书中的体积更换培养基并加入相应感染增强液,将细胞置于37 ℃孵箱中培育12~16 h后,常规培养。依据汉恒生物慢病毒stubRFP-sensGFP-LC3 Lentivirus使用说明,LC3绿色荧光对于酸性环境下具有不稳定性,在自噬体与溶酶体融合后,在溶酶体内的酸性水解酶作用下,LC3绿色荧光发生淬灭,LC3红色荧光存在。检测自噬流开放通过观察同一个细胞红色荧光多于绿色荧光来证明。
1.6 氧糖剥夺实验模型 将对数期生长的细胞7×103接种到96孔板中,于次日对已贴壁的细胞更换为无血清,无糖培养基,然后,放入缺氧培养装置中并充入已配好的5%CO2和95%N2组成的混合气体,并置于37 ℃的恒温孵箱中24 h。
1.7 Western blotting法检测各组细胞中相关蛋白的变化 使用1500r/min收集各组细胞,并使用PBS清洗两次,依照细胞的数量加入细胞裂解液于冰上裂解0.5 h,使用BCA法测量并调平蛋白浓度,加入5×上样缓冲液100 ℃煮沸10 min并于4 ℃保存。将等量的蛋白质在8%聚丙烯酰胺(SDS)凝胶上电泳并转移到聚偏氟乙烯(PVDF)膜(Millipore,Billerica,MA,美国),并与5%的脱脂奶粉于室温孵育2 h,剪切相应的蛋白条带孵育抗LC3(1∶1000)、抗ULK1(1∶1000)、抗P-ULK1(1∶1000)于4 ℃冰箱过夜,次日,PBST洗涤3次,每次10 min,然后将免疫印迹膜与辣根过氧化物酶缀合的抗小鼠(1∶2000)或抗兔IgG(1∶2000)在室温下孵育2 h。最后使用ECL进行曝光显影。使用Image J进行灰度分析,灰度结果=目的蛋白灰度/β-actin。
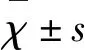
2 结 果
2.1 光镜下各组SH-SY5Y细胞形态学变化与特征 与正常对照组细胞相比,正常实验组细胞无明显差异,生长良好,形态成类三角型。与正常对照组相比,OGD对照组的细胞大部分变圆,细胞触角消失。与OGD对照组相比,OGD实验组中细胞状态略好,部分细胞变圆,部分细胞处于正常形态(见图1)。
2.1.1 各组SH-SY5Y细胞存活率 与正常对照组(100%)相比,正常实验组的细胞存活率为(0.98±0.01)(P<0.01)。OGD对照组的细胞存活率为(0.55±0.03)(P<0.01)。OGD实验组的细胞存活率为(0.67±0.02)(P<0.01)(见图2)。
2.1.2 各组SH-SY5Y细胞中ULK1、P-ULK1、Beclin1、LC3、和P62蛋白表达水平 与正常对照组相比,正常实验组细胞中P-ULK1、Beclin1、LC3、和P62蛋白均未见明显变化(P<0.01),其余各组中ULK1蛋白水平均未见显著变化(P<0.01)。与正常对照组相比,OGD对照组细胞中P-ULK1、Beclin1、LC3蛋白表达水平明显升高(P<0.01),P62蛋白水平降低(P<0.01)。与OGD对照组相比,OGD实验组细胞中P-ULK1、Beclin1、LC3蛋白表达水平明显降低(P<0.01),P62蛋白水平升高(P<0.01)(见图3)。


A:Normal control group;B:3 mmol/L,3MA group;C:OGD group;D::3 mmol/L,3MA+OGD group
图1 各组SH-SY5Y细胞形态学表现(×20)

2)P<0.01 compared with control group;3)P<0.01 compared with control group;4)P<0.01 compared with OGD group
图2 MTT检测各组细胞存活率



Lane 1:coutrol group;Lane 2:3 mmol/L,3MA group;Lane 3:OGD group;Lane 4:3 mmol/L,3MA+OGD group
2)P<0.01 compared with control group;3)P<0.01 compared with control group;4)P<0.01 compared with OGD group
图3 各组细胞中P-ULK1、ULK1、Beclin1、LC3、和P62蛋白表达电泳图
2.2 应用慢病毒感染SH-SY5Y细胞后荧光显微镜观察同一细胞内LC3红绿荧光蛋白数量差异变化 与OGD处理0 h组细胞中红色荧光个数(0±1)相比,OGD处理0 h组的细胞中绿荧光蛋白数量(0±1)(P<0.01)无明显差异。与OGD处理6 h组细胞中红色荧光个数(3±5)相比,OGD处理6 h组的细胞中绿荧光蛋白数量(3±5)(P<0.05)无显著差异。与OGD处理12 h组细胞中红色荧光个数(12±17)相比,OGD处理12 h组的细胞中绿荧光蛋白数量(12±18)(P<0.05)无显著差异。与OGD处理24 h组细胞中红色荧光个数(23±27)相比,OGD处理24 h组的细胞中绿荧光蛋白数量(7±9)(P<0.05)显著降低(见图4)。
2.3 检测各组细胞的存活率 与空转组(100%)相比,scrambled组细胞存活率为(0.98±0.01)(P<0.01)。ULK1 SiRNA组细胞存活率为(0.96±0.02)(P<0.01)。OGD的空转组细胞存活率为(0.55±0.03)(P<0.01)。OGD的scrambled组细胞存活率为(0.54±0.04)(P<0.05)。OGD的ULK1 SiRNA组细胞存活率为(0.64±0.03)(P<0.01)(见图5)。
2.3.1 各组SH-SY5Y细胞中UKL1、P-ULK1、Beclin1、LC3、和P62蛋白表达水平 与ULK1 SiRNA组的ULK1、p-ULK1蛋白相比,空转组和Scrambled SiRNA组的细胞中ULK1、P-ULK1蛋白水平均明显升高(P<0.01)。与OGD的ULK1 SiRNA组ULK1、P-ULK1蛋白相比,OGD的空转组和OGD的Scrambled SiRNA组中ULK1、P-ULK1蛋白水平均显著升高(P<0.01)。与ULK1 SiRNA组的LC3、beclin-1、P62蛋白相比,Scrambled SiRNA组和空转组的LC3、beclin-1、与P62蛋白均未见明显变化(P<0.01)。与OGD的SiRNA ULK1组细胞LC3、beclin-1、与P62蛋白相比,OGD的空转组和OGD的Scrambled SiRNA组细胞中LC3、beclin-1蛋白表达水平显著增高(P<0.01),P62蛋白水平明显下降(P<0.01)(见图6)。

A:OGD treatment 0 h;B:OGD treatment 6 h;C:OGD treatment 12 h;D:OGD treatment 24 h
A)P<0.01;B)P<0.05;C)P<0.05 red fluorescence compared with green fluorescence;D)P<0.05 red fluorescence compared with green fluorescence
图4 使用荧光显微镜观察0 h、6 h、12 h和24 h后细胞中LC3红绿荧光蛋白差异

2)P<0.01,3)P<0.01,4)P<0.01,6)P<0.01 compared with control group;5)P<0.05 compared with control group
图5 MTT检测各组细胞存活率



Lane 1:coutrol group;Lane 2:Scambled SiRNA group;Lane 3:ULK1 SiRNA group;Lane 4:OGD group;Lane 5:OGD+Scambled SiRNA group;Lane 6:OGD+ULK1 SiRNA group
1)P<0.01;2)P<0.01 compared with SiRNA ULK1 group;4)P<0.01,5)P<0.01 compared with OGD SiRNA ULK1 group
图6 各组细胞中P-ULK1、ULK1、Beclin1、LC3、和P62蛋白表达电泳图
3 讨 论
自噬是一种高度保守的蛋白质/细胞器降解系统,负责长期存活的蛋白质的转换和处理多余或受损的细胞器,以维持细胞的稳态[14,15]。本研究通过对SH-SY5Y细胞进行OGD作用24 h发现,细胞死亡率显著升高,细胞中的P-ULK1、Beclin-1、LC3蛋白表达水平显著升高,P62蛋白水平下降,应用3MA自噬抑制剂可以降低细胞的死亡率以及P-ULK1、Beclin-1、LC3蛋白表达水平,挽救了自噬底物蛋白P62的下降。这说明OGD诱导SH-SY5Y细胞自噬水平增强,并最终导致细胞死亡。
ULK1作为自噬途径的起始蛋白,激活自噬起始复合体,并参与自噬膜的延伸,最终形成成熟的自噬体。研究表明,ULK1在自噬过程中参与多种机制的调节,如白藜芦醇通过激活AMPK/ULK1途径和下调mTOR1位点,诱导自噬维持MESC的多能性[16]。ESCs通过依赖AMPK提高ULK1的磷酸化增强自噬水平,平衡能量与生物合成需求,促进细胞复制和自我更新[17]。ULK1蛋白水平可以通过多种刺激进行调节,如营养耗竭、能量缺乏和缺氧等[18~20]。在营养缺乏的初始阶段,ULK1蛋白即可被诱导并提高转录水平,而ULK1蛋白主要是通过泛素化蛋白酶体途径进行降解的[21,22]。在之前的研究中发现,OGD可以显著诱导并降低SH-SY5Y细胞蛋白酶体的活性[9],ULK1蛋白的持续积累,导致自噬过程持续存在。本实验应用ULK1基因沉默后,显著降低OGD诱导的P-ULK1、Beclin1、LC3蛋白在SH-SY5Y细胞中的表达。升高P62蛋白的表达水平;同时能显著降低OGD诱导SH-SY5Y细胞的死亡率。结果表明沉默ULK1基因降低自噬相关蛋白的表达,进而抑制自噬过程减少了OGD所致SH-SY5Y细胞的死亡。使用荧光显微镜观察转染慢病毒的SH-SY5Y细胞,随着OGD处理的时间逐渐延长,细胞中红色荧光蛋白LC3在0 h、6 h、12 h、24 h表达明显增多,绿色荧光蛋白在OGD处理0 h、6 h、12 h之前是逐渐增加的,而在24 h时,绿色荧光蛋白数量淬灭。根据红绿荧光的不同可以发现OGD作用24 h可能诱导SH-SY5Y细胞自噬流开放,导致细胞过度的自我降解,触发了非凋亡的程序性死亡(即自噬性死亡)。
综上所述,OGD可以诱导SH-Y5Y细胞自噬,并最终诱导自噬流开放引起过度自噬,敲除ULK1基因或应用自噬抑制剂可以降低细胞内的自噬水平进而阻断细胞自噬性死亡。这为临床上通过抑制自噬过程治疗脑缺血性神经损伤提供实验支持,为减缓脑神经缺血损伤提供一个潜在的治疗靶点。
