两种多吡啶钌异构体用于抑制Aβ42纤维化和降低Aβ42细胞毒性的研究
2019-10-16李贞华张园芳张黔玲师红东
王 彤,李贞华,张园芳,王 祎,张黔玲,师红东
阿尔茨海默病(Alzheimer disease,AD)是一种渐进性发展致死性神经退行性疾病。随着我国人口老化,患AD的人数不断增加,对老年人的身心健康、社会和家庭造成了严重的影响和负担[1]。AD的发病机制复杂,其主要病理机制学说有β淀粉样蛋白级联学说、tau蛋白学说、中枢胆碱能损伤学说、兴奋谷氨酸毒性学说等[2~4]。目前被较多认可的是β淀粉样蛋白级联学说(amyloid cascade hypothesis),其观点是β-淀粉样肽(amyloid peptide,Aβ肽)在脑部组织中聚集形成沉淀或纤维化,从而导致中枢神经系统损伤[5,6]。因此,抑制Aβ单体发生错误折叠或聚集有望减缓AD的发生发展。
目前已报道的Aβ抑制剂主要包括过渡金属配合物、短肽、有机分子、多金属氧酸盐、纳米粒子以及配体功能化量子点等[7~10]。2008年,含邻菲罗啉或其衍生物的铂配合物(Pt LCl2)被报道能够抑制Aβ聚集,由此开启了过渡金属配合物作为Aβ抑制剂的研究。这些铂配合物通过共价键与Aβ中的金属结合位点(His-6、-13,-14)结合,配合物中的平面芳香环邻菲罗啉配体与Aβ的N端疏水区域发生疏水作用,从而能够有效地抑制Aβ42的聚集并降低神经毒性。后来,钌、铱、铑等过渡金属配合物也被研究用于抗AD治疗[11~13]。在这些过渡金属配合物中,钌配合物具有优良的化学稳定性和独特的光物理、电化学性质,并且毒性较低。此外,钌配合物一般具有6配位八面体构型,配合物中的配体可以任意改变,这样可以使其结构具有多样性,满足不同性能的设计要求,因此,钌配合物非常适合用于抑制Aβ聚集的研究[14]。本论文中选择了两种在不同位置具有双羟基取代基的结构相似的多吡啶钌配合物Ru[(phen)2(DHOPIP)]2+(p23OH)和Ru[(phen)2(DHMPIP)]2+(p25OH),通过ThT荧光、TEM、AFM、MTT等方法研究了这两种钌配合物对Aβ42纤维化的抑制,探讨了羟基取代基位置不同所引起的性质差异,为钌配合物作为Aβ抑制剂的研究提供一定的理论依据。
1 材料和方法
1.1 细胞株和主要试剂 PC12(大鼠肾上腺嗜铬细胞瘤细胞株来源于深圳大学生命与海洋科学学院),用含10%胎牛血清的DMEM培养基培养,并置于5%二氧化碳的37 ℃ 培养箱中培养,取对数生长期细胞进行实验。胰蛋白酶(Biosharp);磷钨酸(麦克林,上海);噻唑蓝(MTT,sigma-Aldrich,美国),5 mg/ml 4 MTT溶液配制:在净化工作台中,将0.2500 g 噻唑蓝固体粉末溶解于50 ml无菌PBS缓冲液中,并用0.22 μmol/L 的滤膜过滤。分装于1.5 ml EP管中,封口并避光保存于-20 ℃冰箱中,避免反复冻融;DMEM完全培养基(Hyclone,美国);胎牛血清(FBS,维特森公司,澳洲);双抗(青霉素-链霉素,Gibico,美国);磷酸盐缓冲液(10 mmol/L PBS,Hyclone,美国);硫黄素T(ThT,sigma-Aldrich,美国),1 mmol/L硫黄素T:用毫克天平秤取3.189 mg硫黄素T固体粉末于15 ml离心管中,并用10 ml无菌PBS溶解,避光保存于4 ℃冰箱中;
1.2 实验方法
1.2.1 配合物的合成 基于已报道的过渡金属配合物抑制Aβ42的研究,本论文以毒副作用较低的钌作为金属中心,以具有芳香环的邻菲罗啉(phen)及2-苯基咪唑并[5,6-f]-1,10邻菲罗啉(PIP)为配体,并在PIP配体上的不同位置上增加了两个羟基,合成了两种结构相似的钌配合物Ru[(phen)2(DHOPIP)]2+(p23OH)和Ru[(phen)2(DHMPIP)]2+(p25OH),配合物的结构见图1。
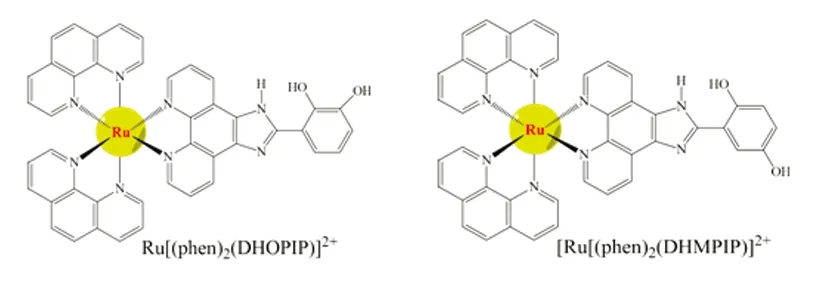
图1 p23OH和p25OH的化学结构式
1.2.2 钌配合物的光谱性质研究 采用紫外可见吸收光谱和荧光光谱研究了两种钌配合物Ru 1和Ru 2的光谱学性质。配合物的浓度为5 μmol/L,使用岛津紫外分光光度计(UV-2450)进行紫外光谱表征,扫描波长为200~700 nm,扫描数据采取间隔为0.2 nm;使用日立荧光发射光谱仪(F7000)进行荧光光谱表征,配合物的激发波长为450 nm,扫描速度为1200 nm/min,发射和吸收光谱狭缝宽为5 nm,PMT Voltage为500。
1.2.3 PC12细胞培养 将PC12细胞放在含有89%DMEM、10% FBS和1%双抗的培养液中,并置于37 ℃、饱和湿度为5% CO2的培养箱进行培养。待细胞长满时,用0.25%的胰酶将细胞消化后,加入培养液吹打均匀,调整细胞密度约为5×106,吸取900 μl细胞悬浮液于2 ml冻存管中并加入100 μl DMSO,轻轻吹打均匀并封口后进行程序性降温:4 ℃存放30 min,-20 ℃存放2 h,最后置于-80 ℃冰箱中冻存进行保种。复苏细胞时,将细胞从-80 ℃取出后置于37 ℃水浴锅至融化,于超净台中将含有细胞的培养液转移至1.5 ml 离心管中,用封口膜封住。1000 r/min离心5 min后在超净台中吸除上清液,加入1 ml培养液吹打均匀后转移至25 cm2培养瓶中并另外加入4 ml培养液进行培养。
1.2.4 MTT法检测细胞毒性 收集对数生长期细胞制备成细胞悬液(细胞密度约为2×104/ml),将细胞接种于透明96孔板(每孔约5×103个细胞),边缘孔用无菌PBS缓冲液填充,每孔总体积均为100 μl。设置调零孔、对照孔及加药孔。空白孔为培养液、对照孔及加药孔为细胞悬浮液,并置于5% CO2、37 ℃培养箱中培养24 h。待细胞贴壁后,对加药孔进行加药,并设置4个复孔。在终止培养前4 h,向每孔加入15 μl MTT溶液(5 mg/ml)。终止培养时,小心吸除孔内培养液,向每孔加入150 μl DMSO,并置于摇床低速振荡10 min。最后,用酶标仪检测OD为570 nm处测量各孔的吸光值。细胞活性计算公式为:

1.2.5 Aβ42预处理 将2.5 mg Aβ42溶于550 μl冷却的六氟异丙醇(HFIP)中,充分震荡后,置于4 ℃摇床中摇晃6 h,使Aβ42充分溶解(单体形态),均等分装于5个EP管中,在-80 ℃冰箱中保存。使用前从-80 ℃冰箱取出至冰上溶解后,于冰水浴中超声2×10 min,并在通风橱中于冰上将EP管盖打开,用流速较小的N2吹干,使HFIP充分挥发,管壁内形成透明的Aβ42蛋白膜。再加入55 μl DMSO充分震荡后于16 ℃水浴中超声10 min,制备成2 mmol/L的Aβ42单体溶液,并根据需要用10 mmol/L PBS(pH 7.4)稀释至所需浓度。
1.2.6 ThT荧光实验 ThT广泛用于Aβ42聚集动力学的监测。取黑色96孔板,设置好对照孔、加药孔、背景孔(不加Aβ42),并设置4个复孔,每孔总体积为150 μl,Aβ42加入后即刻于多功能全波长酶标仪检测485 nm处荧光值(激发光波长为445 nm)。固定Aβ42终浓度为20 μmol/L,通过改变体系中钌配合物的终浓度(2 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L),研究钌配合物对Aβ42聚集的影响及钌配合物与Aβ42的作用过程。
1.2.7 原子力显微镜(AFM) 将孵育24 h后的Aβ42及Aβ42-配合物的孵育液(各物质浓度均为20 μmol/L)均稀释至1 μmol/L,移取5 μl稀释液均匀滴于新鲜剥离的云母片上,静置5 min后用二次蒸馏水轻轻洗涤2次并置于干燥皿中干燥过夜,最后使用原子力显微镜进行观察,扫描模式为tapping mode。
1.2.8 透射电镜(TEM) 移取10 μl孵育24 h后的孵育液(各物质浓度均为20 μmol/L)滴于普通微栅支持膜上,静置20 min后用滤纸从铜网边缘吸干,滴加10 μl 1.5%的磷钨酸(pH 7.4),静置10 min后用滤纸从铜网边缘吸干,并置于干燥皿中干燥。最后使用透射电镜对样品进行观察,操作电压为80 kV。
1.2.9 可溶性Aβ42含量测定 配制钌配合物Aβ42浓度均为20 μmol/L 的孵育液在37 ℃进行孵育,并设置对照组。取不同时间段(6 h、24 h、48 h、96 h)的孵育液进行13800 r/min离心20 min,取上清液进行BCA蛋白定量,每个样平行4个复孔。
1.2.10 Aβ42内部荧光滴定实验 配制终浓度为22 μmol/L 的Aβ42单体溶液700 μl,PBS为缓冲液体系,于荧光发射光谱仪记录270 nm激发下的发射光谱(290~380 nm),设定扫描速度为1200 nm/min,发射和吸收光谱狭缝宽为5 nm,PMT Voltage为500。并随后逐次加入5 μl钌配合物、混匀并放置1 min,直至体系荧光几乎不再变化。计算配合物与Aβ42的淬灭常数、表观结合常数和结合位点。
2 结 果
2.1 p23OH和p25OH的光谱性质表征 p23OH和p25OH的紫外吸收光谱图和荧光发射光谱图比较相似(见图2),均在262 nm处有一个IL(Interligand)峰,在450 nm处有一个MLCT(Metal Ligand Charge Transfer)峰;在450 nm光激发下,两个钌配合物均在579 nm处出现最大发射峰。
2.2 p23OH和p25OH能够抑制Aβ42聚集 设定Aβ42的终浓度为20 μmol/L,改变配合物的浓度,采用ThT荧光法研究不同浓度的两种配合物对Aβ42聚集的影响(见图3)。实验结果表明,与钌配合物共同孵育后,在前200 min内,Aβ42体系中ThT的荧光强度迅速增加,并在约300 min时ThT荧光值达到最大,然后基本保持稳定不变。随着配合物浓度的增加,相同时间下ThT的荧光强度增强。改变钌配合物的浓度分别为2 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、和30 μmol/L,与Aβ42共同孵育24 h后,p23OH对Aβ42纤维体形成的抑制率分别位46.49%、58.96%、76.53%、91.35%、96.00%;p25OH对Aβ42纤维体形成的抑制率分别22.54%、27.48%、48.97%、78.79%、84.40%。可见,在相同的实验条件下,p23OH抑制Aβ42聚集的能力明显高于p25OH。
2.3 p23OH和p25OH抑制Aβ42聚集的形貌观察 采用AFM和TEM研究了钌配合物对Aβ42聚集的影响(见图4)。从AFM实验结果中可以明显看出,在没有钌配合物的存在下,Aβ42形成了密集的分支状纤维体,形成明显的纤维状网络。而在p23OH或p25OH配合物存在时,体系中观察不到纤维状的Aβ42,主要以一些小颗粒存在,猜测为小分子量的寡聚体,且颗粒分子相对较少。TEM的实验结果中也可以看出,在没有钌配合物的存在下,Aβ42形成了明显的聚集体,而在钌配合物存在下,只有分散的颗粒存在。这些结果说明钌配合物可以有效地抑制Aβ42聚集。
2.4 可溶性蛋白含量的测定 纤维化的Aβ蛋白或高分子量的Aβ寡聚体容易被高速离心沉淀下来,而可溶性的Aβ单体及低分子量寡聚体则会存留在上清液中。因此,本论文通过BCA蛋白定量法,取不同时间段(6 h、24 h、48 h、96 h、120 h)的37 ℃孵育液(配合物、Aβ42浓度均为20 μmol/L)在13800 r/min转速下离心20 min,取上清液测试,确定体系中可溶性蛋白的含量,从而评估不同孵育体系中Aβ的聚集程度(见图5)。实验结果表明,随着孵育时间延长,各体系中可溶性蛋白的含量逐渐降低;相对于没有加入钌配合物的Aβ42体系,加了钌配合物的孵育液体系中可溶性蛋白的含量明显较高,且加了p23OH体系中的可溶性蛋白的含量稍高于加了p25OH体系。进一步延长孵育时间,所有体系中的可溶性蛋白含量都明显降低,这是由于Aβ本身具有较强的疏水性质,从而引起沉淀所致。
2.5 p23OH和p25OH降低Aβ42聚集导致的细胞毒性 为定性评估两种钌配合物的细胞毒性,我们采用MTT细胞毒性试验法,通过设置一系列钌配合物的浓度(2 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L),使其与PC12细胞共孵育24 h后,检测其细胞活性(见图6A)。实验结果表明,两种钌配合物均具有较低的细胞毒性,且p23OH的细胞毒性小于p25OH。配合物的细胞毒性与其浓度呈现正相关,其IC50分别为38.5 μmol/L 和28.5 μmol/L 。我们还做了配合物对Aβ42细胞毒性影响的研究。由于有大量研究表明金属离子,尤其Zn2+、Cu2+和Fe3+与Aβ聚集有密切关系,且可能增强Aβ的细胞毒性,因此我们研究在Cu2+存在下,有无p23OH或p25OH的情况下对Aβ42聚集导致的细胞毒性的影响(见图6B),Cu2+加入对Aβ42导致的细胞毒性影响较小;虽然p23OH和p25OH在10 μmol/L 下对细胞的抑制率约有80%,但加入p23OH或p25OH后,明显减少了Aβ42纤维化导致的细胞毒性,且p23OH作用比p25OH大,这一结果跟p23OH抑制Aβ42纤维化效果比p25OH好一致。说明p23OH和p25OH能够降低Aβ42聚集导致的细胞毒性。
2.6 Aβ42内部荧光滴定实验 含有芳香环的色氨酸、酪氨酸、苯丙氨酸具有自身荧光性质,因此含有酪氨酸残基的Aβ42多肽具有自发荧光性质,在270 nm光激发下,在290~380 nm范围内有荧光出现。当Aβ42与其它分子发生相互作用时会使自身荧光降低,荧光强度降低越明显,说明相互作用越强。向Aβ42体系中逐渐滴加钌配合物,研究了钌配合物与Aβ42的相互作用。设定激发波长为274 nm,向含20μmol/L 的Aβ42体系中逐步滴加钌配合物,随着钌配合物浓度的增大,体系的荧光强度逐渐下降(见图7)。采用Stern-Volmer动态荧光淬灭方程[15,16]:F0/F=1+Kqτ0[Q]=1+KSV[Q](F0和F分别表示有无淬灭剂时体系的荧光强度,Kq为荧光淬灭速率,τ0为荧光分子的荧光寿命,大多数生物分子的荧光寿命可认为是10-8s;KSV为荧光淬灭常数;[Q]为体系中淬灭剂的浓度)。对配合物与Aβ42间的淬灭方式进行表征,从(F0/F-1)-[Q]图中各数据点可以看出,Stern-Volmer曲线分成两段线性区间,说明钌配合物与Aβ42之间同时存在着动态荧光淬灭和静态荧光淬灭两种淬灭方式。且随着配合物浓度增加,Stern-Volmer曲线向y轴靠近,说明随着配合物浓度的增加,配合物对Aβ42的荧光淬灭愈加趋向于动态淬灭。以体系中钌配合物与Aβ42的浓度比([Ru]/[Aβ42])为0.3611作为分界点,对Stern-Volmer曲线进行分段线性拟合并求出各自相对应的Kq、KSV和R2(相关系数的平方)(见图7、表1)。由于两种钌配合物使Aβ42内部荧光淬灭的淬灭速率均大于2×1010,因此,p23OH和p25OH两种配合物使Aβ42荧光淬灭的方式主要为静态荧光淬灭。但是随着钌配合物浓度的增加,动态淬灭的效果逐渐增强。钌配合物对Aβ42的静态淬灭可利用公式log(F0/F-1)= logK+nlog[Qt](K:表观结合常数;n:结合位点数)来计算淬灭剂与荧光分子间的表观结合常数及结合位点数(见图8),两种钌配合物与Aβ42的log(F0/F-1)- log[Qt]曲线具有很好的线性相关,具体的线性方程及所求得的表观结合常数和结合位点数n见表2。从表中可见,两种钌配合物和Aβ42的表观结合位点数和结合常数都比较接近,且表观结合常数都小于0.08 mol/L。说明两种钌配合物与Aβ42的相互作用较弱,主要以非共价作用形成复合物,如静电作用、疏水作用和氢键作用等。
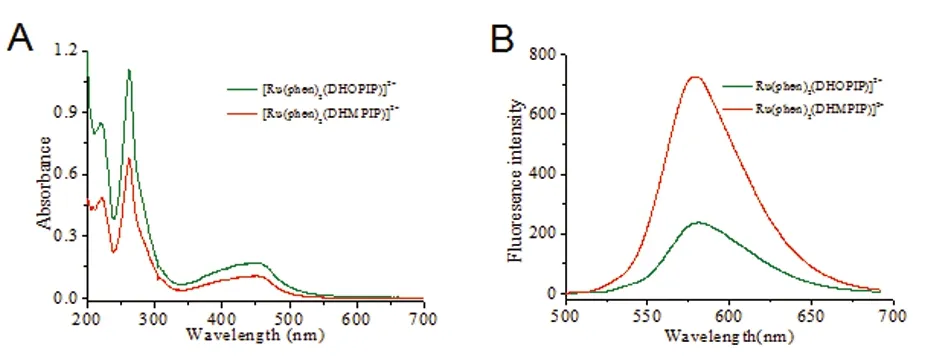
图2 Ru[(phen)2(DHOPIP)]2+和 Ru[(phen)2(DHMPIP)]2+的紫外吸收光谱图(A)及荧光发射光谱图(B)
图3 p23OH和p25OH配合物对Aβ42聚集的抑制动力学(Aβ42及ThT均为20 μmol/L,[Ru] = 2 μmol/L,5 μmol/L,10 μmol/L)

图4 TEM和AFM检测p23OH和p25OH配合物对Aβ42聚集的影响([Aβ42] = 20 μmol/L,[Ru] = 20 μmol/L)
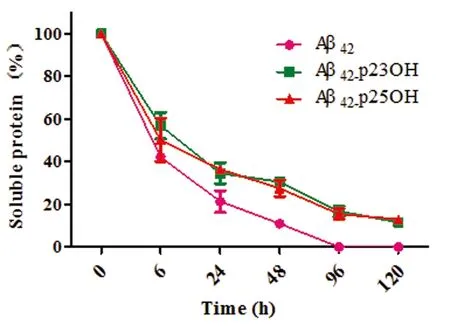
图5 钌配合物与Aβ42共同孵育不同时间段的可溶性蛋白含量
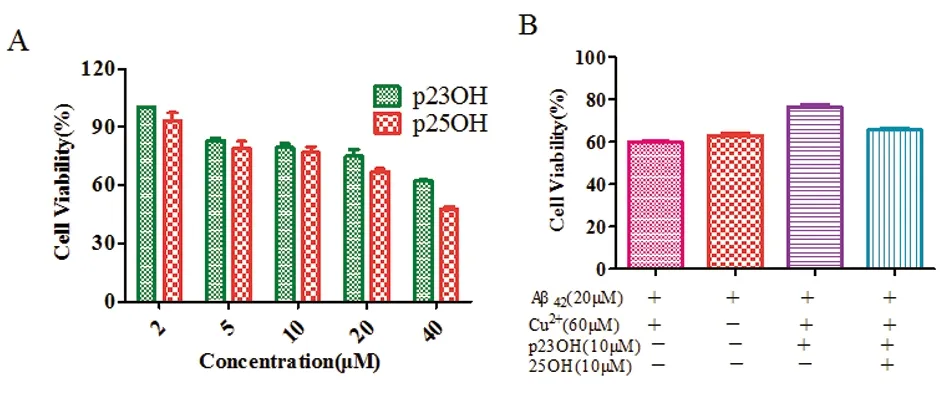
图6 A:不同浓度的p23OH或p25OH作用于PC12细胞24 h后的细胞活性;B:Aβ42在有无Cu2+及钌配合物存在下对PC12的细胞毒性的影响
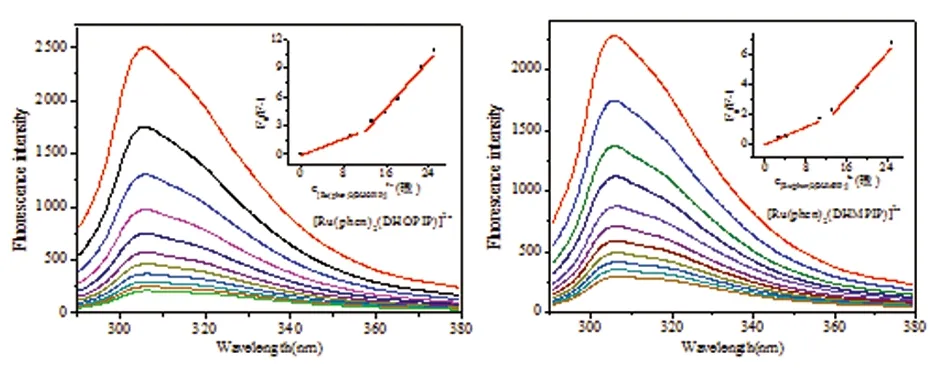
图7 钌配合物与Aβ42的荧光滴定谱图及Stern-Volmer方程的分段线性拟合

图8 静态荧光淬灭线性拟合

表1 Stern-Volmer方程分段线性拟合得到的荧光淬灭速率及淬灭常数

表2 配合物与Aβ42的表观结合常数和结合位点数
3 讨 论
随着人类寿命的增加,特别是我国人口老龄化的加剧,AD严重影响着我国人民的生命健康和生活质量。目前所使用的抗AD药物都只能起到缓解病情的作用,不能根治。因此,开发出能够有效预防AD的药物极为迫切。基于β-淀粉样蛋白级联学说,研发对Aβ聚集能够起到调控作用的Aβ调节剂是防治AD的有效策略,也是当今热门的研究课题。其中,Aβ调节剂可分为能够抑制Aβ聚集、对Aβ聚集体具有解聚作用、能够将Aβ转变为低毒聚集体等类型。近年来,越来越多的过渡金属配合物被报道具有抑制Aβ聚集的作用。其中,一些钌配合物被报道具有良好的抑制Aβ聚集的效果,并且有些钌配合物还同时具有抑制和监测Aβ聚集的双功能作用。与其它的金属配合物相比,钌配合物的毒性较低,是一种潜在的Aβ聚集调节剂,有望开发成为新型的AD药物。因此,深入开展钌配合物与Aβ的相互作用的研究,对寻找合适的Aβ聚集调节剂具有重要意义。
本论文选取含双羟基的两种钌配合物Ru[(phen)2(DHOPIP)]2+(p23OH)和Ru[(phen)2(DHMPIP)]2+(p25OH),通过ThT荧光、AFM、TEM和可溶性蛋白含量测定等方法研究了两种钌配合物对Aβ42纤维化的抑制效果。在ThT方法中,硫磺素T(ThT)能够特异性地识别、结合具有β片层的Aβ纤维体,从而使自身荧光显著增强,常用于检测Aβ聚集,体系中荧光强度越大,表明Aβ聚集体越多[17,18],反之荧光强度越低,表明Aβ聚集体越少,所以可以通过ThT荧光方法检测钌配合物对Aβ聚集的影响。结果显示两种钌配合物都能有效的抑制Aβ聚集,并且呈现出剂量关系,钌配合物的浓度越大,对Aβ42纤维化的抑制效果就越明显,而且p23OH抑制Aβ42聚集能力明显高于p25OH 。同时AFM和TEM结果直观表明在不加钌配合物的时候,Aβ42自身会快速聚集成纤维聚集体,而在p23OH和 p25OH存在下,极大地减少了Aβ42纤维化。可溶性蛋白含量测定也说明两种钌配合物能够有效降低Aβ42聚集,增加Aβ42的溶解性。Aβ在脑组织中聚集形成沉淀或纤维化,而对中枢神经细胞产生毒性,造成中枢神经损伤,细胞毒性实验结果说明,p23OH和 p25OH能够减弱Aβ42纤维化产生的细胞毒性。荧光滴定实验结果说明,两种钌配合物使Aβ42荧光淬灭的方式主要为静态荧光淬灭。随着配合物浓度的增加,动态淬灭的效果逐渐增强,静态淬灭效果减弱。两种钌配合物与Aβ42结合的表观结合常数都小于0.08 mol/L,说明两种钌配合物与Aβ42的相互作用较弱,主要以非共价作用形成复合物,如静电作用、疏水作用和氢键作用等。
综上所述,本论文中合成的p23OH和 p25OH配合物能够有效的抑制Aβ纤维化,减弱Aβ42纤维化产生的细胞毒性,说明这两种钌配合物在治疗AD方面可能具有潜在的应用前景。
