金黄色葡萄球菌二元调控系统vraSR基因敲除菌株的构建及其致病性研究
2019-10-15高彩虹戴媛媛常文娇马筱玲
高彩虹,戴媛媛,常文娇,马筱玲
金黄色葡萄球菌(以下简称金葡菌)是临床常见的病原菌,能引起从皮肤软组织感染到菌血症、肺炎、心内膜炎、深部脓肿等多种感染性疾病[1]。该菌易获得耐药性,从临床标本中分离的金葡菌约50%为耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)[2]。万古霉素是治疗严重MRSA感染的首选药物[3],但随着临床用量增加,低水平万古霉素耐药金葡菌开始出现,包括万古霉素中介金葡菌(vancomycin intermediateStaphylococcusaureus,VISA)和异质性万古霉素中介金葡菌(heterogeneous vancomycin intermediateStaphylococcusaureus,h-VISA)。研究[4]显示,hVISA/VISA感染的临床特点为细菌难以清除,感染症状持续存在,反复发作,给治疗带来极大困难。
VraSR(Vancomycin resistance-associated sensor regulator)是金葡菌万古霉素耐药相关感应二元调控子。研究[5]显示,VraSR的表达水平在hVISA/VISA中明显上升。附属基因调节因子(accessory gene regulator,agr)是金葡菌最重要的全局调控子,对毒力和生物膜均具有调控作用[6],前期研究[7]结果显示VraR蛋白可直接与agr启动子区域结合,提示VraSR可能具有广泛的调控作用。由此,该研究通过构建万古霉素异质性耐药标准菌(Mu3)vraSR基因敲除株、回补株以及小鼠皮肤感染模型,探讨VraSR表达在金葡菌致病中发挥的作用,以期为基于VraSR为靶点的hVISA/VISA感染诊断和干预策略提供理论依据。
1 材料与方法
1.1 材料
1.1.1菌株、质粒和动物 异质性万古霉素中介金葡菌(Mu3)和质粒pLI50由安徽医科大学第一附属医院李家斌教授馈赠;金葡菌RN4220为限制性内切酶缺陷菌株;温度敏感型穿梭质粒pKOR1和大肠杆菌DC10B由皖南医学院朱涛博士馈赠。昆明小鼠(Kunming mice,KM小鼠)购自安徽医科大学实验动物中心,雌性,6~8周龄。
1.1.2主要试剂及仪器 细菌基因组提取试剂盒、琼脂糖凝胶回收试剂盒、质粒抽提试剂盒购自天根生化科技(北京)有限公司;氯霉素、脱水四环素、溶葡萄球菌素购自生工生物工程(上海)股份有限公司;BP ClonaseTMⅡ Enzyme Mix购自美国Invitrogen公司;cDNA合成试剂盒和qRT-PCR试剂盒均购自日本TaKaRa公司;万古霉素药物敏感性试纸条购自法国梅里埃公司;胰蛋白胨大豆肉汤培养基(tryptic soy broth,TSB)、LB培养基购自英国Oxiod公司;Bio-Rad PCR仪、Bio-Rad凝胶成像仪购自美国伯乐公司;ABI7500型荧光定量PCR仪购自美国Applied Biosystems公司。
1.2 方法
1.2.1引物设计 根据GenBank中金葡菌Mu3基因组序列,利用Primer Premier 5.0软件设计vraSR基因上游片段引物(vraSR-UF、vraSR-UR)、下游片段引物(vraSR-DF、vraSR-DR), 所设计的引物由生工生物工程(上海)股份有限公司合成。见表1。

表1 引物序列
下划线分别代表attB1和attB2特异性位点;vraSR-UR和vraSR-DF中小写字母为上下游同源片段之间的互补序列;方框部分为限制性酶切位点
1.2.2金黄色葡萄球菌vraSR基因敲除株的构建 以金黄色葡萄球菌Mu3基因组DNA为模板,以引物vraSR-UF、vraSR-UR和引物vraSR-DF、vraSR-DR分别扩增上下游同源片段,具体引物序列见表1。使用融合PCR得到上下游序列相连的DNA序列。使用Gateway BP ClonaseTMⅡ Enzyme Mix(日本TaKaRa公司)试剂盒进行PCR产物与质粒的重组反应,按试剂盒说明进行操作。通过PCR及测序鉴定重组质粒pKOR1-vraSR是否正确。从大肠杆菌DC10B中抽提的重组质粒pKOR1-vraSR首先电转入(电转条件:电压2.5 kV,电容25 μF,电阻100 Ω)金黄色葡萄球菌RN4220中,从金黄葡萄球菌RN4220抽提的重组质粒以相同条件电转入金黄色葡萄球菌Mu3后,在42 ℃含10 μg/ml氯霉素的TSB培养基中多次传代(4~5 次),将菌液104倍稀释铺板到含1 μg/ml脱水四环素(ATc)的TSB平板上,37 ℃培养24 h。挑取50个菌落分别接种普通TSB平板和含10 μg/ml氯霉素的TSB平板,培养过夜。选择仅在TSB平板上生长的克隆抽提基因组DNA,使用引物vraSR-IF和vraSR-IR进行PCR扩增初步鉴定vraSR基因是否从基因上敲除成功,最后通过序列测定RT-PCR证明敲除株构建成功,敲除株命名为ΔvraSR。
1.2.3金黄色葡萄球菌CΔvraSR基因回补株的构建 首先构建金黄葡萄球菌vraSR基因表达质粒,使用表1中引物vraSR-C-F和vraSR-C-R扩增vraSR基因,使用sac I和Kpn I将vraSR基因克隆到穿梭质粒pLI50,获得重组质粒pLI50-vraSR。从大肠杆菌E.coliDH5α中抽提的重组质粒首先电转入金黄葡萄球菌RN4220中,从金黄葡萄球菌RN4220抽提的重组质粒再电转入ΔvraSR。电转条件同vraSR基因敲除株的构建,通过序列测定及RT-PCR证明回补成功。
1.2.4实时荧光定量PCR(RT-PCR) 收集对数生长期金葡菌Mu3、ΔvraSR和CΔvraSR。利用TRIzol试剂提取总RNA,按试剂盒操作说明逆转录成cDNA,再进行荧光定量PCR检测。使用的引物序列如下:vraSR-1(F):5′-TGTTGCTCTCAAAAACTGTTCAATA-3′,vraSR-1(R):5′-CCTATTCATATTGGTT-TCGGAA-3′;16sRNA-1(F):5′-CGTGCTACAATGGACAATACAAA-3′,16sRNA-2(R):5′-ATCTACGATTACTAGCGATTCCA-3′。以16sRNA mRNA表达水平作为内参,检测各菌株中vraSR基因的表达水平。
1.2.5小鼠皮肤脓肿模型的建立 参照文献[8]报道的方法,将金葡菌Mu3、ΔvraSR和CΔvraSR在37 ℃、220 r/min条件下培养至对数生长中期,收集细菌后用无菌PBS调节菌浓度至1×109CFU/ml,取50 μl金黄色葡萄球菌在小鼠背部进行皮下注射,每一菌株接种5只小鼠,对照组接种50 μl PBS。1周后将小鼠用4%水合氯醛麻醉后解剖观察并测量小鼠皮肤脓肿面积。
1.2.6平板法统计皮肤组织中的荷菌数 将皮肤组织充分研磨后的组织悬液经适当稀释涂布于血琼脂平板上,统计并计算皮肤组织中的荷菌数。
1.2.7石蜡切片的制备 使用皮肤采样器无菌采集感染后的皮肤组织,置于多聚甲醛固定过夜后,按照常规组织切片的方法制备石蜡切片,并进行HE染色。
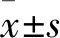
2 结果
2.1 Mu3中vraSR基因敲除株ΔvraSR和基因互补株CΔvraSR的构建Mu3与vraSR基因敲除株ΔvraSR基因组DNA以vraSR-IF和vraSR-IR为引物的PCR结果见图1A,以Mu3为模板,扩增PCR产物长度为1 755 bp,以vraSR基因敲除株DNA为模板,扩增PCR产物长度为100 bp。对vraSR基因敲除株进行回补后,Mu3与vraSR基因回补株CΔvraSR基因组DNA以vraSR-C-F和vraSR-C-R为引物进行PCR扩增(图1B), PCR产物长度均为1 662 bp。通过荧光定量分析Mu3、ΔvraSR、CΔvraSR菌株中vraSR基因的转录水平进行了确认,在vraSR基因缺失株中vraSR基因的转录完全缺失,对vraSR缺失株的质粒回补回复了vraSR基因的转录(t=17.7,P<0.001)(图1C)。以上结果均证明vraSR基因被敲除及回补成功。

图1 构建金黄色葡萄球菌vraSR基因敲除株及回补株
A:用PCR方法筛选vraSR基因敲除株;B:用PCR方法筛选vraSR基因回补株;M:2 000 bp DNA Marker;WT:野生株Mu3;2和3:CΔvraSR菌株;C:RT-PCR检测Mu3、ΔvraSR、CΔvraSR菌株中vraSR基因的mRNA表达水平;与ΔvraSR比较:***P<0.001
2.2 敲除vraSR基因降低金葡菌的致病性与Mu3菌株比较,ΔvraSR菌株接种小鼠后肉眼观察皮肤病变较轻,Mu3和ΔvraSR菌株的脓肿面积分别为(1.58±0.31)cm2、(0.71±0.15)cm2(t=5.634,P<0.001)。CΔvraSR株形成脓肿面积为(1.15±0.30)cm2(t=2.864,P<0.05),表明回补vraSR基因后增加金葡菌致病性(图2A、2B)。另外,通过分析小鼠皮肤组织的菌负荷量显示,ΔvraSR株接种小鼠皮肤组织菌负荷量也显著减少(t=3.356,P<0.01)。回补vraSR基因后小鼠皮肤组织菌负荷量增加(t=2.521,P<0.05)(图2C)。取小鼠皮肤组织进行HE染色观察显示Mu3感染组小鼠皮肤组织病理损伤明显加重,主要表现为显著的炎性细胞浸润;而ΔvraSR感染组小鼠皮肤组织病理损伤较轻,未发现明显的炎性细胞浸润。以上结果表明,Mu3菌株中vraSR基因缺失可以明显降低金黄色葡萄球菌的致病性。
3 讨论
二元调控系统(two-component regulatory system,TCRS)是细菌中常见的信号转导系统,也是基因表达的重要调控系统。细菌可以利用TCRS调节毒力、代谢、营养等一系列生理过程,从而协助其适应外界环境,在细菌的致病性中发挥重要作用[9]。VraSR是一种与万古霉素耐药相关的二元调控系统,在VISA/hVISA中高表达[5]。然而,目前对VraSR的研究均集中在耐药调控方面,其在金葡菌致病性中的作用尚未见报道。
本课题组采用pKOR1和 pLI50为载体,分别构建金葡菌vraSR基因敲除株及其回补株,并利用RT-PCR验证构建成功。pKOR1质粒的结构特点是有用于lambda重组的位点(attP1、attP2),可快速构建同源重组质粒,无需人为导入抗生素抗性基因,可避免影响其他基因功能。质粒pKOR1的另一个特点是在脱水四环素诱导条件下可表达secY的反义RNA,secY是葡萄球菌的必须基因,因此整合了该质粒的菌株将无法存活[10]。由于以上特点,采用质粒pKOR1可以极大地提高目的基因的敲除效率。
VraSR是万古霉素耐药相关二元调控系统,由组氨酸激酶VraS和反应调控蛋白VraR两个部分组成。研究[11]显示VraSR可感受外界压力变化,参与细胞壁调节。细胞壁是包被于细菌细胞最外侧具有坚韧性和弹性的复杂结构。金葡菌细胞壁的主要成分包括肽聚糖、脂磷壁酸、壁磷壁酸及脂蛋白。这些胞壁成分常在宿主免疫系统针对金葡菌感染产生多种趋化因子和细胞因子的过程中发挥作用。有研究[12]显示缺乏壁磷壁酸的菌株对内皮细胞的吸附性明显降低,与动物心内膜炎模型中金葡菌毒力降低有关。另有报道称脂磷壁酸能够激发中性粒细胞释放细胞因子[13],而肽聚糖与脂磷壁酸协同作用可在体内引发炎症反应[14]。研究[11]显示vraSR在保持细胞壁肽聚糖完整性上发挥重要作用, 缺失vraSR基因的菌株细胞壁合成能力明显降低。本实验通过HE染色检测小鼠皮肤组织病理变化,结果表明,ΔvraSR感染组小鼠皮肤组织炎性浸润显著降低。

图2 小鼠皮肤脓肿形成
A:小鼠皮肤感染大体标本;B:小鼠脓肿面积大小;C:小鼠皮肤组织菌负荷量;与ΔvraSR比较:*P<0.05,**P<0.01,***P<0.001;D:各组小鼠皮肤组织HE染色;a:生理盐水组;b:Mu3菌株组;c:ΔvraSR菌株组;d:CΔvraSR菌株组;1:×2;2:×40
本课题组前期研究[7]表明VraR蛋白可以直接与agr启动子区域结合。agr是金葡菌中研究最多也最为透彻的二元调控系统,可调节胞外蛋白毒素及细胞表面相关蛋白的表达[6]。agr调控可以使金葡菌从感染的定植阶段向感染后期入侵、获取宿主营养物质阶段过渡[15]。由此推测VraSR可能通过agr间接参与金葡菌毒力调控。毒力是决定细菌致病力的关键因素。本研究采用小鼠皮肤脓肿模型证实敲除vraSR基因后,金葡菌的致病性显著下降。
综上所述,敲除金葡菌vraSR基因可以明显降低金葡菌皮肤脓肿的形成及炎症反应,证实VraSR在金葡菌的致病性中发挥重要作用。VraSR通过何种途径调节金葡菌致病性,其机制是否与agr调控系统及细胞壁合成相关需进一步深入研究。
