蛋白激酶D1调控胶原表达逆转心肌梗死后心室重构的作用
2019-10-15毛秉豫
杨 雷,刘 暖,毛秉豫
心肌梗死(myocardial infarction, MI)后心肌组织的缺血受损可导致心室重构(ventricular remodeling, VR);心肌细胞外基质(extracellular matrix,ECM)在VR的进程中发挥着重要的作用,特别是和ECM的主要组成成分Ⅰ型胶原(collagen typeⅠ, ColⅠ)和Col Ⅲ的大量积聚密切相关[1]。基质金属蛋白酶(matrix metalloproteinases, MMPs)的主要功能之一是降解ECM,而ECM的过度降解也是引发VR的重要原因之一[2]。在组织重塑过程中,基质金属蛋白酶抑制剂(matrix metalloproteinase inhibitors, TIMPs)被分泌并抑制MMPs的活性水平。因此MMPs和TIMPs的动态平衡调节也是影响VR的关键因素之一[2]。前胶原C端蛋白酶增强子(procollagen C-terminal protease enhancer, PCPE)、富含半胱氨酸的分泌型酸性蛋白(secreted protein acidic and rich in cysteine, SPARC)、粘胶蛋白/肌腱蛋白C(tenascin C, TN-C)和核转录因子(nuclear transcription factor, NF-κB) p50也是参与胶原代谢的代表性调控蛋白[2-3]。
研究[4-6]表明,蛋白激酶D1(protein kinase D1, PKD1)具有促缺血受损心肌组织血管新生的作用,但其对MI后心肌胶原蛋白表达的调控作用尚不清楚。该研究旨在探讨PKD1给药4周是否会影响大鼠MI后的VR,并分析其作用机制。
1 材料与方法
1.1 实验动物45只SPF级雄性Wistar大鼠购自北京维通利华实验动物技术有限公司,8周龄,体质量200~220 g,所有动物在标准饲养的环境下(温度和湿度范围分别为22~26 ℃和53%~60%饲喂食物和饮水,并在南阳理工实验动物伦理委员会(实验批准号:NYIST-20180126)监控下进行。
1.2 药物与试剂PKD1购自美国Pierce公司;MMP-1、MMP-8、TIMP1、ColⅠ、Col Ⅲ、PCPE、SPARC、TN-C、NF-κB p50的一抗抗体均购自圣克鲁斯生物技术(上海)有限公司;羊抗兔IgG二抗、DAB显色液、BCA蛋白测定试剂盒购自武汉博士德生物工程有限公司;其他试剂为国产分析纯。
1.3 主要仪器164-5052型PowerPac HC电泳仪(美国BIO-RAD公司);T25组织匀浆机(德国IKA公司);HX-100E型小动物呼吸机、BL-420F生物机能实验系统(成都泰盟科技有限公司);ERM-3100型半自动病理切片机(苏州郝思琳科技有限公司);TKY-BMB型石蜡包埋机(深圳博大精科技实业有限公司);Nikon Tis型荧光显微镜及Nikon NIS-Elements Software BR分析系统(日本尼康公司)。
1.4 动物造模雄性Wistar大鼠45只,按照数字随机法分为3组,假手术组(Sham组)、模型组(Model组)和PKD1给药组(PKD1组),每组大鼠均15只。参照之前的方法[6],Model组和PKD1给药组结扎大鼠左冠状动脉前降支造成MI,Sham组仅履行手术程序但不结扎冠状动脉。术后3 d,PKD1组开始给予PKD1灌胃给药,即按照每日1 mg/(kg·d)的剂量稀释至2 ml生理盐水中,连续灌胃4周。Sham组和Model组每日生理盐水灌胃2 ml,连续4周。在4周结束时,应用戊巴比妥钠(30 mg/kg)麻醉大鼠,进行血流动力学评估。评估结束,75 mg/kg戊巴比妥钠深麻醉下颈总动脉放血法处死动物,进行后续分析。
1.5 血流动力学评估通过侵袭性手术评估动物的血流动力学数据。动物腹腔注射戊巴比妥钠(30 mg/kg)麻醉后,将SPR-838压力容积导管经左颈动脉插入左心室(left ventricle, LV)腔内。连续监测LV的压力和容积,以便正确定位导管,定位后的导管被连接到压力换能器上。通过BL-420F生物机能实验系统记录左室收缩压(left ventricular systolic pressure, LVSP)、左室舒张末压(left ventricular end-diastolic pressure, LVEDP)、左室压最大上升和下降速率等数据。
1.6 HE染色及心肌细胞横截面面积测定取处死后大鼠的心脏,将左心室与其他心脏结构分离,用10%多聚甲醛固定,石蜡包埋,制作组织学4 μm厚切片,参照之前的方法[4],制作HE染色切片,根据Stefanon et al[7]所描述的方法,光学显微镜400×放大视野下对左心室未梗死区域心肌组织进行分析,每只大鼠观察5个视野,手动计数50个细胞(10个细胞/视野),采用Nikon NIS-Elements Software BR分析软件测量心肌细胞横截面积,作为评估MI后心室肥厚程度的指标之一。
1.7 Masson染色心肌组织取材同HE染色部分。参照之前的方法[6],制作Masson染色病理切片。染色后,心肌胶原纤维在光镜下呈蓝绿色,心肌组织呈现红色,胶原容积分数(collagen volume fraction, CVF)采用日本尼康公司的软件分析系统Nikon NIS-Elements Software BR进行分析。
1.8 Western blot检测取心尖部心肌组织,用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液浸泡后,IKA-T25组织匀浆机将样品进行均匀化和离心分离,提取总蛋白。用BCA蛋白测定试剂盒测定总蛋白量。取40 μg的蛋白质应用于SDS-PAGE凝胶电泳,将蛋白条带转移到0.2 μm硝酸纤维素膜上。用蛋白封闭液封闭2 h后与MMP-1、MMP-8、TIMP1、ColⅠ、Col Ⅲ、PCPE、SPARC、TN-C和NF-κB p50的一抗抗体孵育。加入辣根过氧化物酶偶联的羊抗兔二抗,孵育2 h,置入DAB显色溶液中显色,以β-actin蛋白表达水平作为内参对照,AlphaView SA软件分析各样本与β-actin蛋白灰度的比值,记录蛋白相对含量。
2 结果
2.1 PKD1对MI大鼠血流动力学的影响与Sham组比较,Model组大鼠LVSP、左室压最大上升和下降速率值均减小(P<0.01),而LVEDP增大(P<0.01);与Model组比较,PKD1组大鼠LVSP、左室压最大上升和下降速率值均增大(P<0.01),而LVEDP减小(P<0.01),且所有值接近于Sham组大鼠。见表1。
2.2 PKD1对MI大鼠组织形态学的影响3组大鼠HE染色组织形态学结果表明,Sham组大鼠呈现清晰规整的红色心肌,细胞轮廓清晰;Model组大鼠心肌组织坏死严重,坏死的心肌被瘢痕组织取代,残存的心肌细胞明显肥大(绿色箭头),成纤维细胞(黄色箭头)增生明显,伴炎症细胞(红色箭头)浸润;PKD1治疗组大鼠心肌细胞较Sham组仍显肥大,红色心肌组织结构清晰,少见坏死心肌和炎症细胞浸润,伴随明显的毛细血管和散在分布的红细胞。
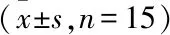
表1 PKD1对MI大鼠血流动力学的影响
与Sham组比较:**P<0.01;与Model组比较:##P<0.01
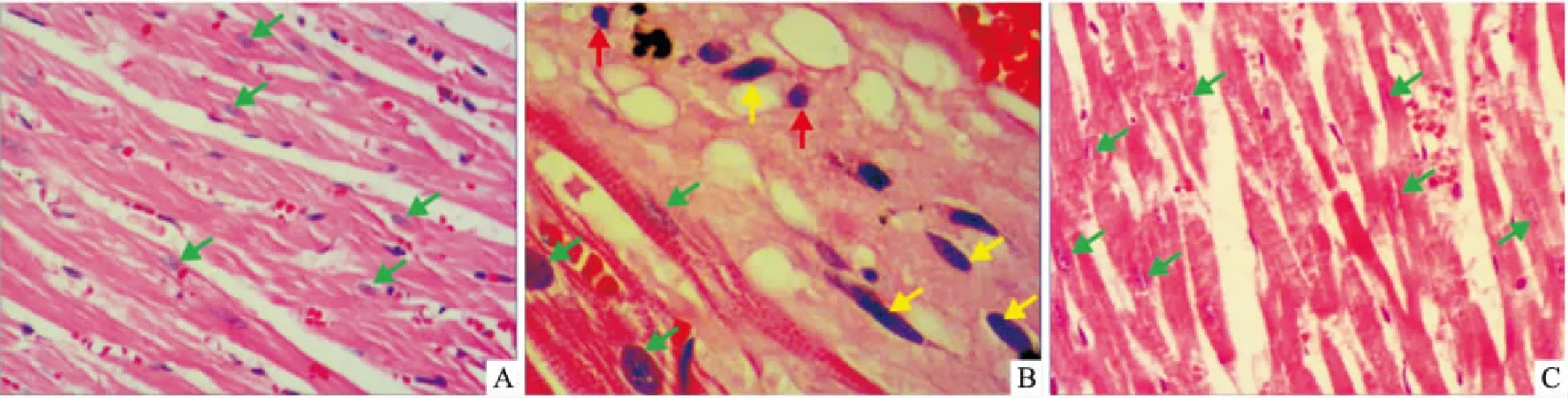
图1 PKD1对MI大鼠组织形态学的影响 HE×400
A: Sham组;B: Model组;C: PKD1组;绿色箭头示心肌细胞,黄色箭头示成纤维细胞,红色箭头示炎症细胞

表2 PKD1对MI大鼠心肌组织的胶原占比和心肌细胞截面积的影响
与Sham组比较:**P<0.01;与Model组比较:##P< 0.01
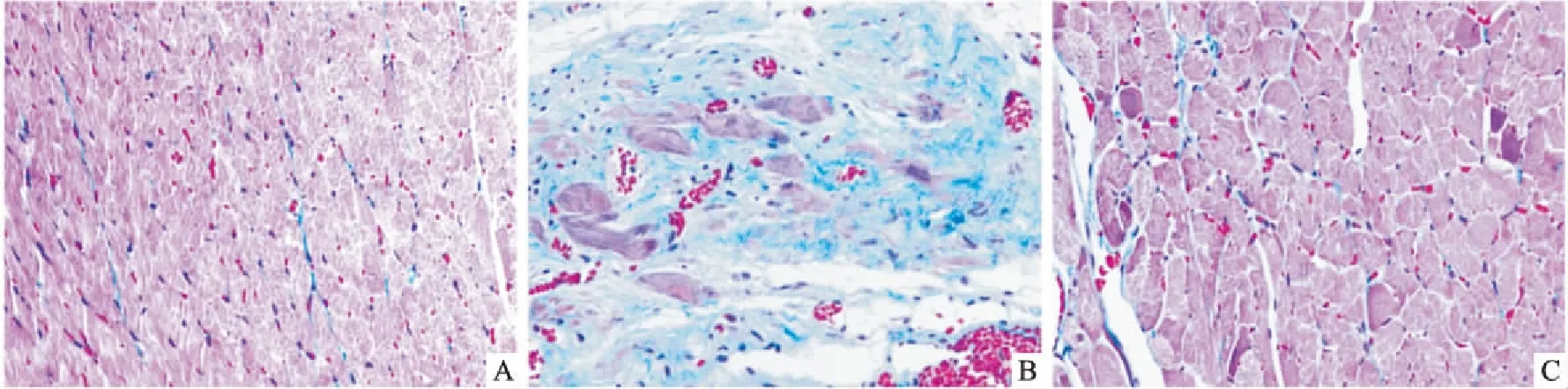
图2 PKD1对MI大鼠心肌纤维化的影响 Masson×400A: Sham组;B: Model组;C: PKD1组
见图1。
2.3 PKD1对MI大鼠心肌细胞截面积的影响3组大鼠非梗死区心肌细胞的截面积分析结果表明,Sham组大鼠心肌细胞的截面积正常;与Sham组比较,MI大鼠残存非梗死区域心肌组织中心肌细胞的截面积增大(P<0.01);与Model组比较,PKD1组大鼠心肌组织中心肌细胞的截面积减小(P<0.01),但较Sham组增大(P<0.01)。见表2、图1。这表明PKD1给药后可改善MI大鼠心肌细胞的肥大程度。
2.4 PKD1对MI大鼠心肌纤维化的影响3组大鼠心肌组织的纤维化程度和胶原占比分析结果表明,Sham组大鼠心肌组织中红色的心肌组织中间杂有蓝色的胶原纤维,但胶原占比较少;与Sham组比较,Model组大鼠残存的红色心肌组织较少,心肌组织坏死严重,坏死的心肌组织由大片蓝色的胶原纤维取代,胶原占比升高(P<0.01);与Model组比较,应用PKD1后,心肌组织坏死的程度明显减轻,胶原纤维占比下降(P<0.01)。见表2、图2。这表明,PKD1给药后可改善MI大鼠心肌组织的坏死程度,降低心肌组织的胶原占比。
2.5 PKD1对MI大鼠心肌组织中胶原相关蛋白表达的影响Western blot结果表明,与Sham组比较,MI大鼠残存心肌组织中MMP-1、MMP-8、ColⅠ、Col Ⅲ、PCPE、SPARC、TN-C和NF-κB p50的表达均升高(P<0.01),TIMP1表达降低(P<0.01);与Model组比较,PKD1组大鼠心肌组织中TIMP1的表达升高(P<0.01),而MMP-1、MMP-8、ColⅠ、Col Ⅲ、PCPE、SPARC、TN-C和NF-κB p50的表达均降低(P<0.01),但除了NF-κB p50的表达外,均仍高于Sham组(P<0.01)。这表明PKD1给药可影响MI大鼠心肌组织中胶原相关蛋白的表达。见图3。
3 讨论
MI后受损心肌组织的ECM中胶原产生和沉积增多,导致心肌纤维化、心室壁僵硬以及心肌的收缩和舒张功能障碍[8]。本研究表明,PKD1在改善MI大鼠心肌组织的血流动力学方面作用显著,这与之前的动物实验研究[4]结果相一致,表明PKD1治疗可减轻心脏的损伤程度,改善心脏的收缩和舒张功能障碍。
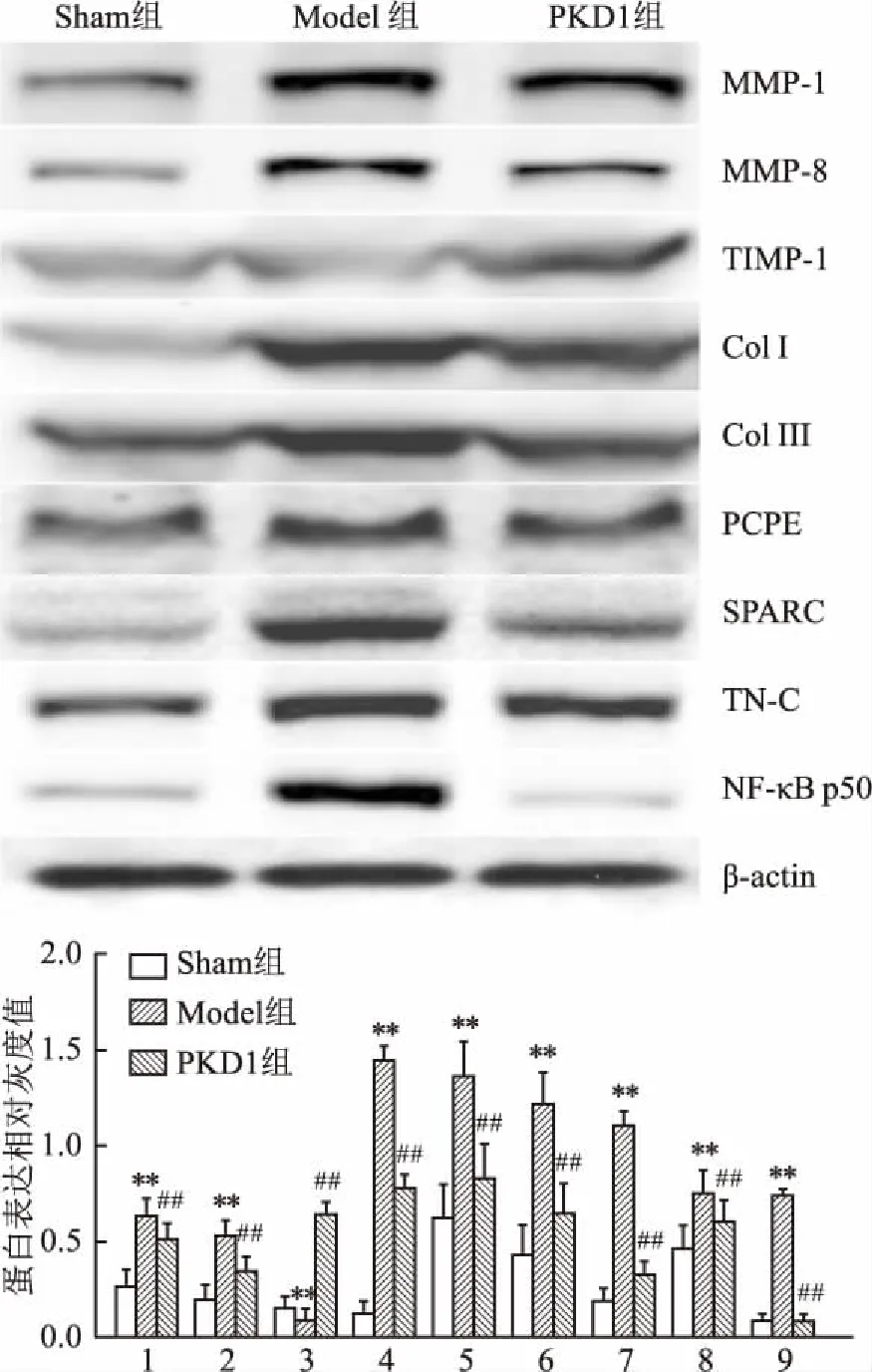
图3 PKD1对MI大鼠心肌组织胶原相关蛋白表达的影响
1:MMP-1;2:MMP-8;3:TIMP-1; 4:Col Ⅰ;5:Col Ⅲ;6:PCPE;7:SPARC;8:TN-C;9:NF-κB p50;与Sham组比较:**P<0.01;与Model组比较:##P<0.01
本研究通过Masson染色分析评估了MI心肌组织的胶原占比,证实PKD1治疗可有效减轻心肌组织的纤维化程度。并证实PKD1可下调心肌组织中ColⅠ、Col Ⅲ、MMP-1和MMP-8的表达。MMPs在心肌组织中被激活后可迅速降解ECM成分,导致心室壁变薄和扩张,心肌纤维化而引发VR,甚至可能导致心功能衰竭[9]。因此,MI后MMPs的分泌增多很可能是VR及心力衰竭发生的起始因素[9-11]。TIMPs是MMPs的特异性内源性调节因子,TIMPs参与调控心肌炎症和心室腔扩张的进程[10],是维持心室几何结构的基础[11]。本研究显示PKD1可下调MMP-1和MMP-8的表达,并上调TIMP1的表达。这表明PKD1可能通过上调TIMPs和下调MMPs的表达而减少ECM的过度降解,抑制心肌纤维化的进展,减轻心肌组织的胶原沉积,并最终逆转VR。
PKD1还通过调控两种特异性蛋白PCPE和SPARC的表达而影响胶原的合成。PCPE具有增强前胶原C蛋白酶调控合成新胶原蛋白的作用[12]。SPARC通过与胶原蛋白前体的结合而调节新胶原纤维的形成[13]。本研究证实,PKD1可下调PCPE、SPARC、ColⅠ和Col Ⅲ的表达水平。这表明PKD1可有效减少组织胶原的合成并促进其降解,从而改善心肌组织的纤维化程度。
TN-C参与新胶原分子的形成并调节NF-κB活化[14]。TN-C的缺失可减少MI后心肌纤维化程度,并改善心脏的舒张功能而减轻MI后的心功能障碍[13]。本实验表明PKD1治疗可减少MI大鼠心肌组织中的TN-C及NF-κB p50的表达。这可能是由于PKD1治疗抑制了TN-C和NF-κB p50激活的炎症信号通路参与的VR。
本研究还显示,PKD1用药组大鼠心肌细胞横截面积、心肌细胞的肥大程度及胶原相关蛋白的含量,尽管较Model组明显改善,但较Sham组仍存在着差异。这表明PKD1用药在抑制心肌肥厚方面的作用是有限的。然而,PKD1用药组大鼠在改善MI大鼠的血流动力学方面却十分显著,几乎接近于Sham组大鼠,而血流动力学指标又是评估心功能的重要指标之一。据此,课题组推测PKD1改善MI后的VR作用除了和一定程度上逆转心肌肥厚有关,同时也可能与PKD1的促血管新生作用密切相关[4-6]。PKD1作用后诱导新的毛细血管生成,可以满足肥厚心肌的血供,而这种肥厚的心肌在保证心肌强有力收缩的同时并不引发心肌缺血。因而,PKD1用药后未完全被抑制的心肌肥厚未必是一种病理性心肌肥厚,有可能是一种生理性肥厚,这对于基于“PKD1”靶点的新药开发提供了一种新的思路。
