TRPC1/C4/C5通道调节胸主动脉平滑肌收缩作用研究
2019-10-15陈良余周利民范涛涛
陈良余,毛 雨,周 扬,费 亮,王 健,周利民,范涛涛,沈 兵
大电导钙激活钾通道(big-conductance Ca2+-activated K+channel,BKCa)是电压门控的钾离子通道超家族成员之一,表达于神经元细胞、分泌细胞以及平滑肌等细胞[1],是调节钙离子进入细胞内的重要反馈机制[2-5]。
已知包括机械力、氧化应激及细胞内信号分子等在内的多种因素可以调节经典瞬时受体电位离子通道(transient receptor potential channel, subfamily C, TRPC)的激活[6]。TRPC1是最早被克隆的哺乳类瞬时受体电位通道,广泛参与钙依赖的细胞分泌和收缩过程;TRPC4参与血管收缩、微血管通透等功能[7];TRPC5参与血管收缩、血小板聚集和减压神经感受血压等功能[8]。但TRPC1、TRPC4、TRPC5形成的异聚体通道对胸主动脉平滑肌收缩的影响尚未阐明[9]。该研究通过检测TRPC1/C4/C5与BKCa相互作用,阐明TRPC1/C4/C5通道在调节胸主动脉平滑肌收缩中的作用。
1 材料与方法
1.1 材料
1.1.1试剂与仪器 内皮素1购于英国Tocris Bioscience;TRPC1、TRPC4、TRPC5、BKCa抗体购自美国Santa Cruz Biotechnology公司;Protein A 磁珠购于Millipore公司;Goat-Anti-Rabbit IgG二抗购自上海生工公司;脂质体3000(Lipofectamine 3000)购于美国Invitrogen公司;Krebs-Henseleit生理缓冲液配方(mmol/L):NaCl 118,CaCl22.5,KCl 4.7,KH2PO41.2,MgSO4·7H2O 1.2,NaHCO325.2和glucose 11.1;高钾溶液为将Krebs生理缓冲液中的NaCl等摩尔替换为KCl,最终使KCl浓度为60 mmol/L;DMT myograph微血管张力记录系统(model 610M, Danish Myo Technology)购于丹麦Aarhus公司;TRPC1/C4/C5小干扰RNA(siRNA)和对照siRNA (scrambled siRNA)购自江苏百奥迈科生物技术有限公司。
1.1.2实验动物 清洁级昆明种雄性小鼠,6周龄,体质量20~25 g,由安徽医科大学实验动物中心提供,正常进食饮水,饲养室温维持(22±1)℃。
1.2 方法
1.2.1血管环的制备 将小鼠用CO2窒息处死,迅速破开胸腔,小心取出胸主动脉,放入冰冷的Krebs缓冲液并通有混合气体(95% O2和5% CO2)以维持溶液pH在7.4。在解剖显微镜下,采用精密手术剪刀快速、仔细地剥去血管外脂肪等组织,再用粗糙的细竹签小心去除血管内皮层,然后将血管沿纵轴分段为2 mm长的血管环。
1.2.2siRNA转染 将各组胸主动脉环置于12孔细胞培养板中,每孔加入0.9 ml DMEM培养基。对照组:取两支无菌EP管,分别做好标记,其中一管加入1.5 μl Lipofectamine 3000和50 μl OPTI-MEM无血清培养基;另一管中加入10 μl Scrambled siRNA和50 μl OPTI-MEM无血清培养基;用移液枪分别混匀室温静置5 min。随后将两管液体混合为一管,用移液枪充分混匀后室温静置10 min;实验组将Scrambled siRNA替换为TRPC1/4/5 siRNA。将Lipofectamine 3000包裹好的siRNA加入已提前放入一段小鼠胸主动脉的12孔板中,将细胞培养板放入细胞培养箱内继续孵育24 h后进行后续实验。
1.2.3离体胸主动脉环张力实验 将两根细金属丝穿入血管环,把其中的一根金属丝固定在张力换能器上,另一根金属丝固定在可调节距离的螺杆上,在浴槽内注入5 ml Krebs液,通入持续的混合气体(95% O2和5% CO2);调节张力换能器,将血管施加500 mg前负荷,运用DMT myograph微血管张力记录系统检测血管张力,在Krebs液中平衡60 min,每隔15 min更换一次新鲜的Krebs液,待血管张力基线稳定后,加入60 mmol/L高钾溶液预激血管,待收缩达峰值后,用Krebs冲洗3次,再平衡后累积浓度加入10-9~10-7mol/L内皮素1,分析张力变化曲线并进行统计分析。
1.2.4免疫共沉淀 将siRNA处理后的胸主动脉在冰上研磨、裂解、转入1.5 ml 离心管中,置于冰上30~60 min,4 ℃离心后取上清液。不同样品中分别加入抗TRPC1/C4/C5/的抗体和不同的互沉淀抗体进行免疫共沉淀,4 ℃混合2 h后分别加入预处理好的50 μl protein A 磁珠过夜;第2天将样品置于磁力架上吸附弃上清液。再用缓冲液清洗沉淀3次,加入5×上样缓冲液50 μl并煮沸,收集上清液后进行后续的Western blot实验。
1.2.5Western blot 将免疫共沉淀收集的蛋白采用SDS-PAGE电泳,再以0.2 A恒流将蛋白转入PVDF膜,用5%脱脂牛奶室温封闭膜1 h后4 ℃孵育一抗。第2天以PBST洗膜3次,再将含有蛋白的PVDF膜室温孵育辣根过氧化物标记的二抗1 h,PBST再漂洗3次,在化学发光检测仪上采集图像。
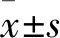
2 结果
2.1 TRPC1/C4/C5 siRNA分别敲低其蛋白表达将对照siRNA(Scrambled siRNA)和TRPC1/C4/C5 siRNA分别处理的胸主动脉组织予以蛋白电泳检测,结果显示TRPC1/C4/C5 siRNA分别显著抑制了TRPC1/C4/C5蛋白的表达,见图1。Scrambled siRNAvsTRPC1 siRNA:(124.61±18.20)%vs(91.34±23.26)%,Scrambled siRNAvsTRPC4 siRNA:(148.90±20.56)%vs(99.92±14.12)%,Scrambled siRNAvsTRPC5 siRNA:(182.72±13.11)%vs(141.76±17.83)%。
2.2 TRPC1/C4/C5 siRNA对高钾引起的胸主动脉收缩的影响将对照siRNA(scrambled siRNA)和TRPC1/C4/C5 siRNA分别处理的胸主动脉环在Kreb′s缓冲液平衡稳定后,采用高钾溶液收缩血管,结果显示,对照组和处理组血管收缩差异无显著性,Scrambled siRNAvsTRPC1 siRNA: (5.07±0.68)vs(5.07±0.72)mN,(Scrambled siRNAvsTRPC4 siRNA:(4.55±0.58)vs(4.69±1.05)mN,Scrambled siRNAvsTRPC5 siRNA:(5.03±0.64)vs(5.32±0.49)mN。
2.3 TRPC1/C4/C5 siRNA对内皮素1引起的胸主动脉收缩的影响将对照siRNA(Scrambled siRNA)和TRPC1/C4/C5 siRNA分别处理的胸主动脉环在Kreb’s缓冲液平衡稳定后,采用内皮素1收缩血管。结果见图2所示,内皮素1引起的血管收缩效应在转染TRPC1/C5 siRNA血管中显著增强,而在转染TRPC4 siRNA血管中显著减弱。
2.4 TRPC1/C4/C5与BKCa蛋白的相互作用已知平滑肌细胞内钙内流受细胞膜上BKCa蛋白的负反馈调节,TRPC通道可以介导细胞内钙离子内流,并调节BKCa的活动。为了进一步检测TRPC1、TRPC4及TRPC5蛋白与BKCa之间的相互关系,本研究借助免疫共沉淀实验进行验证。结果显示TRPC1、TRPC5蛋白与BKCa存在相互作用(图3A、C),而TRPC4蛋白与BKCa之间不存在相互作用(图3A、C),并且TRPC1与TRPC4、TRPC5存在相互作用(图3)。
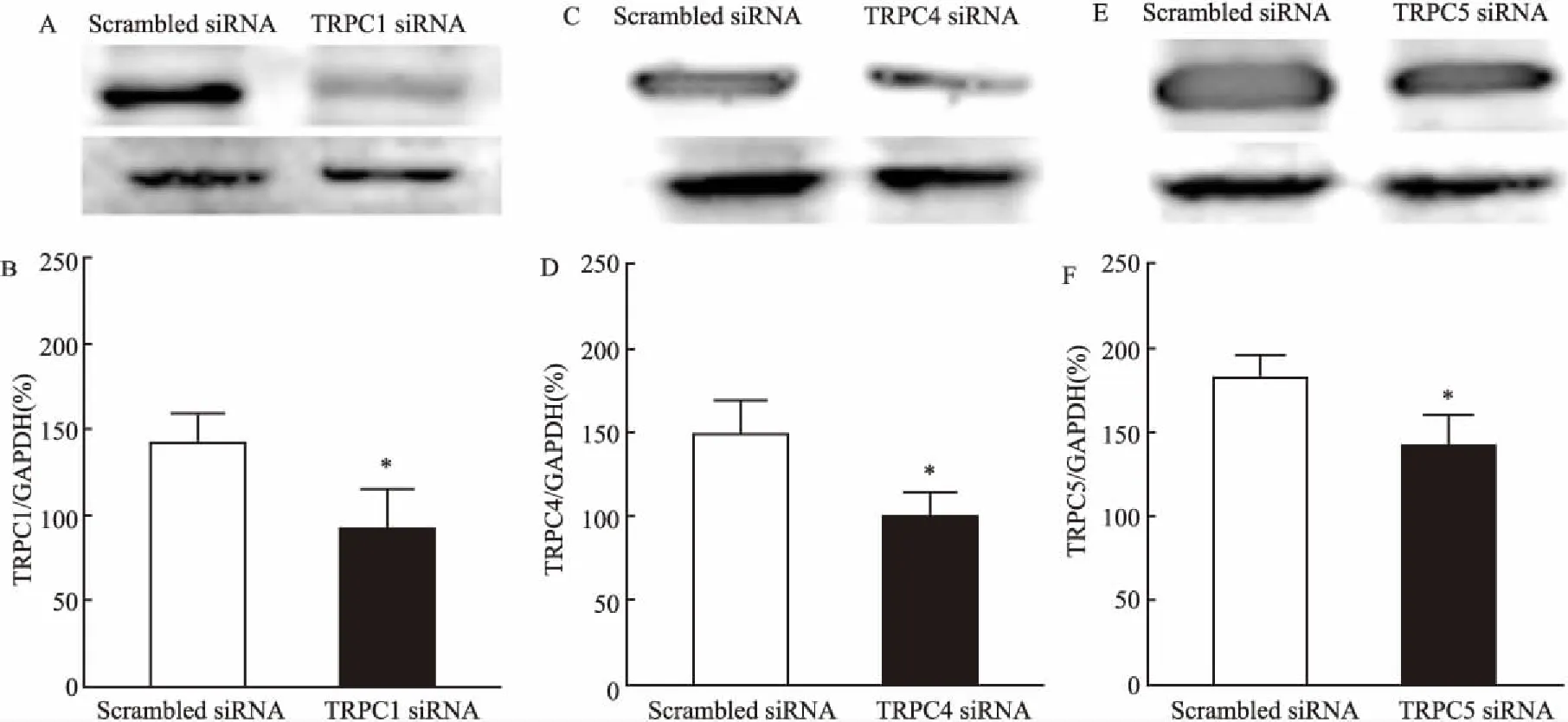
图1 TRPC1/C4/C5 siRNA对蛋白表达的影响A、B:TRPC1蛋白表达水平;C、D:TRPC4蛋白表达水平;E、F:TRPC5蛋白表达水平;与Scrambled siRNA组比较:*P<0.05
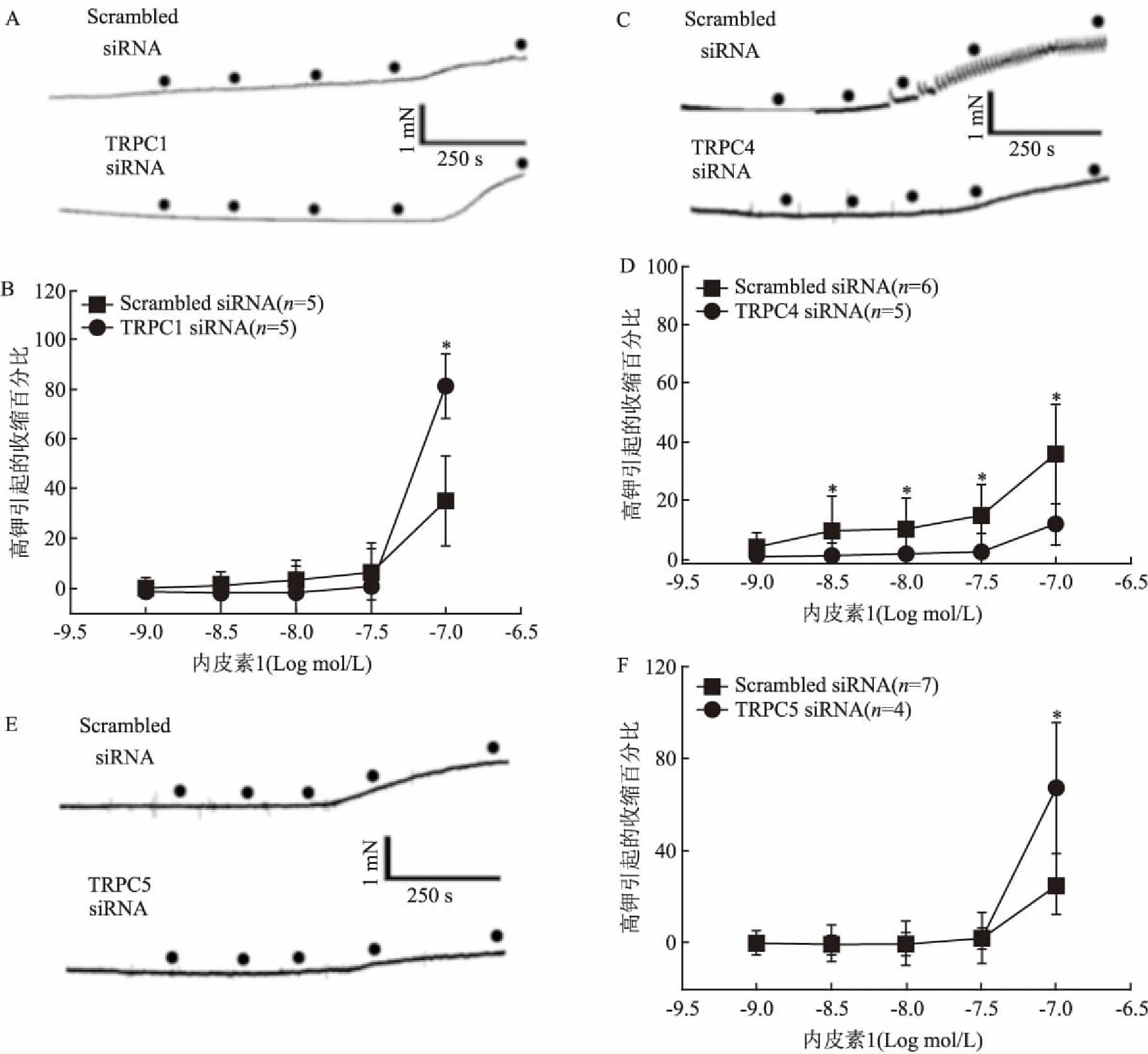
图2 TRPC1/C4/C5 siRNA对内皮素1引起的小鼠胸主动脉收缩的影响A、B:TRPC1和Scrambled siRNA;C、D:TRPC4和Scrambled siRNA;E、F:TRPC5和Scrambled siRNA组;与Scrambled siRNA组比较:*P<0.05
图3 TRPC1、TRPC4、TRPC5和BKCa蛋白相互作用
裂解液:小鼠胸主动脉平滑肌细胞裂解液;IP产物:免疫共沉淀产物
3 讨论
钙离子是细胞体内重要的第二信使[3],参与调控有机体内众多生物学过程,同时细胞内许多生理功能如肌肉收缩、激素分泌、细胞增殖、基因表达等[10-14]的调节也与钙离子紧密相关。电压依赖的钙通道(voltage-dependent Ca2+channel, VDCC)是钙通道之一,其介导的细胞外钙内流能够调节平滑肌细胞的收缩,但VDCC的激活又与细胞膜电位的变化紧密相关。此外,当细胞受到刺激后,细胞内钙离子浓度显著增加,BKCa可通过负反馈的方式调节细胞膜电位并调节VDCC的活动。根据前期实验结果,已知TRPC1、BKCa蛋白形成的信号复合物以负反馈的方式调节激动剂介导的血管平滑肌收缩[15]。同时,TRPC1、 TRPC4、TRPC5蛋白通常会聚集在一起,在细胞膜上形成复合通道,从而介导受体激活引起的钙内流。
为了进一步确认TRPC1/ C4/C5三种钙通道蛋白之间的关系,本研究借助免疫共沉淀实验,检测其两两之间的相互作用。实验结果表明TRPC1可以共沉淀TRPC4、TRPC5蛋白,表明TRPC1可与TRPC4、TRPC5之间存在相互作用,并形成异聚体通道;另一方面,TRPC1和TRPC5可以共沉淀BKCa,但TRPC4不能共沉淀BKCa,说明TRPC1和TRPC5可以和BKCa形成信号复合物,但TRPC4不能与BKCa形成信号复合物。为了进一步深入探讨这两种信号系统对血管功能的影响,本研究采用内皮素诱导胸主动脉收缩,并检测TRPC1-TRPC4和TRPC1-TRPC5通道在内皮素1引起的胸主动脉收缩中的作用。同时,本研究通过瞬时转染TRPC1、TRPC4、TRPC5特异性siRNA分别抑制TRPC1/C4/C5蛋白的表达,结果表明,特异性敲低TRPC1/C5 蛋白后内皮素1引起的血管收缩显著增强,而特异性敲低TRPC4蛋白表达后内皮素1引起的血管收缩显著抑制。
由此推测内皮素激动其受体后,激活了下游的TRPC1-TRPC5蛋白形成异聚体通道并介导细胞外钙离子内流,进而激活与之相互作用的BKCa通道,BKCa通道随后介导细胞内K+外流,使细胞膜超极化并抑制VDCC,从而负反馈抑制内皮素1引起的血管平滑肌收缩。特异性siRNA敲低TRPC1或TRPC5蛋白表达,使得细胞膜上TRPC1-TRPC5异聚体通道表达减少,导致BKCa通道激活受阻,从而使VDCC活性增强而介导更多的外钙内流,使血管收缩增强。另一方面,TRPC4不能与BKCa形成信号复合物,说明TRPC1-TRPC4异聚体通道介导的钙内流不能激活BKCa通道并形成负反馈调节机制,而相反作为受体依赖的钙通道介导钙内流增强平滑肌收缩。当TRPC4被敲低后,TRPC1-TRPC4异聚体通道介导的钙内流将减弱,而TRPC1-TRPC5异聚体通道介导的钙内流可以激活BKCa并引起细胞膜超极化,抑制VDCC,最终导致血管收缩减弱。
