探索人高转移胃癌细胞HGC-27适配体的靶标蛋白
2019-10-15刘浩波王亚雷罗昭锋
刘浩波,刘 涛,王亚雷,罗昭锋
胃癌(stomach cancer,SC)是世界上第四大常见的恶性肿瘤, 发病率逐年上升[1],但其早期症状并不明显,大多数SC患者就诊时就已发生癌细胞转移, 延误了最佳治疗时机。因此如果能鉴定出高转移性SC的肿瘤标志物将对早期监测SC转移和探索SC转移机制带来巨大前景。
目前,寻找肿瘤标志物一种方法是使用抗体,另一种是使用适配体,通过抗体寻找靶蛋白时,需要两种抗体形成一种特殊结构才能找到靶标蛋白[2],使用核酸适配体来寻找生物标志物的方法相对简单。核酸适配体是由随机寡核苷酸文库通过寡核苷酸与靶分子的重复结合演化而来的单链DNA或RNA分子。与抗体类似,适配体可以以高特异性和亲和力结合其靶分子。该研究旨在利用已经得到的可以特异性识别高转移SC细胞的适配体LW-25去探索其结合的靶标蛋白。
1 材料与方法
1.1 主要材料
1.1.1细胞株 人胃癌细胞系HGC-27(高转移能力)获赠于中国科学技术大学生命科学院;生长于含20 U/ml的青霉素和链霉素以及10%胎牛血清的RPMI-1640培养液中,在37 ℃、5%CO2条件下恒温恒湿培养箱内培养, 实验均采用对数期细胞。
1.1.2单链DNA序列名称及碱基组成 见表1。

表1 生物素修饰后的LW-25及随机文库Lib的碱基组成
以上两种适配体由上海生物工程公司合成
1.1.3主要试剂和仪器 RMPI-1640培养基、胰蛋白酶购自美国Gibco公司;胎牛血清购自杭州四季青公司;PBS缓冲液购自上海慧颖生物科技有限公司;青霉素-链霉素溶液、PMSF、蛋白酶抑制剂混合物购自上海碧云天公司;酵母tRNA购自美国Sigma公司;葡萄糖、BSA购自上海生物工程公司;洗涤缓冲液(washing buffer,WB)、结合缓冲液(binding buffer,BB)以及DNA封闭液由实验室自行配置; WB:含有4.5 g/L葡萄糖及5 mmol/L MgCl2的DPBS;BB:含有1 mg/ml BSA和0.1 mg/ml酵母tRNA的WB;DNA封闭液:5 mg鲑鱼精DNA和1 ml胎牛血清加入4 ml的BB;链霉亲和素包被的琼脂糖凝胶珠、Q Exactive Plus质谱仪购自美国赛默飞公司;Guava easyCyte 5流式细胞仪购自美国Merck Millipore公司;CLM-170B-8-NF型CO2培养箱购自上海Esco公司。
1.2 方法
1.2.1LW-25靶标类型的鉴定 核酸适配体的靶标类型通过胰蛋白酶消化细胞蛋白,然后将细胞与核酸适配体孵育,再用流式细胞仪检测其结合结果来确定。
1.2.2SC细胞的培养 将HGC-27细胞在含有10%胎牛血清的RPMI 1640培养基于37 ℃、5% CO2培养箱中培养。
1.2.3收集蛋白样品 收集2×108的HGC27细胞;洗涤消化后收集在离心管中,将细胞加入含有PBS(pH 7.4)、2%Triton-X-100(V/V)、0.4%SDS(W/V)、5 mmol/L EDTA、1 mmol/L PMSF以及蛋白酶抑制剂混合物的裂解液,于4 ℃、水平摇床上孵育裂解50 min,将细胞裂解液在4 ℃、6 500 r/min离心5 min,保留上清液作为蛋白质样品。
1.2.4蛋白上样样品的制备 通过适配体下拉实验技术,将适配体LW-25和文库分别与蛋白质样品孵育,进而分别与链霉亲和素包被的琼脂糖凝胶珠孵育,利用链酶亲和素和生物素的相互作用,通过高温变性洗脱LW-25和文库结合的蛋白质。
具体而言,分别取90 μl琼脂糖凝胶珠置于3个EP管中并用WB洗涤3次;用5%的BSA封闭珠子1 h,封闭完成后用WB洗涤珠子5次。收集的蛋白质样品加入DNA封闭液孵育1 h,封闭完取100 μl留作全蛋白样品组。将封闭后的蛋白质样品与400 nmol/L的LW-25在4 ℃水平摇床上孵育1 h,离心后的上清液与0.9 mg(90 μl)琼脂糖凝胶珠在4 ℃振荡器上孵育1 h,用磁铁收集已经捕获蛋白质-LW-25复合物的琼脂糖凝胶珠;将封闭后的蛋白质样品与400 nmol/L的Lib在4 ℃摇床上孵育1 h,离心后的上清液继续与0.9 mg(90 μl)琼脂糖凝胶珠在4 ℃振荡器上孵育1 h,用磁铁收集已经捕获蛋白质-Lib复合物的琼脂糖凝胶珠;将封闭的蛋白质样品直接与0.9 mg(90 μl)琼脂糖凝胶珠在4 ℃振荡器上孵育1 h,用磁铁收集琼脂糖凝胶珠;收集的珠子用WB洗涤5次。
1.2.5SDS-PAGE 向3组珠子中各加入30 μl 1×上样缓冲液,向预留的100 μl全蛋白中加入25 μl 5×上样缓冲液,100 ℃变性10 min。将变性后的蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳后,将其浸入考马斯亮蓝染液中35 min,染色后用超纯水脱色,直至条带清晰可见。用凝胶成像仪扫描SDS-PAGE凝胶以获得图像,并分析图像结果找出差异条带。
1.2.6质谱检测差异条带 切下SDS-PAGE凝胶中的差异条带并送质谱检测。
2 结果
2.1 LW-25靶标类型分析先用胰蛋白酶消化细胞,再将消化后的细胞与适配体孵育。未经胰酶处理的细胞与适配体有着很强的结合力,而经胰酶处理的细胞与适配体结合强度明显下降,说明核酸适配体LW-25的靶标是蛋白质。见图1。
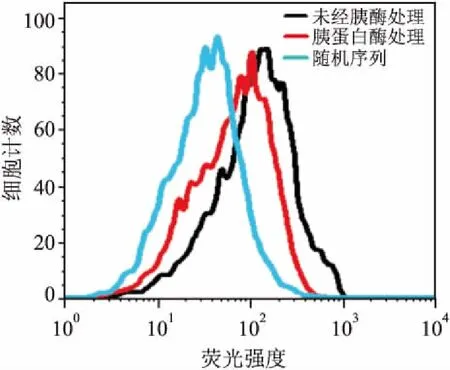
图1 LW-25的靶标类型图
2.2 SDS-PAGE成功检测到差异条带在用凝胶电泳扫描仪扫描后,获得扫描图,找到差异条带,即箭头所指蛋白条带,差异条带处可见LW-25组蛋白表达量要明显高于文库对照组。空白珠子组在相应位置则无明显条带。见图2。

图2 考马斯亮蓝染色的10%SDS-PAGE 凝胶图
1:Marker;2:全蛋白;3:空白珠子样;4:文库珠子样;5:核酸适配体LW-25珠子样
2.3 液相色谱-质谱联用仪分析出最明显的差异蛋白将切下的差异条带送去质谱检测,获得差异条带中的蛋白信息见图3。图中可见不含POU结构域的八聚核苷酸结合蛋白(non-POU domain-containing octamer-binding protein,NONO)在适配体LW-25样品组中量极高,在文库对照组中蛋白量很少,在空白珠子对照组中几乎没有,并且NONO(54.2 ku)的大小与从SDS-PAGE凝胶上切下条带的分子量正好相关。

图3 差异蛋白条带质谱分析结果
A:LW-25结合的蛋白质;B:文库结合的蛋白质;C:空白珠子结合的蛋白质;D:NONO的肽指纹图谱
3 讨论
SC是种致命的恶性肿瘤,转移与侵袭是患者死亡的主要原因。大约有50%患者在SC确诊时就已经发生了转移[3]。因此,早期发现肿瘤并预防其转移显得十分重要。特异性指示SC转移的肿瘤标志物的鉴定,可以实现对SC的早期检测,还可以深入了解SC的发生和发展机制,进而实现SC的预防和治疗。
寻找肿瘤标志物一直是医师和生物研究人员热衷的研究方向,如原发性肝癌患者血清中的甲胎蛋白被公认为是肝癌最具诊断价值的诊断指标[4]。然而像甲胎蛋白这种具有重要诊断价值并投入临床实践的标志物却很少,这种现象可以归因于两个主要方面:① 缺乏用于肿瘤标志物发现的有效方法;② 缺乏用于肿瘤标志物验证和应用的实际测定的分子工具。
核酸适配体具有无免疫原性、尺寸小、优异的化学稳定性以及容易生产的特性,能够通过折叠三维结构以高亲和力与靶标特异性结合,并且能在分子水平上区分恶性肿瘤细胞及其相应的正常细胞,在识别分子差异上具有很大优势[5]。因此,可以把适配体用作探索肿瘤标志物的理想分子探针,进而通过后期的质谱检测分析出核酸适配体所结合的靶标。此外利用细胞指数富集的配基系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)筛选的适配体可以继续用于鉴定肿瘤新的标志物[6]。到目前为止,利用细胞SELEX技术筛选出来的适配体已经鉴定出了多种肿瘤标志物,如酪氨酸蛋白激酶7[7]、免疫球蛋白重μ链[8]、应激诱导磷蛋白1[9]等。
寻找核酸适配体靶蛋白实验已存在许多年,但利用此种方法找到的肿瘤标志物却很少,说明此种方法还存在一些难点有待解决。比如靶蛋白分子量不清楚因而很难锁定电泳中的靶标所在的条带。从捕获蛋白-适配体的磁珠洗去非特异性蛋白时需要适当的洗涤条件,过度的洗涤有可能将靶蛋白一同洗掉,洗涤不足会存留大量的非特异性蛋白,导致质谱结果数据繁多复杂,很难判断哪个是靶蛋白。本实验中一些技术环节上的改进,如多次重复实验以确保结果的可靠性;通过加大细胞量去避免靶标蛋白因浓度过低导致SDS-PAGE检测不出条带的问题;在核酸适配体和蛋白孵育时通过加大盐浓度以促进适配体和靶蛋白的牢固结合,并通过严格的洗涤步骤以去除非特异性结合蛋白等。这使得在重复SDS-PAGE时可以稳定的得到相同的差异条带。
本研究显示NONO参与了多种肿瘤的发生和发展, 有文献[10]报道称在乳腺癌细胞系SKBR3 (HER2/c-erb-2过表达) 中敲除P54nrb/NONO可抑制癌细胞的增殖、侵袭和迁移, 提示p54nrb/NONO很可能是促进乳腺癌细胞增殖、侵袭和迁移的重要调控蛋白;同时许多的研究表明NONO也能促进黑色素瘤[11]、膀胱移行细胞癌[12]、鼻咽癌[13]的侵袭和转移。这与适配体LW-25可以特异性识别SC转移细胞的特性很好的吻合,综合以上结果推断NONO极有可能是LW-25的靶标蛋白,并很可能也是引起SC转移的重要蛋白, 但其作用机制仍不清楚。相信NONO基因功能的深入研究将为临床预测癌症转移和治疗癌症带来巨大潜力。
