循环肿瘤细胞数量及分型检测在肾癌疗效评价中的作用
2019-10-15王振龙薛玉泉张亚萍杨小杰李和程李洪亮刘文聘
王振龙,张 鹏,薛玉泉,张亚萍,杨小杰,薛 力,李和程,李洪亮,刘文聘,种 铁
(西安交通大学第二附属医院泌尿外科,陕西西安 710004)
肾癌(renal cell carcinomar,RCC)是泌尿系统常见肿瘤,发病率逐年上升,每年增长约2%~4%,即使手术治疗,术后仍有约20%~40%的患者出现疾病进展,5年生存率仅有11%[1-2]。寻找合适的评价肾癌治疗效果的方法,实时监测肾癌治疗后的转归,对肾癌治疗后的疾病进展做到早发现早治疗意义重大。循环肿瘤细胞(circulating tumor cells,CTCs)是实体瘤原发灶或转移灶释放进入外周循环血中的肿瘤细胞,被认为是肿瘤转移的“种子”。研究表明,CTCs与多种肿瘤的转移和复发显著相关[3-4]。我们前期研究也发现了CTCs数量及分型检测具有评估肾癌进展风险的作用[5]。CTCs数量及分型检测能否作为评价肾癌疗效的早期、敏感的方法,值得深入研究。
1 资料与方法
1.1 临床资料入组患者为2015年6月至2016年9月西安交通大学第二附属医院收治的47例肾癌患者,均经病理学确诊且既往未经任何治疗。年龄47~82岁,平均 64.5 岁;男性33例,女性14例;TNM 分期采用国际抗癌联盟2003年制定的标准:T1期 34 例,T2期 10 例,T3期 3 例,无T4期病例;手术方式:根治性肾切除术10例,肾部分切除术37例;术后病理诊断:肾透明细胞癌45例,乳头状细胞癌2例。本研究通过了西安交通大学第二附属医院医学伦理委员会审核,标本的采集和检测均经患者知情同意。
1.2 监测与随访所有患者行术前检查并进行CTCs检测,术中记录肿瘤分级分期等信息,术后每3个月复查一次,检查项目包括,胸部、上腹部及双肾计算机断层扫描(computed tomography,CT)平扫或增强(怀疑有转移及复发患者加做增强CT)检测评估肿瘤有无远处转移;外周血CTCs检测,包括CTCs数量及分型检测,分别得到CTCs总数及上皮型、混合型、间质型CTCs数量,并计算间质型CTCs比例(间质型CTCs数量/CTCs总数)。肾癌转移患者在给予治疗前及治疗后1月增加外周血CTCs分型检测,后续常规复查每3个月1次,均完成至少1年随访。
1.3 研究分组按以下方案进行分组:①影像学发现远处转移的患者,按进行治疗(包括切除转移灶或靶向治疗)和未予治疗分组,比较CTCs数量及间质型CTCs比例在2组患者中的差异,评价CTCs分型检测对转移肾癌疗效评价的作用。②CTCs呈进展趋势的患者(不论影像学是否发现转移灶),按进行分子靶向治疗和未进行靶向治疗分组,比较CTCs数量及间质型CTCs比例在2组患者中的差异,评价分子靶向治疗对CTCs数量及分型的作用。
1.4 分子靶向治疗方案分子靶向药物治疗用药及辅助治疗用药,均选择索拉非尼0.8 g/d口服。
1.5 外周血CTCs数量及CTCs分型检测方法(纳米膜过滤、RNA原位杂交法)
1.5.1样本采集 使用8号采血针和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝采血管采集7.5 mL外周血。将样本保存管插入孔内,使孔中针头刺穿样本保存管橡胶塞,EDTA抗凝采血管内的血液将自动输入样本保存管内。待样本保存管内的液面不再上升后,拔出样本保存管,上下颠倒混匀10次,室温放置30 min。
1.5.2CTCs的分离富集 离心去除上清,固定剂固定8 min。通过真空歧管将过滤器与真空泵连接,将样本保存管中的液体转移至纳米膜过滤器中,甲醛溶液室温固定60 min。
1.5.3上皮型、混合型、间质型CTCs的分型鉴定 固定后的样本进行探针杂交CTCs分型鉴定。透化剂孵育5 min,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤3次。消化酶孵育60 min,PBS洗涤3次。加入探针工作液,(40±1)℃孵育3 h,洗涤3次。加入预扩增工作液,(40±1)℃孵育30 min,洗涤3次。加入扩增工作液,(40±1)℃孵育30 min,洗涤3次。加入显色工作液,(40±1)℃孵育30 min,洗涤3次,在样本上加抗淬灭剂(含DAPI)。
CTCs分型检测技术采用多重RNA探针,分别针对上皮型CTCs特异性基因EpCAM、CK8、CK18、CK19,间质型CTCs特异性基因Vimentin、Twist进行检测(探针序列见表1)。使用扩增探针与标记有荧光基团的上述分型标记探针进行杂交,产生荧光信号,利用自动识别系统阅读荧光信号,通过不同颜色荧光信号,自动判断CTCs分型检测结果。免疫荧光检测标准判读:上皮型CTCs显示为红色荧光信号点,间质型CTCs显示为绿色荧光信号点,同时表达上皮型和间质型特异性基因的CTCs为混合型(同时显示红色荧光及绿色荧光信号点)。
表1 核酸探针序列

基因序列(5′→3′)EpCAMTGGTGCTCGTTGATGAGTCAAGCCAGCTTTGAGCAAATGAAAAGCCCATCATTGTTCTGGCTCTCATCGCAGTCAGGATCTCCTTGTCTGTTCTTCTGACCTCAGAGCAGGTTATTTCAGCK8CGTACCTTGTCTATGAAGGAACTTGGTCTCCAGCATCTTGCCTAAGGTTGTTGATGTAGCCTGAGGAAGTTGATCTCGTCCAGATGTGTCCGAGATCTGGTGACCTCAGCAATGATGCTGCK18AGAAAGGACAGGACTCAGGCGAGTGGTGAAGCTCATGCTGTCAGGTCCTCGATGATCTTGCAATCTGCAGAACGATGCGGAAGTCATCAGCAGCAAGACGCTGCAGTCGTGTGATATTGGCK19CTGTAGGAAGTCATGGCGAGAAGTCATCTGCAGCCAGACGCTGTTCCGTCTCAAACTTGGTTCTTCTTCAGGTAGGCCAGCTCAGCGTACTGATTTCCTCGTGAACCAGGCTTCAGCATCVimentinGAGCGAGAGTGGCAGAGGACCTTTGTCGTTGGTTAGCTGGCATATTGCTGACGTACGTCAGAGCGCCCCTAAGTTTTTAAAAGATTGCAGGGTGTTTTCGGGCCAATAGTGTCTTGGTAGTwistACAATGACATCTAGGTCTCCCTGGTAGAGGAAGTCGATGTCAACTGTTCAGACTTCTATCCCTCTTGAGAATGCATGCATTTTCAGTGGGCTGATTGGCACTTACCATGGGTCCTCAATAACD45TCGCAATTCTTATGCGACTCTGTCATGGAGACAGTCATGT
1.5.4检测结果的判读标准 本研究将CTCs数量及间质型CTCs比例同时增加认为CTCs进展;CTCs数量及间质型CTCs比例同时减少认为CTCs下降;CTCs数量及间质型比例变化趋势不相符定义为CTCs趋势待定。
1.6 统计学分析所有数据采用SPSS 20.0进行分析,连续性变量使用均值、标准差以及波动范围的表示方法,类别变量使用频数进行表示,连续性变量根据是否符合正态分布采用t检验或秩和检验,类别变量采用Pearsonχ2检验或Fisher’s确切概率检验,P<0.05为差异有统计学意义。
2 结 果
2.1 CTCs分型检测对肾癌治疗的实时监测作用
1例肾癌(T1bN0M0)行根治性肾切除患者,术后3月检测CTCs呈现进展趋势,给予分子靶向药物索拉菲尼辅助治疗0.8 g/d,持续用药3个月后停药,复查CTCs数量及间质型CTCs比例均呈现下降趋势。但在术后15个月(即停用辅助治疗后9个月),检测CTCs数量及间质型CTCs比例再次呈现上升趋势,影像学检查未见异常,术后18个月CT发现肺转移,与影像学检测比较,CTCs能提早3个月发现肿瘤的进展。给予索拉菲尼靶向治疗,术后21月(即靶向治疗3月后)复查CTCs较治疗前呈现下降趋势,术后24月(即靶向治疗6月后)胸部CT显示转移灶由治疗前最大径13 mm缩小至10 mm,缩小23.07%,CTCs呈现的下降趋势比影像学发现转移灶缩小提早3个月(图1)。
1例左肾癌(T2N0M0)患者行左肾根治性切除术,术后3个月发现CTCs数量及间质型细胞比例增加,影像学检查未发现异常;术后6个月CT及PET-CT发现右侧肾上腺转移,予右肾上腺转移灶切除,患者未同意应用分子靶向治疗,术后CTCs呈现下降趋势。术后24个月复查时发现CTCs再次出现进展趋势,同时CT发现左侧肾上腺转移灶,予左侧肾上腺切除,联合分子靶向治疗,治疗后CTCs呈现下降趋势(图2)。以上2例接受CTCs监测的个案病例,提示CTCs分型检测具有实时、早期评价疾病进展及治疗转归的作用。

图1 肾癌术后肺转移患者CTCs变化及CT表现
A:CTCs随访监测结果柱状图;B:术前肾CT轴位图(示左肾中部55×47 mm肾门肿瘤);C:分子靶向治疗前(示肺转移灶表现,转移灶最大径13 mm);D:分子靶向治疗半年后(肺转移灶较治疗前最大径缩小至10 mm)。AT:分子靶向辅助治疗;T:分子靶向治疗。

图2 左肾癌术后肾上腺转移患者CTCs变化及CT表现
A:CTCs随访监测结果柱状图;B:术前PET-CT示原发左肾癌;C:左肾根治性切除术后6月PET-CT发现右肾上腺占位,行右肾上腺肿瘤切除,术后病理证实右肾上腺转移癌;D:术后24月CT发现左肾上腺肿瘤,行左肾上腺切除,术后病理证实左肾上腺转移癌;E:左肾上腺转移瘤切除术后复查CT,未见局部异常。RAC:发现右肾上腺转移,行转移灶切除;LAC:发现左肾上腺转移,行转移灶切除。
2.2 CTCs分型检测对转移肾癌疗效评价的作用47例患者均完成12~27个月的随访,平均随访时间(13.0±8.5)个月。其中5例在随访期发生远处转移(1例肾上腺转移,4例肺转移)。转移患者中,3例给予治疗(1例肾上腺转移给予转移灶切除,2例肺转移给予分子靶向治疗),治疗后CTCs数量及间质型比例较治疗前呈下降趋势;2例因患者原因未接受治疗,CTCs总数及间质型CTC比例均呈进展趋势。
2.3 分子靶向治疗对CTCs数量及分型的作用16例CTCs呈进展趋势的患者中,11例未予干预,8例患者CTCs继续进展。5例患者给予索拉菲尼分子靶向治疗(2例为晚期治疗,3例为术后辅助),治疗后检测CTCs数量及间质型CTCs比例较治疗前均呈下降趋势(27.00±8.74vs.11.40±2.07;0.81±0.02vs.0.33±0.05)。靶向治疗组CTCs呈现下降趋势的患者比例高于未治疗组(表2)。
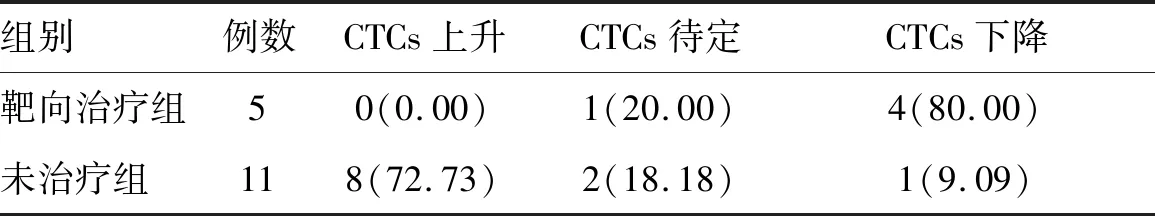
表2 靶向治疗与CTCs分型检测结果[例(%)]
3 讨 论
对肾癌的进展早发现早治疗,并对治疗效果进行实时、有效的评价意义重大[6]。目前肾癌监测手段主要靠影像学检查,但影像学检查对肾癌的进展及疗效判断具有滞后性,肿瘤体积发生一定变化后才会被影像学发现,不利于治疗效果的及时评价。寻找一种能够在治疗过程中对肿瘤进行重复监测,实时了解肿瘤治疗效果及进展风险的检查手段,对肾癌的治疗至关重要。
研究发现,CTCs与乳腺癌、结直肠癌、非小细胞肺癌等多种肿瘤的转移和复发显著相关[3]。CTCs检查仅需抽取少量外周血,具有取样简单、可重复性强、无创等诸多优点,对早期发现肿瘤微转移、评估预后和疗效以及肿瘤的个体化治疗具有重要意义[7]。在无法通过现有诊断模式如CT和PET-CT发现远处转移的患者中,约20%的患者可检测到CTCs,CTCs检测可以比CT、PET更早、更有效地诊断肿瘤复发和转移[8]。肾癌方面,我们前期研究发现CTCs数量及间质型CTCs比例的增加趋势与肾癌的进展转移具有显著相关性[5]。
一些研究发现,CTCs数量检测可评价肿瘤治疗效果。结直肠癌根治术后CTCs数量继续增加,则提示肿瘤复发转移的危险性增加[9]。对接受化疗的进展期结直肠癌患者研究发现,通过CTCs检测,可以有效地预测患者的OS[10]。在前列腺癌研究中发现,与PSA检测相比,CTCs能够更早地预测患者从治疗中的获益程度,在治疗的第2~5周PSA尚未有显著变化时,CTCs数量就出现具有统计学差异的变化,提示CTCs数量检测是早期,敏感的疗效评价指标。其次,通过ROC曲线对比CTCs数量和PSA的预测准确性,发现CTCs数量对治疗效果的预测准确性要比PSA更有优势[11]。
但在一些研究中发现,单纯的CTCs数量变化与治疗后疾病转归并不相符,CTCs分型检测中间质型CTCs的比例变化也同样重要。发表在Science上的一篇针对乳腺癌的研究发现,在接受治疗的肿瘤缓解病例中,仍有部分患者CTCs数量呈现上升趋势,另有一些患者即使治疗后CTCs数量呈现下降趋势,但疾病仍出现临床进展[12]。出现这种结果的原因是CTCs在形成过程中伴随着上皮-间质转化(epithelial-mesenchymal transition,EMT)过程,使得外周血循环肿瘤细胞包含上皮型、间质型和上皮/间质混合型的三种类型,与上皮型CTCs相比,间质型CTCs具有更强的侵袭转移能力,在肿瘤的转移过程同样起主要作用[13-15]。因此,仅仅依靠CTCs的数量不能准确评估肿瘤进展风险,还需要结合CTCs分型,即间质型CTCs的数量和比例来综合评估。上述乳腺癌研究中治疗后肿瘤进展病例中,虽然CTCs数量降低,但间质型细胞比例出现了增加;疾病缓解的病例中,虽然有CTCs数量的增加,但间质型细胞的比例却呈下降趋势,提示间质型CTCs比例的增高与乳腺癌预后呈负相关性[12]。因此,本研究在CTCs结果认定中,认为CTCs的进展或下降不仅表现为CTCs数量的增加或减少还应同时包括间质型CTCs比例的增高或降低。CTCs数量与间质型细胞比例出现相反趋势时,则认为趋势待定,需继续严密监测CTCs变化。本研究入组的5例转移性肾癌患者,2例未予治疗,3例给予转移灶切除或分子靶向治疗,其CTCs数量及间质型CTCs比例的变化趋势与肿瘤预后的关系,证实了CTCs检测是评价晚期肾癌治疗的有效方法。
CTCs数量及分型检测是否可以作为实时监测治疗效果的手段,是评价CTCs检测临床价值的另一重要因素。研究认为,CTCs检测对乳腺癌的治疗具有实时监测作用[12]。我们研究中的2例治疗转归颇为复杂的转移性肾癌个案,1例发生2次远处转移,1例进行2次靶向治疗。其CTCs检测的变化趋势与临床治疗转归一致,且CTCs检测均比影像学提早发现疾病的变化趋势,证实了CTCs检测对肾癌治疗的评价更具有早期、灵敏的优势。
分子靶向治疗对肾癌CTCs作用的研究文献不多。MUSELLA等[16]对结直肠癌患者应用西妥昔单抗、帕尼单抗靶向治疗并进行CTCs检测发现,治疗后CTCs阴性的患者比阳性者具有更长的无进展生存期。本研究发现,16例CTCs进展趋势的患者中,5例给予分子靶向治疗,其中2例属于转移性肾癌治疗用药,3例属于未转移的辅助靶向治疗,治疗后CTCs均呈显著下降的趋势。11例未予干预治疗,其中8例患者CTCs呈现进展趋势,靶向治疗组CTCs呈现下降的患者比例高于未治疗组。说明分子靶向治疗具有降低肾癌患者CTCs数量及间质型CTCs比例的作用。
综上,我们认为CTCs具有评价肾癌治疗效果的作用,CTCs数量及间质型细胞比例的下降与治疗有效相关。分子靶向治疗具有降低肾癌CTCs数量及间质型CTCs比例的作用。CTCs分型检测具有早期、灵敏的优势,可以作为实时监测治疗效果及疾病进展的手段。但本课题分子靶向治疗的例数较少,结果难免存在偏差,有待选取更大样本量进一步验证。
致谢:感谢辉瑞医学部宋旸博士给予的文献支持!
