层结构硫代锡酸盐的制备及去除痕量Cs+离子
2019-10-15孙千益李呈呈韩晴玉王榕静吕慧芸
那 平,孙千益,李呈呈,韩晴玉,王榕静,李 萌,吕慧芸
(天津大学化工学院,天津 300350)
2011年福岛的核泄漏导致日本关东和东北部广大地区被放射性核素污染,污染物主要包括131I、134Cs、137Cs和90Sr等放射性核素[1-3].其中137Cs是核裂变的产物之一,它能产生γ和高能 β粒子,因其半衰期长而构成长期风险[4].随着核电厂数量的增加,核废料平均每年增加 2300 t[5].核泄漏会给人类和生物圈造成难以估量的损失.因此,探索工艺简单、低廉和高效的材料去除 Cs+离子具有重要的应用价值.
工业分离核素常用有机化合物进行溶剂萃取,但对于痕量 Cs+离子的分离,溶剂萃取成本高且容易造成二次污染.而无机离子交换材料具有环保、低廉、高效率等特点,其在短时间内能快速吸附Cs+离子[6-7].报道的可交换 Cs+离子的无机离子交换材料有黏土矿物[8]、杂多酸盐[9]、亚铁氰化物[10]和金属硫化物[11-14]等.离子交换材料的吸附性能因元素组成和晶体结构不同而有所差异.
基于 S元素对 Cs+离子高效的诱导作用,并且Cs+离子的低水合能容易与 K+离子选择性交换[15],本文探索了通过引入 H+离子,调节硫代锡酸盐的结构,提高S和K元素含量,得到具有优异Cs+离子去除性能的硫代锡酸盐.相比已往的报道[11-14],本文的材料具有工艺简单、环保以及更优异的痕量 Cs+离子去除等特点.
1 实 验
1.1 实验原料
高纯度K2CO3(99%,Aladdin),锡粉(<150mm,99.5%,Aladdin),升华硫(99%,Aladdin),浓盐酸(36%~38%),高纯度CsCl(99%,Aladdin).
1.2 材料合成
3种材料的合成反应同步进行.Sn粉(9mmol)在浓盐酸浸泡1min后,分别放入3个25mL聚四氟乙烯反应釜内,将 K2CO3(6mmol)和 S粉(对于HKTS-1和 HKTS-2是 30mmol,对于 HKTS-3是40mmol)依次加到3个反应釜内,各加入1mL去离子水并搅拌均匀,HKTS-1对应的反应釜内再加入0.3mL浓盐酸.反应釜密封并置于 200℃的烘箱内持续 15h.反应结束后冷却至室温.用去离子水和乙醇洗涤数次,离心分离产物,真空下冷冻干燥得到HKTS-1、HKTS-2和 HKTS-3.
1.3 Cs+离子吸附实验
Cs+离子吸附实验过程是将 10mg材料放入20mL玻璃瓶内,加入 10mL Cs+离子溶液,磁力搅拌,达到指定时间后,取出悬浮液过滤,用 ICP-MS检测 Cs+离子质量浓度.Cs+吸附动力学实验在1018μg/L 的Cs+离子溶液中进行,分别在5、15、30、60、120和300min时取样并检测Cs+离子浓度.分别配置质量浓度为 1、64、157、252、386、542、826 和1185mg/L的 Cs+离子溶液,在室温下吸附 20min后,通过ICP-MS或ICP-OES进行检测.最后根据吸附容量数据拟合出吸附平衡等温线.
1.4 表征方法
X 射线衍射(XRD,D8Focus,Bruker AXS)扫描范围 5°~80°,扫描速度 8°/min.在 785nm 恒定波长激光的拉曼(Raman)系统上收集样品的拉曼光谱数据.样品与KBr混合压片制得待测样品,进行红外光谱(FT-IR,Nicolet 6700)分析,扫描范围从 400~4000cm-1.用配备有 ESED II检测器的 Hitachi S-4800扫描电子显微镜(SEM)分析了材料的形貌,使用能量色散谱(EDS)分析了元素含量,加速电压为15kV.在 200kV电压下进行透射电镜分析(TEM,JEM-2100F).使用PERKINELZZR PHI1600Xi光谱仪进行 X射线光电子能谱(XPS)分析.热重分析(TG)使用SF/1382Mettler-Toledo系统在氮气气氛下进行,测试温度范围为 35~600℃,升温速率为10℃/min.使用电感耦合等离子体质谱仪(ICP-MS,PE 300D)和电感耦合等离子体原子发射光谱仪(ICPOES,PE ICP8000)收集Cs+离子浓度数据.
2 结果与讨论
2.1 X射线衍射
利用XRD收集3种硫代锡酸盐的衍射峰峰位置和晶面间距信息.图1为3种材料的XRD衍射图,主要特征峰对应(020)和(040)晶面[5],表 1给出对应的衍射角度和晶面间距.与 HKTS-2对比,HKTS-1和HKTS-3的衍射峰峰位置都向高角度方向移动,同时晶面间距变小.这是由于原料中增加 H+离子后,材料结构中的H元素部分代替了K元素,导致晶面间距缩小.XRD证实引入H+离子成功实现了结构调控,随着 H+离子引入量的增加,(020)和(040)晶面间距呈缩小趋势.

图 1 HKTS-1、HKTS-2和 HKTS-3的 XRDFig.1 X-ray diffraction of KTS-1,HKTS-2,and HKTS-3
根据 XRD数据,利用 unitcell软件计算获得材料的晶胞体积.结果显示,HKTS-1、HKTS-2和HKTS-3的晶胞体积分别是0.294、0.994和0.798nm3.晶胞体积变化表明,随着原料中 H+离子引入量的增加,晶胞体积呈缩小趋势.

表1 (020)和(040)的衍射峰及晶面间距Tab.1 Diffraction peaks and crystal plane spacing of(020)and(040)
2.2 拉曼光谱
利用拉曼光谱收集材料的特征峰峰位,进而对材料的结构组成进行分析,如图 2所示.3种材料的拉曼光谱基本一致,以 HKTS-3为例进行分析.拉曼光谱在 317、349 cm-1处出现两个清晰的峰,在 98、179、274、381cm-1处出现 4个小峰.317和 349cm-1处的峰与[SnS6]八面体 Sn—S键振动一致,381 cm-1处的峰与[SnS4]四面体 Sn—S键振动一致[5],根据对应的强度判断主要由[SnS6]八面体组成骨架结构.274cm-1峰与 K+离子相关的振动有关[5],表明 K元素进入晶体内.98cm-1处的峰与来自晶格的客体氢离子旋转振动有关[16],表明 H元素进入晶体内.179cm-1处的峰与集体晶格振动有关.因此证明了材料的骨架结构由[SnS6]八面体以及少量的[SnS4]四面体组成,并且H和K元素进入晶体结构内.

图2 HKTS-3的拉曼光谱Fig.2 Raman spectroscopy of HKTS-3
2.3 红外光谱
利用红外光谱分析引入H元素对3种材料官能团和结构的影响,如图3所示.结果显示HKTS-1与HKTS-2的红外吸收峰一致.与 HKTS-1和 HKTS-2相比,HKTS-3出现1145、1008和 658cm-1吸收峰,对应K—S基团的振动吸收峰[5].HKTS-1和HKTS-2同样也含有K元素,但并没有显示出K—S基团的振动吸收峰.这是由于在HKTS-1和HKTS-2中,K元素是一种游离态,多用于平衡电荷,而在 HKTS-3中,K 元素以结合状态参与结构的形成[5],这与拉曼光谱的结论是一致的.

图3 HKTS-1、HKTS-2和HKTS-3的红外光谱图Fig.3 Infrared spectra of HKTS-1,HKTS-2,and HKTS-3

图4 HKTS-1、HKTS-2和HKTS-3的SEM图Fig.4 SEM images of HKTS-1,HKTS-2,and HKTS-3
2.4 材料微观形貌
利用扫描电镜和透射电镜分析了 H元素结构调控对材料微观形貌的影响.图 4中(a)、(b)、(c)分别是HKTS-1、HKTS-2和HKTS-3的扫描电镜图.3种材料的形貌均为多层结构,并且尺寸较大,达到10.图 5中(a)、(b)分别是不含 H 元素的 KTS-3[5]和含有H元素的 HKTS-2的微观形貌图.从图中可以看出,未引入 H元素的材料形成的片层弯曲未超过 90°,并且片层发生断裂现象;而引入 H元素的材料形成的片层可折叠 180°,这表明 H元素对硫代锡酸盐的形貌结构产生了影响.

图5 KTS-3和HKTS-2的微观形貌图Fig.5 Micromorphology images of KTS-3 and HKTS-2
图 6(a)、(b)、(c)分别是 HKTS-1、HKTS-2 和HKTS-3的高分辨透射电镜图.HKTS-1、HKTS-2和HKTS-3的条纹间距分别是 0.31nm、0.34nm 和0.32nm.结果表明,晶面条纹均匀排列,并且随着结构内 H元素引入量的增加,晶面条纹的间距呈缩小的趋势.

图6 HKTS-1、HKTS-2和HKTS-3的TEM图Fig.6 TEM images of HKTS-1,HKTS-2,and HKTS-3
2.5 能量色散谱
利用能量色散谱(EDS)分析了材料的平均K、S、Sn元素含量,结合电荷守恒得到化学式分别是H4xK2xSn2-xS4+x(x=0.5~0.6,HKTS-1)、H3.6xK2.4xSn2-xS4+x(x=0.5~0.6,HKTS-2)和 H3.63xK2.37xSn2-xS4+x(x=0.5~0.7,HKTS-3).表 2列出 K、S和 Sn元素的平均含量.结果表明,引入 H 元素后,3种材料的元素组成产生变化,其中 HKTS-3具有最高的 K和S元素含量,分别达到14.9%和39.6%.未引入H元素的硫代锡酸盐 KTS-3[5]、KMS-1[12]和 KMS-2[13],硫含量分别是 34.2%、34.3%和 35.8%,钾含量分别是9.6%、10.1%和10.9%.本文材料中的S和K含量相比明显提升.这是因为相比于 Sn—S键,H—S键能更大,更容易成键[5,20].因此,引入H元素后,减少了单位体积内 Sn—S键的生成,从而提高了 S元素的含量.另一方面,单位体积内 S原子数量增多则需更多的K+离子来平衡电荷,最终导致S和K元素含量的增加.
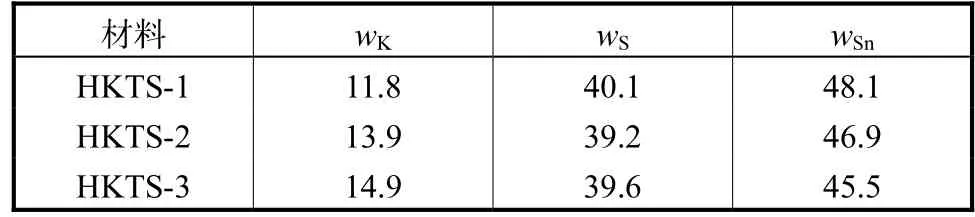
表2 K、S和Sn元素的EDS分析Tab.2 EDS analysis of K,S,and Sn elements %
2.6 X射线光电子能谱
利用 X射线光电子能谱(XPS)分析 HKTS-3表面元素的组成、价态和结合能,如图 7所示.图 7(a)为XPS全谱,显示存在K、S、Sn元素并且是HKTS-3的主要组成元素.图7(b)中486.4和494.8eV处的特征峰对应Sn4+阳离子的3d5/2和3d3/2的特征,表明Sn元素为+4价[5].图7(c)中293.1和295.8eV处的特征峰对应 K+阳离子的 2p3/2和 2p1/2的特征,表明K元素为+1价[5].图7(d)中S元素的2p轨道在结合能 158~167eV范围内出现两个宽峰和两个小峰.经过软件拟合处理,两个宽峰可分为 161.1、161.5和162.4eV的3个峰,分别对应2p3/2、2p3/2硫化物阴离子和 2p1/2硫化物阴离子的特征,表明 S元素为-2价[17-19].在 164.3eV处的特征峰对应 S—H键的特征[20],表明H元素以成键的形式进入HKTS-3结构内.XPS结果证实 HKTS-3由 K、Sn、S元素组成并且出现 S—H键的特征,K 为+1价,Sn为+4价,S为-2价.
2.7 热失重
利用热失重表征考察材料的热稳定性与组成结构差异,如图8所示.数据表明,在35℃至187℃的升温过程中,材料的质量损失约 4% ,这是材料中吸附水和结晶水的总质量[11].温度升高至 187℃时,3种材料开始不同程度的分解.当温度升高至 350℃,HKTS-1的质量损失约 27%,HKTS-2损失约 10%,HKTS-3损失约 16%.对热失重后的材料进行 EDS分析,发现热失重损失的主要是 S元素.3种材料的热失重顺序依次是 HKTS-1>HKTS-3>HKTS-2,这与 H+离子引入量的顺序一致.当温度超过 187℃,材料中的H和S元素从结构中以H2S的形式分解出来,导致了结构的破坏[11].热失重证实了H元素能够调节硫代锡酸盐的组成和结构.
2.8 Cs+离子吸附动力学
Cs+离子吸附动力学如图9所示,结果表明:3种材料都在 5 min内快速达到吸附平衡;HKTS-1将Cs+离子质量浓度从 1018μg/L 降至 124μg/L,去除率为 87.8%;HKTS-2将 Cs+离子质量浓度降至75 μg/L,去除率为 92.6%;HKTS-3将 Cs+离子质量浓度降至 23 μg/L,去除率为 97.7%.材料快速吸附Cs+离子是因为S2-阴离子配体对Cs+离子高效的诱导作用[11].并且,材料内的高K+浓度与溶液中的低Cs+离子浓度形成较大的浓度差推动力,这也加速了离子交换的进行[11].与不含 H 元素的 KTS-3[5]和 FJSMSnS[11]硫代锡酸盐相比,本文 3种材料的 Cs+离子吸附性能均有所提高,其中HKTS-3表现出更优异的痕量Cs+离子吸附特性.其原因为HKTS-3具有更高的K和 S元素含量,更多的 S2-离子配体对 Cs+离子高效的诱导作用促使了更多的 Cs+被 K+离子交换[12-13].Cs+离子吸附动力学证实了材料内的 K+离子容易交换Cs+离子,K和S元素含量的增加,提高了Cs+离子的痕量吸附性能,其中 HKTS-3具有高效的痕量 Cs+离子吸附能力,有望应用于处理核废料.

图7 HKTS-3的XPSFig.7 X-ray photoelectron spectroscopy images of HKTS-3

图8 热失重(TG)Fig.8 Thermogravimetrics
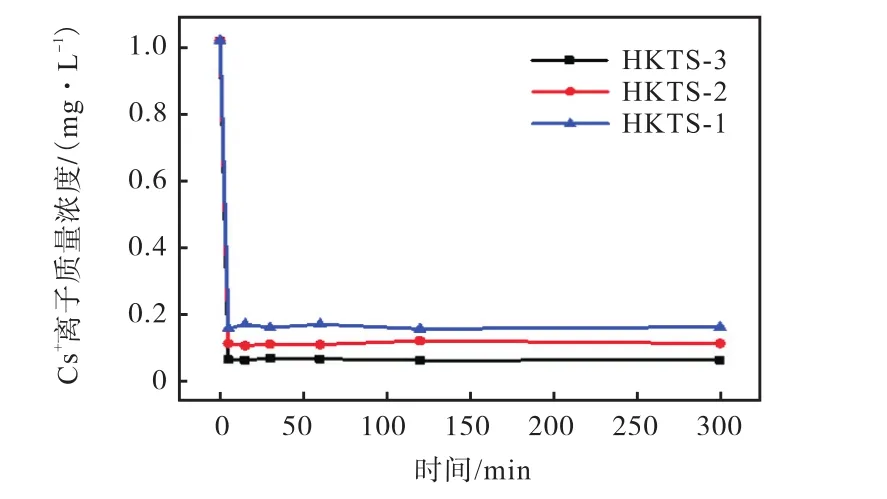
图9 Cs+离子吸附动力学Fig.9 Adsorption kinetics of Cs+ ion
2.9 Cs+离子吸附容量
Cs+离子吸附容量是离子交换材料吸附性能的重要参数之一.通过拟合吸附容量数据,表明该吸附过程符合Langmuir吸附,平衡吸附容量曲线如图10所示,表3列出拟合参数.结果显示,HKTS-1、HKTS-2和 HKTS-3的饱和吸附容量分别是 268、372和343mg/g.材料的Cs+离子吸附过程符合Langmuir吸附模型,这得益于材料是由众多薄层组成的,其吸附过程发生在均匀的薄层表面,并且 Cs+离子被吸附后不易从一个吸附位点迁移至另一个吸附位点[5].硫代锡酸盐的吸附过程是通过溶液中的 Cs+离子与材料内的K+离子交换实现的[12-13],而Langmuir饱和吸附容量与理论吸附容量有一定差距,报道的锡酸盐表明这或许是离子的尺寸效应或晶体的空间尺寸效应造成的[11-14].Cs+离子交换容量实验进一步证实了 H元素调控对材料的 Cs+离子交换容量产生影响.随着材料中 H元素含量增加,Cs+离子吸附容量呈现逐渐缩小的趋势.
上述Langmuir拟合方程[11]为
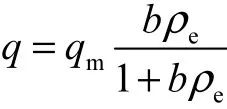
式中:q为在平衡浓度下交换的阳离子量,mg/g;qm为最大阳离子交换容量;b为 Langmuir常数,L/mg;ρe为Cs+交换平衡浓度,mg/L.

图10 Cs+离子平衡吸附容量Fig.10 Equilibrium adsorption capacity of Cs+ ion

表3 Langmuir等温线参数Tab.3 Langmuir isothermal parameters
3 结 论
(1) 使用溶剂热法合成了具有最佳配比的多层结构硫代锡酸盐 H3.63xK2.37xSn2-xS4+x,微观尺寸达到10μm,该材料由[SnS6]八面体构成基本骨架,H+和K+离子作为平衡电荷.材料制备过程中,通过H元素的引入,成功实现了硫代锡酸盐结构的有效调控.
(2) H元素能够调节硫代锡酸盐的元素含量,元素含量变化导致晶体结构变化,随着 H元素含量增加,晶面间距、晶体体积减小.同时,引入 H元素后,H元素与S元素成键,S和K元素的含量明显增加,其中 HKTS-3具有最高的 K和 S元素含量,分别达到14.9%和39.6%.
(3) 硫代锡酸盐中的H元素含量影响K和S元素的含量,进而影响材料的 Cs+离子吸附性能,随着H 元素含量增加,Cs+离子吸附容量减小.硫代锡酸盐内的 K+离子容易与 Cs+离子交换,其中 HKTS-3在 5min内将 Cs+离子质量浓度从 1018μg/L降至23μg/L,去除率最高达到 97.7%,Cs+离子交换容量达到 343mg/g.与传统的金属硫化物相比,HKTS-3合成工艺简单、结构可调控,有望应用于核废料处理.
