玉竹连作对土壤微生物区系的影响
2019-10-15段良霞
张 周,盛 浩,袁 红,段良霞,张 亮
(湖南农业大学资源环境学院,湖南 长沙 410128)
玉竹(Polygonatum odoratum(Mill.)Druce),别名铃铛菜、尾参、地管子和甜草根,是百合科黄精属多年生草本植物[1],富含氨基酸、微量元素、多糖和苷类等化学成分,可增强人体免疫力,有效延缓衰老、促进淋巴细胞转化[2],对人体有较多用处。玉竹既可食用,又可药用,在我国分布广泛,较为出名的一种是湖南的湘玉竹,它已成为当地重要的经济来源。近年来,由于玉竹连年连片种植,产地病虫害越来越重,已严重影响玉竹的品质,成为玉竹生产开发的主要障碍[3]。湖南地区的玉竹大片连作不仅影响其产量和质量,对当地的土壤微生物区系和土壤养分也造成不同程度的影响。
连作障碍是指在同一块土壤中连续栽培同种或同科作物时,即使在正常的栽培管理状况下,也会出现生长势变弱、产量降低、品质下降、病虫害严重的现象,在日本被称为“忌地”现象,在欧美国家被称为“再植问题”,我国称其为“重茬问题”[4]。植物连作通常会导致土壤养分失衡、理化性质恶变、微生物群落变化、作物自毒物质积累等[5]。基于土壤微生物群落变化的研究层面,植物连作后,由于长期受同一类根系分泌物的影响,土壤微生物群落会发生选择性富集,导致土壤微生物群落数量发生变化,如连作后土壤中细菌、真菌和放线菌等的数量变化[6]。一般连作年限越长,土壤中微生物群落数量变化程度越大。为了解释连作障碍的形成机理,国内外众多学者对作物连作问题进行研究,分析了造成连作障碍的几大原因,包括:土壤微生物生物学环境改变;土壤酸碱度改变;土壤营养成分改变;植物化感作用。大量试验表明,土壤微生物区系变化和群落结构、病原微生物数量改变及植物的化感作用,是造成作物连作障碍主要因素之一[7-14]。
纵观国内外各学者的大量试验,目前研究连作对土壤生物学环境的影响,大多是与保护地蔬菜连作有关,如黄瓜、番茄、玉米等,与药食兼用植物尤其是玉竹的相关研究少有文献报道,其中肖岚等[3]通过对玉竹根际土壤有机化合物的鉴定,发现玉竹连作土壤中有多种化感物质,与作物的自毒作用共同造成玉竹的连作障碍,但关于玉竹连作土壤中微生物区系的具体分析鲜见报道。
本文对连作3年的玉竹根际土壤和种植1年的玉竹根际土壤中3大类群土壤微生物(细菌、真菌、放线菌)以及主要功能微生物的数量进行了分析,以期初步探明玉竹连作对土壤微生物区系的影响,为连作障碍机理研究、提高玉竹的产量和质量、实现玉竹生产的可持续发展提供科学依据。
1 材料和方法
1.1 取样点概况及取样方法
供试土壤采集于2018年2月,地点位于长沙县高桥镇玉竹种植园,采集对象为连作3年的玉竹根际土壤(板页岩母质风化的红壤),并以种植1年的玉竹根际土壤为对照。
采用五点法选择采样对象,小心剥离玉竹植株周围土壤,并轻轻拔出,收集根表附着土壤作为根际土壤,混匀后按四分法处理,取约500 g样品装入塑料袋中,带回实验室。将采集到的土壤去除明显可见的未分解和半分解动物、植物残体和较大的石砾,用2 mm筛子过筛后装入灭菌的密封塑料袋,置于4 ℃冰箱保存、备用。
1.2 培养基与试剂
细菌[15]:牛肉膏蛋白胨琼脂培养基(蛋白胨5 g、牛肉膏3 g、水1 L、琼脂18 g)。
放线菌[15]:改良高氏Ⅰ号培养基(淀粉20 g、NaCl 0.5 g、KNO31 g、FeSO4·7H2O 0.01 g、K2HPO40.5 g、MgSO4·7H2O 3 g、水1 L、琼脂18 g)。
真菌[15]:马丁培养基(葡萄糖10 g、蛋白胨5 g、K2HPO41 g、MgSO4·7H2O 0.5 g、10 g/L孟加拉红液3.3 mL、水1 L、琼脂18 g)。
好氧自生固氮菌[15]:瓦克斯曼77号培养基(葡萄糖10 g、K2HPO40.5 g、MgSO4·7H2O 0.2 g、NaCl 0.2 g、FeCl3·6H2O微量、MnSO4·4H2O微量、10 g/L刚果红溶液5 mL、蒸馏水1 L、琼脂18 g)。
氨化细菌[15]:牛肉膏蛋白胨琼脂培养基(蛋白胨5 g、MgSO4·7H2O 0.5 g、KH2PO40.5 g、蒸馏水1 L、K2HPO40.5 g、琼脂18 g)。
硝化细菌[15]:氨氧化细菌(亚硝化细菌)培养基(CaCO35 g、MgSO4·7H2O 0.03 g、(NH4)2SO42 g、MnSO4·4H2O 0.01 g、K2HPO40.75 g、蒸馏水1 L、NaH2PO40.25 g)。
有机磷细菌[15]:蒙金娜有机磷培养基(葡萄糖 10 g、NaCl 0.3 g、CaCO35 g、卵磷脂 0.2 g、(NH4)2SO40.5 g、MnSO4·4H2O 0.03 g、MgSO4·7H2O 0.3 g、KCl 0.3 g、FeSO4·7H2O 0.3 g、蒸馏水1 L)。
无机磷细菌[15]:磷酸三钙无机磷培养基(葡萄糖10 g、MgSO4·7H2O 0.3 g、Ca3(PO4)210 g、FeSO4·7H2O 0.03 g、(NH4)2SO40.5 g、MnSO4·4H2O 0.03 g、NaCl 0.3 g、蒸馏水1 L、KCl 0.3 g)。
格利斯试剂A液[15]:0.5 g对氨基苯磺酸加到150 mL 200 g/L的乙酸溶液中;B液:1 g酸溶萘胺加到20 mL蒸馏水和150 mL 200 g/L的乙酸溶液中。40 g/L的钼酸铵试剂:18 g化学纯钼酸铵结晶溶于420 mL蒸馏水,渐渐加入30 mL浓硫酸,充分振荡,使结晶完全溶解,保存在棕色玻璃瓶中待用。还原剂:15 g化学纯亚硫酸氢钠溶于250 mL蒸馏水中,加入1.5 g亚硫酸钠和1,2,4-氨基萘酚磺酸,完全溶解后,用蒸馏水稀释至500 mL。
1.3 试验方法
1.3.1 3大土壤微生物的计数
分别称取10 g新鲜连作土样和对照土样,加入盛有90 mL无菌水的250 mL三角瓶中,置于摇床中振荡15 min,制备使土样均匀地分散在稀释液中的土壤悬液;吸取0.5 mL土壤悬液到4.5 mL无菌水中,按10倍法依次稀释成10-2、10-3、10-4、10-5、10-6稀释液[15]。
细菌:用0~100 μL移液枪各吸取100 μL 10-5、10-6稀释土壤悬液,接入牛肉膏蛋白胨琼脂培养基表面,立即用玻璃刮刀将接入培养基表面的悬液涂抹均匀,每一个稀释度3个重复。将平板倒置,在培养箱中28 ℃培养3~4 d后观察并计数。
放线菌:用0~100 μL移液枪各吸取100 μL 10-4、10-5稀释土壤悬液,接入改良高氏Ⅰ号培养基表面,立即用玻璃刮刀将接入培养基表面的悬液涂抹均匀,每一个稀释度3个重复。将平板倒置,28 ℃培养5~7 d后观察并计数。
真菌:用0~100 μL移液枪各吸取100 μL 10-2、10-3稀释土壤悬液,接入马丁培养基表面,立即用玻璃刮刀将接入培养基表面的悬液涂抹均匀,每一个稀释度3个重复。将平板倒置,在培养箱中28℃培养2~3 d后观察并计数。
1.3.2 主要功能土壤微生物计数
好氧自生固氮菌:用0~100 μL固氮移液枪各吸取100 μL 10-2、10-3稀释土壤悬液,接入瓦克斯曼77号培养基表面,立即用玻璃刮刀将接入培养基表面的悬液涂抹均匀,每一个稀释度3个重复。将平板倒置,在培养箱中28 ℃培养7 d后观察并计数[15]。
氨化细菌:用0~100 μL移液枪各吸取100 μL 10-5、10-6稀释土壤悬液,接入牛肉膏蛋白胨琼脂培养基表面,立即用玻璃刮刀将接入培养基表面的悬液涂抹均匀每一个稀释度3个重复。将平板倒置,在培养箱中28 ℃培养5~7 d后观察并计数[15]。
硝化细菌:用1.0~5.0 mL移液枪各吸取1 mL 10-5、10-6稀释土壤悬液,接入装有5 mL氨氧化细菌(亚硝化细菌)培养基的试管中,每一个稀释度接种3个试管,另取2只培养基接种无菌水作对照。在培养箱中28 ℃培养14 d,吸取培养液5滴于白瓷板穴中,依次加入格利斯试剂A液、B液各1滴,如有亚硝酸(NO2)存在,则呈红色,表示亚硝酸化细菌存在。依据“最大或然数法”计算结果[15]。
有机磷细菌:用1.0~5.0 mL移液枪各吸取1 mL 10-4、10-5、10-6稀释土壤悬液,接入装有5 mL蒙金娜有机磷培养基的试管中,每一个稀释度4个重复,另取6只培养基接种无菌水作对照。在培养箱中28 ℃培养5 d,加40 g/L的钼酸铵试剂2 mL于试管中,在沸水浴中加热2 min。取出后加入还原剂1 mL,有磷酸时呈蓝色反应。依据“最大或然数法”计算结果[15]。
无机磷细菌:用0~100 μL移液枪各吸取100 μL 10-5、10-6稀释土壤悬液,接入磷酸三钙无机磷培养基表面,立即用玻璃刮刀将接入培养基表面的悬液涂抹均匀,每一个稀释度3个重复。将平板倒置,在培养箱中28 ℃培养7 d后观察并计数[15]。
1.4 微生物数量计算公式
1.4.1 涂布法
菌数=(菌落平均数×稀释倍数×20×鲜土质量)/干土质量,单位为CFU/g[15]。
1.4.2 最大或然数法
菌数=(近似值×数量指标首位稀释倍数×鲜土质量)/干土质量,单位为CFU/g[15]。
1.5 数据分析
采用Microsoft Excel 2010软件对试验所得数据进行分析并绘制图表,采用DPS 7.05软件对数据进行显著性差异分析。
2 结果与分析
2.1 玉竹连作对土壤3大类群微生物区系的影响
玉竹连作影响土壤3大类群微生物的区系,由表1知,连作玉竹根际土壤与种植1年玉竹的土壤3大类群微生物的数量均表现为细菌>放线菌>真菌。与对照相比,连作土壤中细菌和放线菌的数量均减少,而真菌的数量增多。连作根际土壤细菌、放线菌总数分别比对照降低了12.4%、13.2%,且均与对照差异显著。连作根际土壤真菌总数达1.05×106CFU/g,较对照显著增加了239%。
2.2 玉竹连作对土壤功能微生物的影响
2.2.1 玉竹连作对土壤好氧自生固氮菌、氨化细菌、硝化细菌数量的影响
从图1可以看出,连作玉竹根际土壤中的好氧自生固氮菌和氨化细菌数量均少于种植1年玉竹的土壤中的数量,而硝化细菌数量则大致相同。其中,连作玉竹根际土壤中好氧自生固氮菌的数量为2.51×106CFU/g,氨化细菌的数量为2.74×107CFU/g,种植1年玉竹的土壤中好氧自生固氮菌的数量为3.87×106CFU/g,氨化细菌的数量为5.33×107CFU/g。经过分析,连作后土壤中的好氧自生固氮菌数量仅为种植1年玉竹的土壤中的64.9%,数量变化差异未达到显著水平。连作根际土壤中的氨化细菌的数量较种植1年玉竹的土壤中的数量减少了将近36.3%,数量变化差异显著。连作玉竹根际土壤中硝化细菌的数量和种植1年玉竹的土壤中硝化细菌的数量均大约为1.45×106CFU/g,分别占连作玉竹根际土壤和种植1年玉竹的土壤中的细菌总数的0.004 2和0.003 7。
2.2.2 玉竹连作对土壤有机磷细菌、无机磷细菌数量的影响
从图2可知,种植1年玉竹的土壤中的有机磷细菌的数量为1.45×106CFU/g,连作玉竹根际土壤中的有机磷细菌的数量为1.65×106CFU/g,两者相差约12.1%。连作玉竹根际土壤和种植1年玉竹的土壤中的有机磷细菌的数量相差不多,但连作玉竹土壤中无机磷细菌数量为1.24×107CFU/g,对照土壤中无机磷细菌数量为4.29×107CFU/g,约是连作玉竹根际土壤中无机磷细菌的3.5倍。
3 结论与讨论
土壤中的细菌、放线菌和真菌的数量是衡量土壤中微生物区系状况的一个重要指标。大量研究表明,连作后土壤中细菌和放线菌的数量急剧下降,真菌的数量显著上升。刘晔等[16]对不同连作年限对植烟土壤微生物区系的研究发现,细菌、放线菌数量随连作年限的增加而减少,但真菌数量变化相反,随着连作年限的增加而增加。黄玉茜等[17]的研究发现,随连作年限增加,花生根际土壤中的细菌数量和放线菌数量减幅明显,同时真菌数量增加幅度较大。本研究结果表明,经过3年的连作,细菌和放线菌数量显著减少,而真菌的数量则大幅度增加。土壤中细菌和放线菌数量减少,真菌数量增加,会使得植物很容易被土传病害感染,同时土壤的肥力也会在一定程度上被削弱。

表1 细菌、放线菌与真菌数量
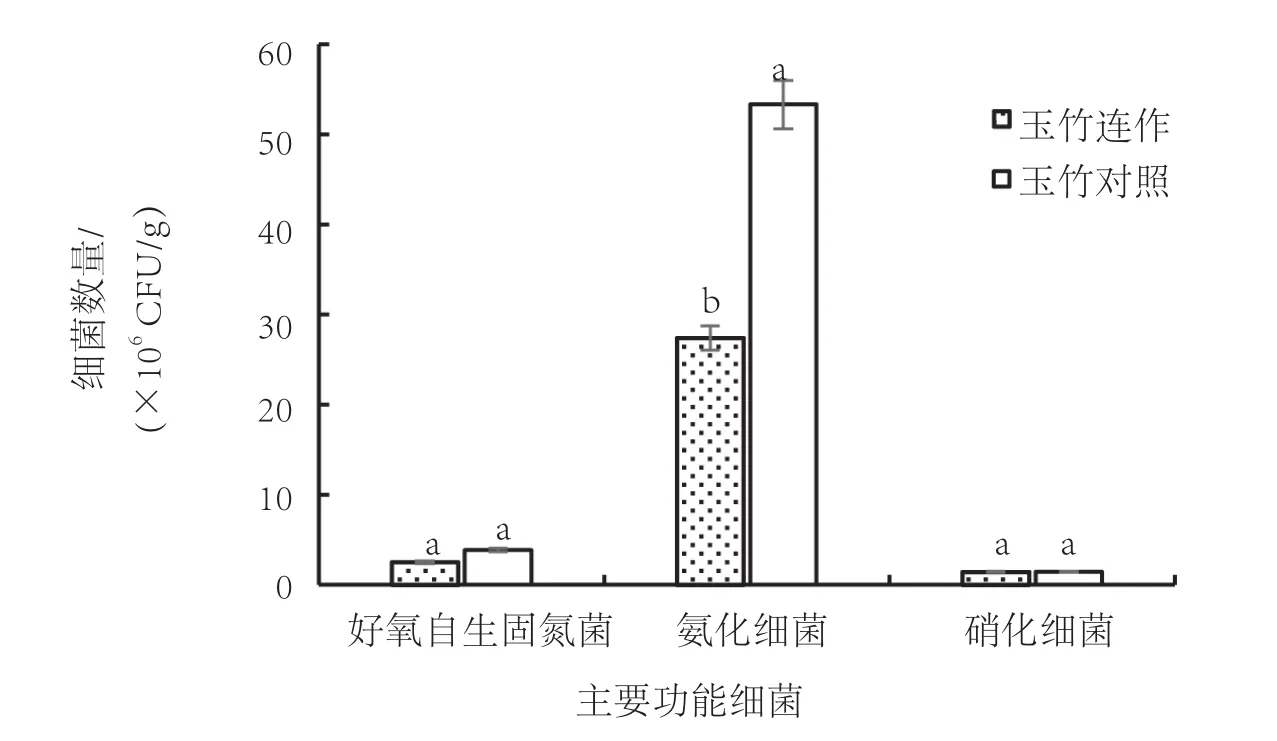
图1 玉竹连作对土壤好氧自生固氮菌、氨化细菌、硝化细菌数量的影响

图2 玉竹连作对土壤有机磷细菌和无机磷细菌数量的影响
除了土壤中的3大类群微生物(细菌、放线菌、真菌)的数量在连作后会发生明显变化,土壤中的功能微生物数量也会发生一定的变化。连作玉竹根际土壤中的好氧自生固氮菌、氨化细菌、无机磷细菌的数量均有不同程度的减少,而有机磷细菌和硝化细菌的数量变化不大。功能微生物的减少,会导致土壤中的微生物量碳和微生物量氮相对减少,从而影响植物的生长质量和最终的产量。
连作年限的增加,会使得土壤微生物的区系发生变化,从而影响玉竹生长的土壤环境,进而影响玉竹的产量、质量,甚至影响连作地块的土壤肥力。故采取一定的措施如合理的施用有机肥和无机肥改善土壤中微生物的区系,对改良土壤和植物良好生长有一定的稳定作用。
