CXCR4及CD44和CD133的表达与上皮性卵巢癌临床病理特征的相关性*
2019-10-11陈永香文芳吴金健吴章颖訾聃
陈永香,文芳,吴金健,吴章颖,訾聃***
(1.贵州医科大学 临床医学院,贵州 贵阳 550004; 2.贵州医科大学附院 临床研究中心,贵州 贵阳 550004; 3.贵州医科大学附院 妇产科,贵州 贵阳 550004)
卵巢癌(ovarian cancer)位列女性最常发生癌症的第8位[1],而上皮性卵巢癌(epithelial ovarian carcinoma,EOC)占卵巢癌的90%,因其早期临床症状不明显,易于转移及广泛播种,70%的患者在诊断时已处于晚期[2]。由于卵巢癌较易发生侵袭转移和肿瘤复发,5年生存率仅40%[3]。目前针对卵巢癌的治疗主要是手术联合化疗,但治疗效果往往不尽如人意,约60%~85%的卵巢癌患者在完成初级治疗后复发[4]。在对肿瘤的研究中,趋化因子受体4(Chemokine receptor 4,CXCR4)可作为疾病进展的标志物[5], CXCR4还参与了肿瘤的耐药性[6];表面黏附分子CD133常在成体干细胞中表达,通过抑制分化来维持干细胞特性;CD44是参与细胞与细胞相互作用(黏附和迁移)的细胞表面糖蛋白[7]。本研究拟通过检测卵巢良恶性肿瘤组织中CXCR4、CD44及CD133的表达来探究3者对上皮性卵巢癌的影响。
1 资料与方法
1.1 基本资料
收集2015年8月-2017年4月EOC(浆液性卵巢癌、黏液性卵巢癌、混合性上皮性癌)患者病理蜡块标本88例作为EOC组,其中早期卵巢癌(FIGOⅠ-Ⅱ期)26例、晚期卵巢癌(FIGOⅢ-Ⅳ期)62例,年龄17~74岁、平均(49.23±12.49)岁;同期卵巢良性肿瘤(浆液性囊腺瘤、黏液性囊腺瘤) 80例作为对照组(NC组),年龄18~65岁、平均(38.51±10.77)岁。所有纳入本研究的患者的临床资料完整,手术标本病理诊断由贵州医科大学附属医院病理科完成。
1.2 研究方法
采用免疫组织化学方法检测两组标本CXCR4、CD44及CD133的表达情况。收集标本用4%多聚甲醛固定,脱水、包埋并切片,切片厚4 μm,并行常规HE染色,免疫组织化学操作步骤按说明书上进行。采用双盲阅片,半定量积分法判定结果,以细胞核、细胞膜或细胞质呈黄色颗粒为阳性;依照细胞阳性着色程度(抗原含量),可分为弱阳性(+)1分、中等阳性(++)2分、强阳性(+++)3分;依照阳性细胞数量,可分为弱阳性(+)1分、指阳性细胞数在25%以下,中等阳性(++)2分、指阳性细胞数在25%~49%,强阳性(+++)3分、指阳性细胞数在50%以上。两组得分相乘,<3者为阴性,>4者为阳性,>6者为强阳性;至少随机观察5~10个高倍视野,取其均值。
1.3 观察指标
观察CXCR4、CD44及CD133在两组肿瘤组织中的表达情况。收集EOC患者临床病理资料包括年龄、病理类型、临床分期、腹水中找到恶性细胞、淋巴结转移及大网膜转移情况,了解CXCR4、CD44及CD133表达与EOC患者临床病理特征的关系。
1.4 统计学分析

2 结果
2.1 CXCR4、CD44及CD133表达
实验结果表明,CXCR4主要表达在细胞质中,CD44及CD133表达在细胞膜上,颜色呈明显的棕黄色。EOC组表达区域呈现较强的棕黄色,而对照组细胞的相应区域无该蛋白表达,EOC组与对照组表达差异有统计学意义(P<0.05),见图1、表1。
2.2 CXCR4、CD133及CD44的表达与EOC临床病理的关系
数据分析结果显示,CXCR4与EOC临床分期、腹水中找到恶性细胞、淋巴结转移、大网膜转移有关,差异具有统计学意义(P<0.05);CD44与EOC临床分期、腹水中找到恶性细胞、淋巴结转移、大网膜转移有关,差异有统计学意义(P<0.05);CD133与EOC临床分期、淋巴结转移、大网膜转移有关,差异有统计学意义(P<0.05)。3项指标均与年龄及病理类型无性,CD133与腹水找到肿瘤细胞无关,差异无统计学意义(P>0.05)。见表2。
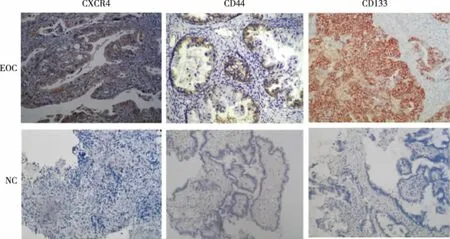
图1 CXCR4、CD44、CD133在卵巢良恶性肿瘤中的表达(DAB,×200)Fig.1 The expression of CXCR4, CD44 and CD133 inbenign and malignant ovarian tumors
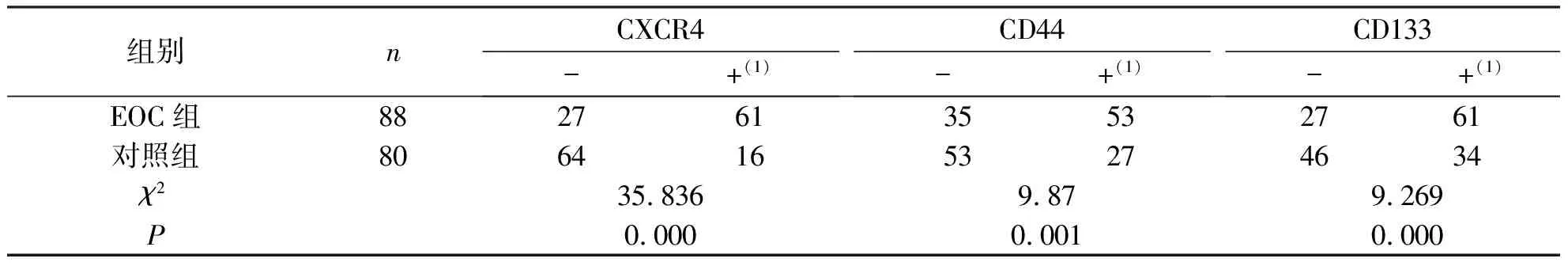
组别nCXCR4-+(1)CD44-+(1)CD133-+(1)EOC组882761 3553 2761 对照组806416 5327 4634 χ235.8369.879.269P0.0000.0010.000
注:(1)包括阳性和强阳性。
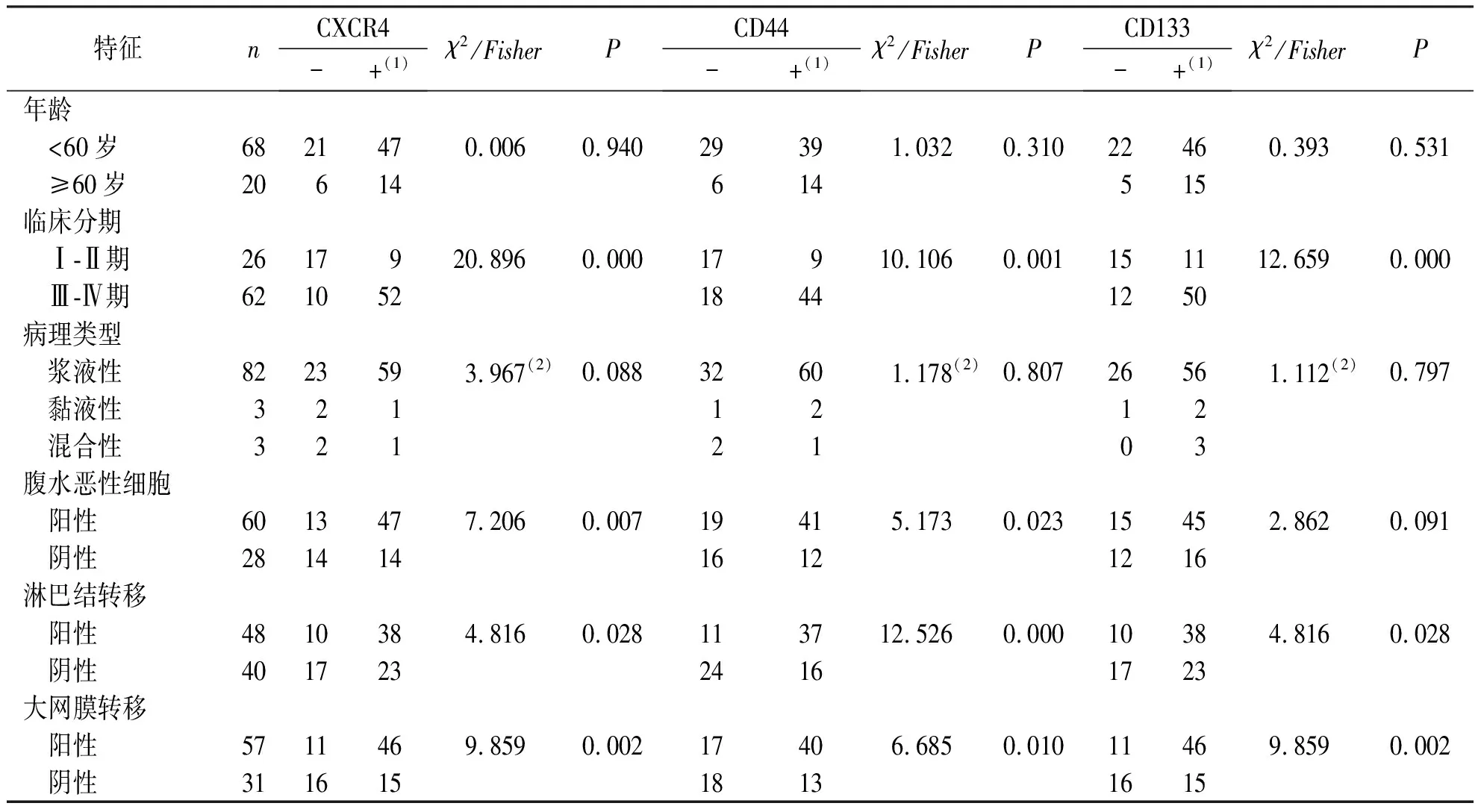
表2 CXCR4、CD133、CD44的表达与EOC临床病理的关系Tab.2 Correlation between expression of CXCR4, CD133, CD44 and clinical pathology in EOC group
注:(1)包括阳性和强阳性,(2)检验方法为Fisher检验。
3 讨论
卵巢癌是女性生殖系统疾病中致死率最高的恶性肿瘤,多数患者诊断时已属晚期,失去最佳手术时期,严重威胁女性的身心健康[8]。细胞因子受体CXCR4的表达使卵巢癌具有了侵袭性[9],而在对胶质瘤细胞的研究中,将其与CD44、CD133共同作为干细胞标志物[10]。CXCR4的细胞外结构域与其配体结合,引起构象变化,允许趋化因子紧密结合形成受体袋,接下来,发生第二次构象变化,通过Gα亚基从Gβ/Gγ二聚体的解离激活细胞内三聚体G蛋白[11],一旦激活,cAMP刺激酪氨酸激酶的Src家族,激活Ras、Raf、丝裂原活化蛋白激酶(MEK)和ERK途径;除此之外还存在许多途径,包括c-Jun[12]、NF-κB[13]及mTORC2[14]途径。在本研究中,通过免疫组织化学发现CXCR4、CD44、CD133在EOC组织中均有表达,EOC患者中CXCR4阳性率为69.32%,而在良性卵巢肿瘤中仅占为20%,χ2检验结果也显示在卵巢良恶性肿瘤中CXCR4的表达差异有统计学意义(P<0.001);CD44、CD133在卵巢良恶性肿瘤中的表达差异有统计学意义(P<0.001),因此有理由相信,3者对卵巢癌的发生发展是有影响的。
CXCR4与其特异性的配体结合形成CXCR4/CXCL12轴,它涉及干细胞的维持和(或)分化,癌症发生和其他多种病理途径[15]。在食管癌的研究中发现,自分泌CXCL12 / CXCR4是通过ERK1 / 2信号通路转化食管癌干细胞转移特性的主要机制之一[16],在胰腺导管癌的研究中发现,在Krüppel样转录因子10缺失的情况下靶向CXCR4/CXCL12能抑制胰腺导管癌的进展[17]。在子宫内膜癌中,CD133+CXCR4+的原发性子宫内膜癌细胞生长更快,干细胞特征相关基因mRNA高表达,产生更多球体,并且具有比其他亚群更高的克隆形成能力,它们对抗癌药物的抵抗能力也更强[18],而Kimura T等[19]的研究也证实在滑膜肉瘤中,CXCR4+细胞的致瘤性比阴性细胞更高,并具有自我更新和多能分化能力,因此针对CXCR4+的肿瘤细胞群的治疗将成为肿瘤治疗的新思路。临床上,腹水肿瘤细胞、淋巴结转移、大网膜转移常作为卵巢肿瘤分期的主要依据,本研究中证实3者均与CXCR4、CD44、CD133的表达有关,因此CXCR4、CD44及CD133可能通过某种机制促进了卵巢癌的侵袭和转移。
综上,在EOC中,CXCR4、CD44、CD133促进了卵巢癌的的侵袭转移,这或许将为卵巢癌的治疗提供新的策略,但具体机制有待进一步研究。
