基于MeCP2蛋白和双酶信号放大的DNA甲基化电化学免疫分析*
2019-10-11粟莎莎张姝黄健陈曦李艳方立超邓钧莫非郑峻松
粟莎莎, 张姝, 黄健, 陈曦, 李艳, 方立超, 邓钧, 莫非**, 郑峻松**
(1.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 2.贵州医科大学附院 临床检验中心, 贵州 贵阳 550004; 3.陆军军医大学 药学与检验医学系, 重庆 400038)
DNA甲基化一直是表观遗传领域研究的前沿和热点,由于其在细胞分化、胚胎发育、遗传性疾病和肿瘤发生等基因表达调控方面起着重要作用,DNA甲基化分析已成为表观遗传紊乱疾病和肿瘤早期预警的新手段[1-5]。传统DNA甲基化检测技术存在一定的不足,如重亚硫酸氢测序存在测序深度、转化效率和庞大数据分析等不足,甲基化限制性酶切分析引物设计受酶识别序列的限制等,高效液相色谱、质谱等操作繁琐且需要庞大的仪器设备[6-11]。电化学传感分析检测技术克服了以上缺点,具有成本低、操作简便、响应快速、灵敏度高和设备易于小型化等诸多优点[12-14],国内外应用电化学传感器检测DNA甲基化主要是通过检测DNA甲基转移酶的活性间接反映DNA甲基化的水平,灵敏度、特异性仍有待提高[15]。本研究利用甲基化CpG结合蛋白2(Methyl-CpG-binding protein 2, MeCP2)特异性识别结合DNA甲基化位点,以葡萄糖氧化酶(glucose oxidase, GOD)和辣根过氧化物酶(horseradish peroxidase, HRP)双酶标记的抗体作为信号放大体系,通过级联催化作用实现信号放大,同时利用电极表面修饰的纳米金有效促进电极表面的电子转移,两者相结合,探讨DNA甲基化的定量检测效果。
1 材料与方法
1.1 主要仪器与试剂
CHI660D电化学工作站购自上海辰华仪器公司,电极为三电极体系,辅助电极为铂丝电极,参比电极为Ag/AgCl电极,工作电极为金电极(直径为2 mm)。crossbeam 340 zeiss扫描电子显微镜(Scanning electron microscope, SEM)购自德国蔡司公司,氯金酸(HAuCl4)、牛血清白蛋白(Bovine serum albumin, BSA)及人重组MeCP2购自上海近岸科技有限公司,GOD、HRP和抗6×His鼠单克隆抗体(Anti-His tag antibody)购自上海生物工程有限公司,K3[Fe(CN)6]、K4Fe(CN)6·3H2O、NaCl和MgCl2购自国药集团化学试剂有限公司,三羟甲基氨基甲烷乙二胺四乙酸(Tris-EDTA, TE)缓冲液、KCl、磷酸盐(phosphate buffer saline, PBS)缓冲粉剂和三(2-羰基乙基)磷盐酸盐[Tris(2-carboxyethyl)phosphine hydrochloride, TCEP]购自北京鼎国昌盛生物技术有限责任公司,其他所用试剂均为分析纯,实验用水均为超纯水(电阻率18.2 MΩcm)。
1.2 DNA序列
探针序列5′-HS-(CH2)6-GCG CGC TGG GTG GGCm CCC GCG GCG CT-3′,甲基化序列5′-AC GCC GCG GGG CmCC ACC CAG CGC GC-3′,非甲基化序列5′-AGC GCC GCG GCG CCC ACC CAG CGC GC-3′。
1.3 方法
1.3.1缓冲液的配制 缓冲液有3种:一是探针固定缓冲液(50 mmol/L NaCl、1.0 mmol/L TCEP和pH 7.4的1×TE缓冲液),即准确称取NaCl 0.029 g、TCEP 0.002 8 g,用适量1×TE缓冲液溶解并定容至10 mL所得;二是杂交缓冲液(50 mmol/L NaCl、10 mmol/L MgCl2和pH 7.4的1×TE缓冲液),准确称取NaCl 0.029 g、MgCl20.020 3 g,用适量1×TE缓冲液溶解并定容至10 mL所得;三是蛋白固定缓冲液,即量取5 mL甘油,倒入容量瓶后加入1×PBS定容至100 mL所得。
1.3.2双酶标记抗体的制备 HRP和GOD标记抗体分两个阶段完成,第一阶段是根据文献[16]标记GOD,即1 g/L抗体逐滴加入溶有GOD 2 mg的1.25%戊二醛溶液中,加入1 mol/L、pH 9.5 PBS进行搅拌,继续加入200 mmol/L赖氨酸混匀后,4 ℃静置1 h,离心弃上清液,沉淀物即为GOD/anti-His tag;第二阶段是根据文献[17]将HRP偶联到GOD/anti-His tag上,先用60 mmol/L的过碘酸钠和160 mmol/L的乙二醇混合液将HRP活化,将酶与GOD标记后的抗His tag抗体按1 ∶1比例进行偶合。依次加入浓度为5 g/L的硼氢化钠溶液和等体积的饱和硫酸铵溶液,再次离心、弃上清液,并用10 mmol/L PBS重悬,混合液在0.15 mol/L PBS中透析,透析结束后将标记的抗体与等体积甘油混合,标记产物记为GOD-HRP/anti-His tag,取适量进行紫外可见分光光谱扫描鉴定,其余分装后于-20 ℃避光保存。
1.3.3DNA电化学生物传感器构建 (1)AuNPs/Au的制备:首先用0.05 μm的Al2O3抛光粉将金电极(Au)在麂皮上打磨光滑,接着依次用丙酮、乙醇和超纯水各超声清洗5 min,清洗完成后将电极置于新鲜配制的Piranha溶液(98%硫酸溶液与30%过氧化氢按3 ∶1体积比混合)中活化15 min,完成活化过程;取出电极,用0.5 mol/L浓硫酸进行电化学清洗,直到获得稳定重复的循环伏安曲线,随后用超纯水将电极表面彻底淋洗干净;在3 mmol/L氯金酸溶液(含0.1 mol/L硝酸钾)中于-0.2 V电位下沉积120 s,再次充分淋洗电极,并用氮气吹干,制备得纳米金(AuNPs)修饰的电极,标记为AuNPs/Au,然后采用SEM对电沉积纳米金的表面形貌进行表征,观察纳米粒的大小及分布情况,并推算出纳米金的直径大小。(2)探针固定与杂交:在上述制备的AuNPs/Au电极上滴加10 μL探针固定缓冲液(含0.1 μmol/L巯基化探针DNA),4 ℃放置12 h,得到探针DNA修饰的电极,杂交之前先用PBS和超纯水充分淋洗干净以除去多余吸附的DNA探针,滴加10 μL杂交缓冲液(含0.1 μmol/L靶DNA),于37 ℃杂交1 h,电极取出后再次用PBS和超纯水淋洗干净。(3)DNA电化学生物传感器构建过程的电化学表征:电极每一步组装后均在含0.1 mol/L KCl的3 mmol/L [Fe(CN)6]3-/4-溶液中采用电化学阻抗法(Electrochemical impedance spectroscopy, EIS)扫描,EIS参数设置为初始电位0.24 V,频率范围0.1~105 Hz,扫描速度50 mV/s。(4)MeCP2蛋白固定与免疫反应:杂交完成后,电极用0.5% BSA封闭30 min,接着滴加10 μL、200 mg/L MeCP2置于37 ℃水浴箱孵育1 h,PBS淋洗3次,滴加10 mg/L GOD-HRP/anti-His tag液10 μL 、 于37 ℃完成免疫反应,最后PBS淋洗3次待干。(5)电化学信号测定:将电极浸入含0.5 mmol/L 葡萄糖10 mL和0.25 mmol/L对苯二酚的PBS溶液中,采用差分脉冲伏安法(Differential pulse voltammetry, DPV)进行扫描并记录峰电流大小,DPV检测参数设置为电压范围-0.1~0.6 V,脉冲幅度0.05 s,脉冲宽度0.05 s,脉冲周期0.2 s,静置时间2 s。
1.3.4可行性分析 按照1.3.3项下的方法制备DNA电化学生物传感器对0.1 μmol/L非甲基化DNA与甲基化DNA进行测定,通过比较各自的峰电流大小,对该电化学检测方法的可行性进行验证。
1.3.5DNA甲基化定量分析 将0.1 μmol/L甲基化DNA按10倍比稀释依次得到1.0×10-8、1.0×10-9、1.0×10-10、1.0×10-11、1.0×10-12、1.0×10-13、1.0×10-14、1.0×10-15及1.0×10-16mol/L的靶序列溶液,按照1.3.3项下的方法制备DNA电化学生物传感器,用电化学方法测得该传感器的最低检测限,通过所得电信号对靶标浓度作线性关系曲线,计算回归方程和相关系数r。
1.3.6双酶信号放大策略的电化学表征 实验设置3组实验体系,分为GOD和HRP双酶标记体系(GOD-HRP/anti-His tag)、单独HRP标记体系(HRP/anti-His tag)及单独GOD标记体系(GOD/anti-His tag),在相同的条件下,将所制备的DNA电化学生物传感器先后进行杂交、MeCP2蛋白固定后,再与3组不同的酶标记抗体反应,通过比较各自DPV峰电流的大小,考察实验所设计的双酶信号放大策略的放大效果。
1.3.7传感器的重复性与稳定性研究 在相同条件下,同时制备5支电化学免疫传感器,对0.1 μmol/L甲基化DNA同时进行检测,比较结果之间的差距,计算相对标准偏差(relative standard deviation,RSD),评价该电化学方法检测甲基化DNA的重复性;通过将制备好的电极浸入0.1 mol/L、pH 7.4的PBS溶液中,于4 ℃冰箱放置,每7天测定1次,评估电化学生物传感器的稳定性。
2 结果
2.1 双酶修饰抗体表征
将偶联物进行紫外扫描鉴定,HRP的最大吸收光谱分别为403 nm,GOD的最大吸收光谱为275 nm,双酶标记抗体后的最大吸收峰向HRP及GOD的最大吸收峰处偏移。见图1。
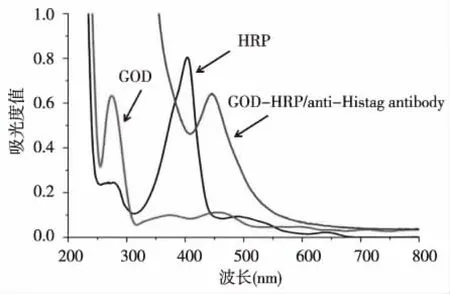
图1 HRP、GOD和GOD-HRP/anti-His tag antibody的紫外-可见光谱分析Fig.1 UV-visible spectroscopy of HRP, GOD and GOD-HRP/anti His tag antibody
2.2 AuNPs/Au形貌表征
采用SEM表征纳米金修饰的金电极AuNPs/ Au形貌,AuNPs呈球形、均匀地分布在电极表面,其直径大小约为35 nm。见图2。

图2 纳米金修饰金电极SEMFig.2 SEM image of electrode covered with AuNPs
2.3 传感器构建的电化学表征
用电化学阻抗法研究传感器制备过程中的电化学特性,裸电极的电阻抗图可以观察到有一个很小的半圆,表明电极表面电阻很小;当修饰上纳米金后,几乎变为一条直线,电阻减小;当探针组装在电极表面后,其负电荷的磷酸骨架排斥[Fe(CN)6]3-/4-,曲线半圆增大,电阻增大;同样,当电极表面的探针DNA与互补序列杂交形成DNA双链,电极表面的负电荷增多,电阻继续增大;当MeCP2蛋白结合在甲基化的CpG上后,蛋白的分子结构对电极表面的电子转移有一定的阻碍,电阻进一步增大。见图3。
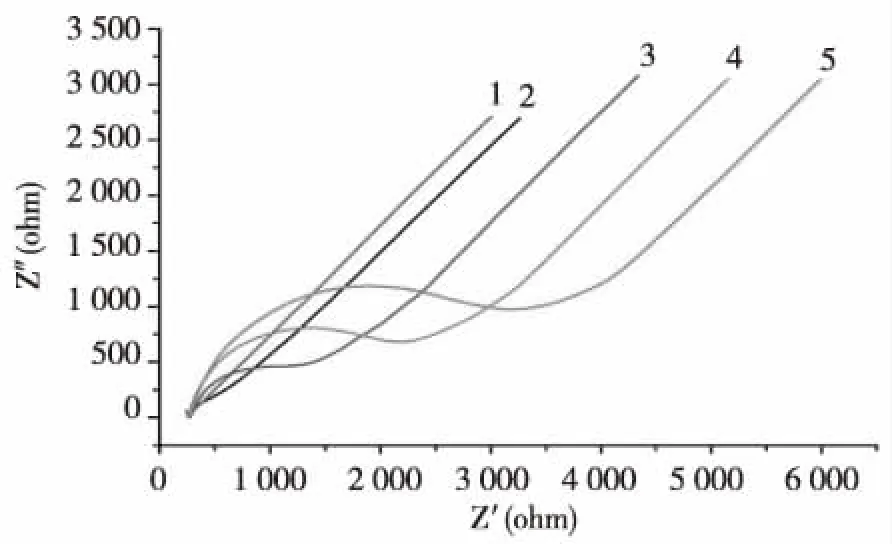
注:1为纳米金修饰金电极,2为裸Au,3为探针固定,4为杂交,5为MeCP2蛋白固定。图3 DNA电化学生物传感器构建的电化学表征Fig.3 Characterization of EIS of the self-assembling electrochemical biosensor
2.4 可行性分析
非甲基化DNA出现较小的背景电流,约2.6 μA;甲基化DNA则出现显著的氧化电流信号,约9.1 μA,是非甲基化DNA电信号的3.5倍。见图4。
2.5 DNA甲基化定量分析
在优化的实验条件下,随着甲基化靶序列DNA浓度的增加,DPV峰电流逐渐增加;在10-14~10-7mol/L范围内,DPV峰电流的大小与甲基化的靶DNA浓度对数呈线性关系,线性回归方程为I(峰电流值,μA)=1.038lgC(DNA甲基化的浓度,mol/L)+16.598,相关系数r为0.993,检测限为0.1 fmol/L。见图5。
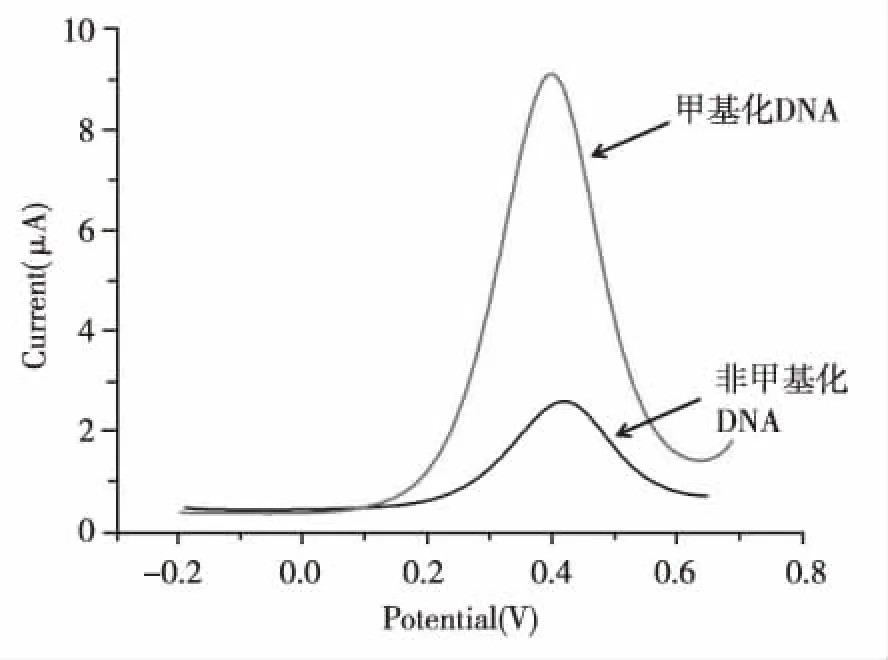
图4 0.1 μmol/L甲基化DNA与0.1 μmol/L非甲基化DNA的DPV电信号检测Fig.4 DPV signals in response to 0.1 μmol/L unmethylated DNA and methylated DNA
2.6 双酶信号放大的表征
双酶标记体系的DPV峰电流最高,达9.105 μA,单独HRP标记体系的DPV峰电流约为1.99 μA,单独GOD标记体系的电信号极其微弱,仅为0.969 μA。见图6。
2.7 电化学免疫传感器的重复性与稳定性
通过同时制备5支电化学免疫传感器,在相同条件下对0.1 μmol/L浓度的靶甲基化DNA进行电化学检测,RSD为4.6%;将传感器置于pH 7.4的PBS中,响应电流非常稳定,28 d后其电流大小为最初电流的93.7%,提示所制得的传感器具有良好的重复性和稳定性。

注:A为电流响应曲线,B为回归曲线。图5 电化学生物传感器对不同浓度甲基化DNA的电流响应曲线及其回归曲线Fig.5 The DPV curves at different concentrations of methylated DNA and the correlation of peak current and DNA methylation concentration

图6 双酶标记体系的电化学表征Fig.6 The effect of different enzyme-labeled antibodies on DPV response currents
3 讨论
到目前为止,DNA甲基化的检测方法已经开发出很多种,每种方法都有各自的优势与劣势,对DNA甲基化检测技术特异性、灵敏度以及高效性要求更高,生物传感分析无疑成为DNA甲基化检测新方法研究的趋势,其在DNA甲基化的检测方面显示出了研究人员期待的优点:快速、相对廉价、灵敏度高、能进行多样本分析、易于小型化、特别适合床旁检测。因此,生物传感技术也成为当前DNA甲基化研究领域的热点。本研究提出了一种简单而灵敏的DNA电化学免疫传感检测方法,首先,采用纳米金修饰金电极,其作用有三:一是提高电极比表面积,增大探针固载量;二是纳米金和探针之间通过Au-S键结合,使得探针牢牢固定在电极表面;三是促进电子转移[18-21]。因此,纳米金在本研究中具有重要的作用。扫描电镜观察到采用电沉积制备的纳米金呈球形,均匀地分布在电极表面,表明电极的比表面积扩大;EIS表征纳米金修饰电极后电阻较裸金电极减小,可明显提高检测的灵敏度,具有信号放大作用。传感器构建过程的EIS表征证明各成分均成功组装在电极上,传感器构建成功。其次,本研究利用MeCP2特异性结合双链DNA甲基化位点能力,有效保证检测结果的可靠性,这一结论通过对传感器的可行性分析得以证实。第三,在本次设计的3种标记体系中,采用GOD和HRP联合标记的双酶体系比单独标记HRP的体系提高约4.6倍。通常的电化学免疫传感器都是单独采用某种酶进行标记,与之不同的是,双酶联合催化信号放大的机制在于GOD和HRP的联合催化作用,即GOD催化葡萄糖氧化在电极表面原位产生H2O2,后者会立即被HRP利用,将对苯二酚氧化生成苯醌,从而检测电子转移,加上电极表面修饰的AuNPs有效促进了电子转移,从而实现双重信号放大,通过该方法最终获得甲基化DNA浓度低至0.1 fmol/L的检测限,线性范围为10-14~10-7mol/L,重复性实验RSD为4.6%,比以往研究结果低[21-23],具有较好的重复性。但传统方法如比色法、高效液相色谱、重亚硫酸氢盐转化、毛细管电泳法等,这些方法大多存在样本用量大、检测时间长、处理复杂等缺点,相比而言,本实验设计的电化学免疫传感器是一种相对简单、快速、灵敏的检测方法,更适用于临床分析。
综上所述,本研究采用双酶标记信号放大技术制备的电化学免疫传感器具有超高的灵敏度,能实现痕量DNA甲基化的检测,有望成为肿瘤和其他甲基化相关疾病早期诊断有用的分析工具。
