天然间苯三酚的化学结构和药理活性研究进展
2019-10-11杨雷敏黄雪峰
杨雷敏,张 敏,黄雪峰
中国药科大学中药学院天然药物化学系,南京 210009
天然间苯三酚广泛存在于植物、海洋生物中,拥有丰富的化学结构和生物活性。在藤黄科、桃金娘科、大戟科、鳞毛蕨科、菊科、豆科和芸香科等植物中均有发现,其中不乏结构新颖的间苯三酚。褐藻多酚则主要来源于褐藻属植物,多以酚类聚合而成。现代药理研究表明,间苯三酚类化合物有抗肿瘤、抗菌、抗炎等多种活性。目前对于该类化合物的综述多为特定种属的间苯三酚或特定药理活性的间苯三酚,Pal等[1]于2006年发表了较全面的综述,本文对近十年报道的284个天然间苯三酚的化学成分和药理活性研究进展进行了整理,以期对间苯三酚类化合物的进一步研究和开发提供参考。
1 结构分类
根据间苯三酚的苯环取代和聚合情况[1,2],可将其分为五大类,即间苯三酚单聚体、间苯三酚二聚体、间苯三酚三聚体、间苯三酚四聚体和多聚体、以及褐藻多酚。本文主要对研究较多的间苯三酚单聚体、二聚体、三聚体做介绍。
1.1 间苯三酚单聚体
据报道,天然来源的单体间苯三酚有着大量不同的取代和结构,可被进一步细分为简单间苯三酚、间苯三酚-萜加合物、间苯三酚苷、异戊烯基间苯三酚、β-三酮类、卤代间苯三酚。其中卤代间苯三酚主要来源于海洋生物,近十年未见新颖化合物的报道,因此本文不做具体介绍。
1.1.1 酰基间苯三酚
酰基间苯三酚为天然间苯三酚中含量最多的一类,简单酰基间苯三酚的区别主要在于侧链酰基取代的不同,主要有异戊酰基、甲基丁酰基、异丁酰基、乙酰基和苯甲酰基取代。
Shiu等[3]从Hypericumolympicum中分离鉴定了5个化合物(1~5)。Wang等[4]从Hypericumchinense中分离鉴定了4个化合物(6~9)。Schmidt等[5]从Hypericumempetrifolium石油醚提取物中分离鉴定了10个化合物(10~16,26~28)。Fobofou等[6]从Hypericumlanceolatum叶的氯仿提取部位中分离鉴定出9个化合物(17~25)。Fuentes等[7]首次对马达加斯加特有植物Garciniadauphinensis根茎的化学成分进行了报道,并从其乙醇提取物中分离得到10个化合物(29~38)。Kim等[8]从龙牙草(Agrimoniapilosa) 全草的乙酸乙酯部位中分离鉴定了8个化合物(39~46),其中化合物39和40是首次从自然界中发现的原花青素与间苯三酚加合物。化合物结构见图1。
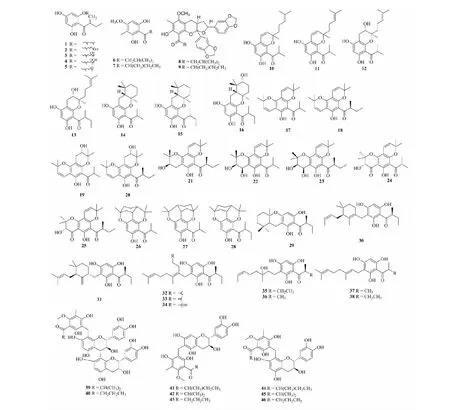
图1 酰基间苯三酚类化合物Fig.1 Acyl phloroglucinol compounds
1.1.2 间苯三酚-萜加合物
间苯三酚-萜加合物主要来源于桉属(Eucalyptus),从结构上被分为两类:含有苯并二氢吡喃环结构的称为euglobals,是二甲酰基或甲酰基-异戊酰基间苯三酚单萜烯或间苯三酚-倍半萜烯加合物;而不含苯并二氢吡喃环的则称为macrocarpals。化合物47~63为euglobals,化合物64~76均含呋喃环,化合物77~94为macrocarpals。
Su等[9]从水翁(Cleistocalyxoperculatus) 叶的95 %乙醇提取物中首次分离鉴定了2个含2,4-二甲基-肉桂基-间苯三酚骨架的萜类(47和48)。Qin等[10]从桉树(Eucalyptusrobusta) 果实中分离鉴定了3个间苯三酚-水烯芹混源萜(49~51)。Chen等[11]从阔鳞鳞毛蕨(Dryopterischampionii) 中分离鉴定了3个外消旋混源萜(52~54)。Cao等[12]从红千层(Callistemonrigidus) 叶的提取物中分离鉴定了2个含三酮-间苯三酚-单萜结构的新骨架(55和56)及1个其生物合成前体(73)。Yang等[13]从地耳草(Hypericumjaponicum) 中首次分离鉴定了4个TPAPs(Terpenoid Polymethylated Acylphloroglucinols) 型间苯三酚(58~61),这类成分是由与PPAPs(polycyclic polyprenylated acylphoroglucinols) 有着共同前体的多甲基酰化间苯三酚和一个倍半萜经过杂Diels-Alder反应而成,这是首次对金丝桃属中TPAPs型天然产物的报道。Faqueti等[14]从Eugeniaumbelliflora中分离鉴定了3个间苯三酚-萜(86~88)。Hattab等[15]从Cystoseiratamariscifolia中分离鉴定了5个间苯三酚-混源二萜(62,89~92)。Fu等[16]从番石榴(Psidiumguajava) 中分离鉴定了3个类倍半萜(63、93、94)。Cao等[17]从红千层(Callistemonrigidus) 叶中分离鉴定了9个单萜(64~72)。Xiong等[18]从台湾金粟兰(Chloranthusoldhamii) 根中分离鉴定了3个间苯三酚-萜(74~76)。Yu等[19]从桉树(Eucalyptusrobusta) 叶中分离鉴定了9个间苯三酚-倍半萜及其衍生物(77~85),首次报道了土青木香烷型倍半萜-间苯三酚加合物(77和78)。化合物结构见图2。

图2 间苯三酚-萜加合物Fig.2 Phloroglucinol-terpene adducts
1.1.3 异戊烯基间苯三酚
异戊烯基间苯三酚在植物中含量丰富,来源广泛,种类多达50余种,包括了单体、二聚、含异戊烯基或香叶基、多聚的间苯三酚。目前研究最广的多环多异戊烯基间苯三酚(PPAPs)主要来源于藤黄属和金丝桃属,传统的分类是根据酰基在间苯三酚上的相对位置而将其分为三类,即A型PPAPs、B型PPAPs、C型PPAPs。C型PPAPs迄今为止只报道了3个化合物,即nemorosone,hydroxynemorosone,7-epi-nemorosone[20]。Yang等[20]对3个PPAPs类化合物(garcinielliptones K-M) 的结构进行了校正,发现藤黄科(Clusiaceae) 中只可能存在A型和B型PPAPs。根据PPAPs类的生源合成途径和基本骨架分类,则可分为A型BPAPs(bicyclic polyprenylated acylphloroglucinols)、B型BPAPs、seco-BPAPs、金刚烷型PPAPs、高金刚烷型PPAPs等[21]。
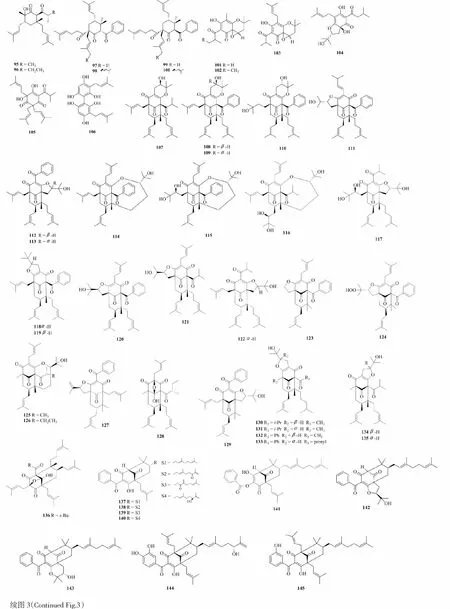


图3 异戊烯基间苯三酚类化合物Fig.3 Prenylated phloroglucinols
Gao等[22]从糙枝金丝桃(Hypericumscabrum) 中分离鉴定了15个PPAPs类化合物(95、96、123~135)。Tian等[23]从元宝草(Hypericumsampsonii) 中分离鉴定了4个C-2羰基缺失的PPAPs类化合物(97~100),以及1个生源合成衍生物(210)。Yu等[24]从Psorothamnusfremontii中分离鉴定了3个化合物(101~103)。Forino等[25]从啤酒花(Humuluslupulus) 花序中分离鉴定了3个化合物(104~106),其中humudifucol(106)为首次从自然界发现。Zhou等[26]从匙萼金丝桃(Hypericumuralum) 中分离鉴定了16个PPAPs类间苯三酚(107~122)。Yang等[27]从金丝梅(Hypericumhenryi) 中分离鉴定了10个PPAPs类化合物(136、193~195、205~209,222)。Zhang等[28]从岭南山竹子(Garciniaoblongifolia) 叶中分离鉴定了11个化合物(137~146、196、197)。Le等[29]从Garciniaschomburgkiana果实中分离鉴定了12个化合物(147~158)。Liu等[30]从连柱金丝桃(Hypericumcohaerens) 中分离鉴定了9个PPAPs类化合物(159~167)。Nguyen等[31]从Calophyllumthorelii根的石油醚提取物中分离鉴定了3个PPAPs类化合物(168~170)。Ishida等[32]从小连翘(Hypericumerectum) 中分离鉴定了7个化合物(171、172、200~204)。Acuna等[33]从Rheediaedulis种子和果皮中分离鉴定了2个化合物(173和174)。Zhang等[34]从菲岛福木(Garciniasubelliptica) 果实的丙酮提取物中分离鉴定了4个异戊烯基间苯三酚(175和178)和2个金刚烷型PPAPs(198和199)。Xu等[35]从云树(Garciniacowa) 树枝丙酮提取物中分离鉴定了4个化合物(179~182)。Magadula等[36]从Garciniasemseii根茎中分离鉴定了3个PPAPs类化合物(277~279)。Xu等[37]从金丝桃(Hypericummonogynum) 花中分离鉴定了10个[3.3.1]型PPAPs(183~192)。Liu等[38]从连柱金丝桃(Hypericumcohaerens) 中分离鉴定了3个高金刚烷型PPAPs(211~213)。Zeng等[39]从元宝草(Hypericumsampsonii) 果实中分离鉴定了4个高金刚烷型PPAPs(214~217)。Abe等[40]从Hypericumchinense中分离鉴定了4个螺环型PPAPs(218~221)。化合物结构见图3。
1.1.4β-三酮类
β-三酮类化合物是由间苯三酚母核上的C原子被氧化成羰基(C=O),苯环上的其他C或O被不同的取代基取代而形成的。当β-三酮类化合物六元环上有羟基取代时,易发生烯醇互变,多出现以异构体的形势存在的化合物。β-三酮类的合成中,关键步骤聚甲基化一般是用烷基卤化物在NaOMe的甲醇溶液或KOH水溶液中完成[41]。β-三酮类化合物主要分布于桉属(Eucalyptus),它们的区别在于侧链基团、甲基数和氧合程度的不同。
Carroll等[42,43]从Corymbiapeltata和Corymbiascabrida中分离鉴定了6个β-三酮类化合物(225、226、232~235)。Cottiglia等[44]从香桃木(Myrtuscommunis) 叶的二氯甲烷提取物中分离鉴定了3个β-三酮类化合物(223、224、231)。Zhang等[45]从桃金娘(Rhodomyrtustomentosa) 干燥叶的提取物中分离鉴定了2个β-三酮类化合物(227和228)。Wu等[46]从双花金丝桃(Hypericumgeminiflorum) 心材的氯仿提取物中分离鉴定了2对互变异构的β-三酮类化合物(229和230)。化合物结构见图4。
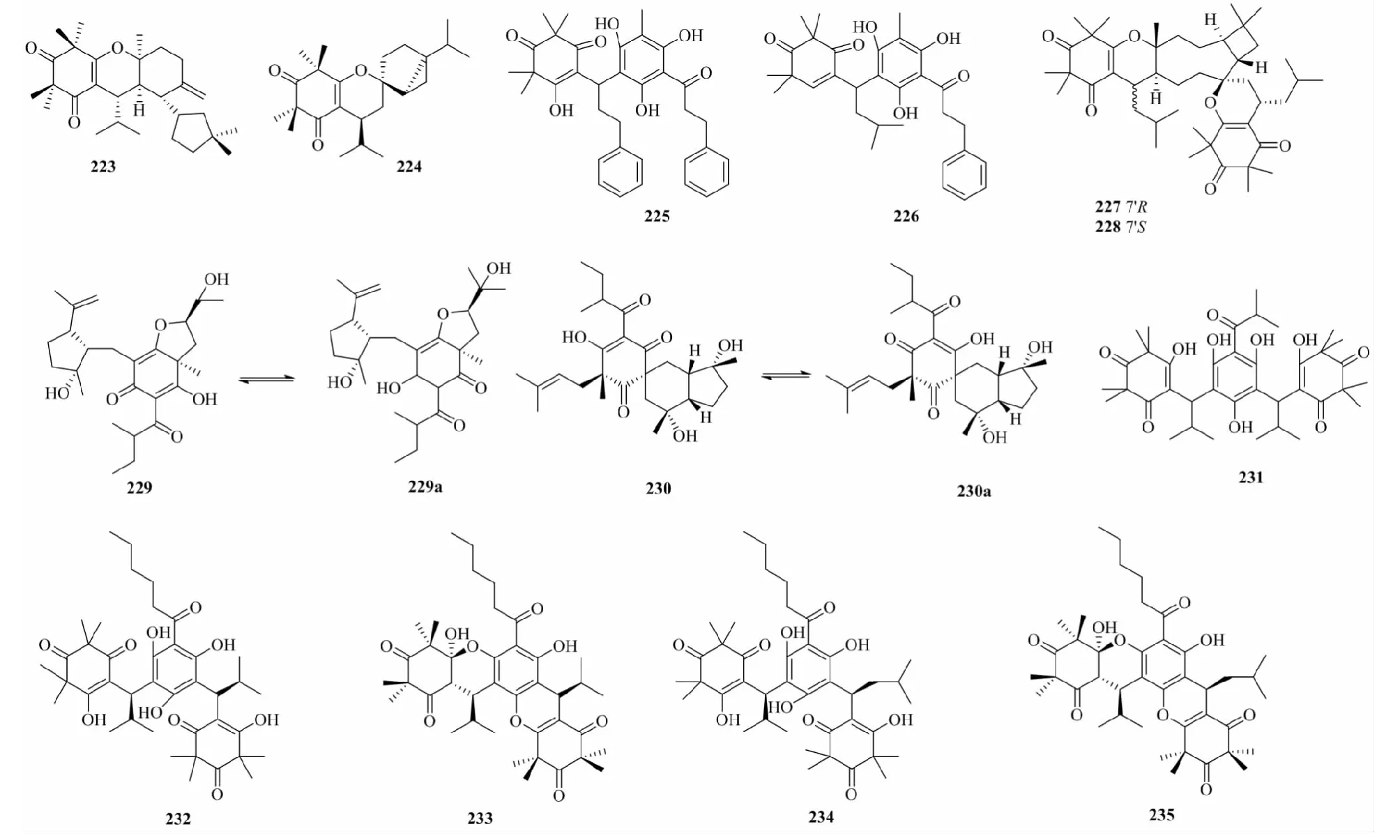
图4 β-三酮类化合物Fig.4 β-Triketone
1.1.5 间苯三酚苷
目前已报道的间苯三酚苷主要分为碳苷和氧苷。Tian等[47]从直杆蓝桉(Eucalyptusmaideni) 80 %丙酮提取物中分离鉴定了5个间苯三酚苷(236~240)。化合物结构见图5。

图5 间苯三酚苷类化合物Fig.5 Phloroglucinol glycosides
1.2 间苯三酚二聚体和三聚体
该类化合物是由亚甲基或苯并二氢呋喃环连接的2个间苯三酚单位而构成。目前从鳞毛蕨属(Dryopteris) 和舌蕨属(Elaphoglossum) 中分离和鉴定了大量由亚甲基连接的二聚间苯三酚。从生物合成的角度考虑,由苯并二氢呋喃环连接的二聚体是由Diels-Alder反应环合形成的,Tatsuta等[48]根据仿生途径合成了sideroxylonal B。
Li等[49]从地耳草(Hypericumjaponicum) 中分离鉴定了9个二聚间苯三酚(241~249)。Socolsky等[50-53]从Elaphoglossumlindbergii、Elaphoglossumgayanum、Elaphoglossumpiloselloides、Elaphoglossumcrassipes中分离鉴定了18个异戊烯基型的二聚间苯三酚和4个三聚间苯三酚(250~264,268~271,277~280)。Harinantenaina等[54]从Mallotusoppositifolius叶和花序中分离鉴定了3个二聚间苯三酚(265~267)。Wu等[55]从仪花(Lysidicerhodostegia) 中分离鉴定了3个聚合间苯三酚(272、273、276)。Su等[9]从水翁(Cleistocalyxoperculatus) 干燥叶中分离鉴定了2个二聚间苯三酚(274和275)。化合物结构见图6。

图6 间苯三酚二聚体和三聚体Fig.6 Dimeric and trimeric phloroglucinols
1.3 褐藻多酚
褐藻多酚主要来源来褐藻属植物,是一类分子量最大的间苯三酚化合物,以间苯三酚为基础通过芳基、醚键联接而形成,有抗氧化、抗菌等活性。Li等[56]从Eckoloniacava中分离鉴定了3个褐藻多酚(281和282)。Zou等[57]从铁钉菜(Ishigeokamurae) 中分离鉴定了2个褐藻多酚(283和284)。化合物结构见图7。

图7 褐藻多酚类化合物Fig.7 Phlorotannins
2 药理活性
2.1 抗肿瘤活性
Fan等[58]对分离得到的5个PPAPs类间苯三酚进行了细胞毒活性筛选,发现均含2个邻位酚羟基的化合物garcicowin C、isogarcinol、garcinialone有较好的细胞毒活性,其IC50在2.23~26.1 μM。Le等[29]测试了schomburgkianones A-F(147~152)、schomburgkianones H(153)、guttiferone K(154)、oblongifolin C(155)、garciyunnanin A(156) 对哺乳动物DNA聚合酶(polsα和λ) 及HeLa细胞的抑制活性,结果显示这些化合物对HeLa细胞和polα的抑制趋势相同,表明该类化合物的细胞毒性可能与其对DNA聚合酶的抑制有关。Zhang等[34]对从菲岛福木(Garciniasubelliptica) 中分离鉴定的化合物进行了细胞毒性评测,发现化合物175~178均有显著活性,而garsubellin A则无活性,进一步验证了苯甲酰基对间苯三酚类的体外活性起着关键的作用。Cottiglia等[44]对从香桃木(Myrtuscommunis) 中分离得到的3个化合物(223、224、231) 进行了细胞毒性测试,结果显示myrtucommulone A(231) 对MT-4、HepG2、CRL7065均有显著活性,而myrtucommulones K和L(223和224) 则无活性,这提示化合物223和224缺失的间苯三酚中心可能对其细胞毒性起着重要作用。
2.2 抗菌活性
Olympicins A-E(1~5) 对金黄色葡萄球菌均表现出抑菌活性,其中olympicin A(1) 的MICs达0.5~1.0 mg/L[3]。Li等[49]选用大肠杆菌ATCC 11775、鼠伤寒沙门氏杆菌ATCC 6539、金黄色葡萄球菌ATCC 25922、粪肠杆菌ATCC 10541对地耳草(Hypericumjaponicum) 中分离得到的二聚间苯三酚进行了抗菌活性评测,发现化合物hyperjaponicols A-D(241~244)、japonicin C(246)、sarothralen A(247) 表现出显著的抗菌活性,MICs在0.8~3.4 μM,而sarothralen C(245) 活性较弱,推测4′-OH或C-5′的长脂肪链可能对该类化合物的活性有影响。相对于阳性对照品苯唑西林,callistrilone A(55) 对多重耐药菌株StaphylococcusaureusATCC33591、S.aureusMu50和Enterococcusfaecium13-01有更强的抗菌活性,MICs在256-512 μg/mL[12]。Eugenials C和D(86和87) 对Bacillussubtilis、Staphylococcusaureus以及不同菌株的MRSA均显示有效的抑制活性[14]。Socolsky等[50]对从Elaphoglossumlindbergii中分离鉴定的化合物进行了抗菌活性测试,发现lindbergins E和F(250和251) 对Leishmania.braziliensis有明显的抑制活性,而其乙酰化衍生物lindbergins G和H(252和277) 的抑菌活性则较弱,表明疏水性的增加导致了活性的降低。
2.3 抗氧化活性
32-hydroxy-ent-guttiferone M(173) 对DPPH和ABTS均有显著的清除活性[33]。Wu等[46]对双花金丝桃(Hypericumgeminiflorum) 分离得到的化合物生物活性测试,结果hyperielliptone HB(230) 显示出抑制氧化性DNA损伤和抑制黄嘌呤氧化酶的作用。Lysidicins F-H(272、273、276) 以维生素E为对照,在浓度为0.1 μM/mL时抗氧化活性的抑制率为81.54%[55]。Diphlorethohydroxycarmalol(283) 和6,6′-bieckol(284) 对DPPH、羟基、烷基、超氧自由基有一定的清除活性[57]。
2.4 抗炎活性
Isopilosanols A-C(41~43)、pilosanidins A和B(39和40)、pilosanols A-C(44~46) 均有一定的抑制BV2小胶质细胞产生NO活性[8]。Cao等[17]对从红千层(Callistemonrigidus) 中分离得到的9个间苯三酚-单萜进行了抑制NO活性测试,结果显示callisretones A和B(64和65) 有显著活性,而callisalignene B(66)、2-methyl-1-[(5aR,8R,9aR)-5a,8,9,9a-tetrahydro-3-hy-droxy-1-methoxy-5a-methyl-8-(1-methylethyl)-4-dibenzofuran-yl]-1-propanone(67)、viminalins B和C(68和69)、viminalins H,L,N(70~72) 则无活性,提示重排的萜烯部分可能对此类化合物的NO抑制活性起着重要作用。Xu等[37]通过测定化合物对小鼠RAW264.7细胞上由LPS刺激的NO产生过程的抑制作用,发现hypermongone G(189) 有显著的活性,其IC50为9.5 μM,而hypermongones A-C(183~185)、hypermongones E和F(186和187)、hypermongone H(189) 活性稍弱,IC50在14.5~27.3 μM,这表明金丝桃(Hypericummonogynum) 的抗炎活性可能与其主含的贯叶金丝桃素类似物有关。
2.5 抗病毒活性
Su等[9]分别采用细胞病理效应(Cytopathic Effect,CPE) 和荧光法对从中水翁(Cleistocalyxoperculatus)分离得到的化合物进行了体外抗病毒活性评价,结果显示cleistoperlone A(274) 对HSV-1的抑制活性呈计量依赖性(IC50=7.50 ± 1.25 μM),而operculatol A(47)、operculatol B(48)、cleistoperlone B(275) 及它们的生物合成前体thoxychalcone和champanone B均无抗病毒活性,表明2,4-二甲基-肉桂基-间苯三酚结构部分对抗病毒活性不是必须的。Oblongifolin J(196)、oblongifolin M(141) 对非洲绿猴肾细胞中EV71诱导的CPE有显著的抑制作用,IC50分别为31.3和16.1 μM[28]。
2.6 抗疟活性
Dauphinol B(31)对恶性疟原虫Dd2耐药菌株有较好的抑制活性,其IC50=0.8 ± 0.1 μM[7]。Harinantenaina等[54]对从Mallotusoppositifolius中分离得到的3个化合物进行了生物活性测试,发现mallotojaponins B和C(265和266) 对有氯喹抗性的疟原虫有抑制活性,IC50分别为0.75 ± 0.30和0.14 ± 0.04 μM,而mallotophenone(267) 则无明显活性,提示3,3-二甲基烯丙基结构可能起着增强活性的作用。
2.7 其他活性
Hyperscabrones D-G(126~129)、hypermongone G(133)、hyperibone A(135)、hypermongone D(138)在浓度为10 μM时均有一定的神经保护活性[22]。Zhou等[26]对从匙萼金丝桃(Hypericumuralum) 中分离得到的16个化合物(107~122) 的神经保护作用进行了评测,除了uralione I(115) 外,所有化合物均有神经保护活性。Crassipin A(261) 在口服给药为15 mg/kg的小鼠强迫游泳实验中显示抗抑郁样活性[53]。Eucarobustols A-I(77~85) 均有抗PTP1B活性,IC50在1.3~5.6 μM[19]。Psidials B和C(93和94) 有抑制PTP1B的活性,在浓度为10 μM时,抑制率分别为61.7%、38.8%[16]。Qin等[10]对从桉树(Eucalyptusrobusta) 分离得到的3个化合物(49~51) 及它们的生物合成前体的eucalyprobusone A的抗炎活性、抑制乙酰胆碱酯酶(AchE) 和PTP1B活性进来了评测,结果显示仅(±)-eucalyprobusone A和(+)-eucalyprobusone A有一定的抗炎活性。此外,eucalyptusdimer A(49)、eucalyprobusone A、(+)-eucalyprobusone A、(-)-eucalyprobusone A均显示一定的抑制AchE活性[10]。Li等[56]对从Eckoloniacava中分离鉴定的褐藻多酚进行了一系列药理活性测试,发现fucodiphloroethol G(281) 和phlorofucofuroeckol A(283) 有显著的抗组胺活性。
3 展望
天然间苯三酚类化合物来源广泛,化学结构多样,酰基类、萜类、异戊烯基类占较大比例,其中多环多异戊烯基间苯三酚类因其特殊的生物合成途径和药理活性而备受关注,近十年不断有新化合物被发现和报道。间苯三酚类有抗肿瘤、抗菌、抗抑郁等药理活性,是一类很好的合成前体和药物研发候选物,如hyperforin已广泛用于临床;也有化学工作者以3′-甲基丁酰基-间苯三酚为前体合成了一类具有强抗神经炎症活性的化合物;间苯三酚二聚体则具有多种活性,如有抗疟和抗肿瘤活性的mallotojaponin C。但目前对天然间苯三酚类化合物的研究也存在一些问题,部分活性明显的化合物则只报道了初步的药理活性测试结果,应对它们的药理活性和作用机制进行深入的研究,以对化学合成和修饰、药物研发提供更多的依据,进一步更好的开发和应用间苯三酚类化合物。
