宁夏枸杞根和茎的化学成分及抗炎活性研究
2019-10-11黄远鹏梁秋萍周光雄
兰 婷,黄远鹏,梁秋萍,周光雄
暨南大学药学院中药及天然药物研究所 广东省普通高校中药和天然药物药效物质基础重点实验室,广州 510632
全球共有枸杞属植物80多种,离散分布在北美洲、南美洲、澳洲、欧亚大陆、太平洋岛屿和南非等地区。在我国,枸杞属植物有7个种3个变种,主要分布于我国北部和西北部地区[1]。枸杞属植物在我国作为传统中药材的药用历史悠久,主要涉及的种为枸杞(LyciumchinenseMill.)和宁夏枸杞(LyciumbarbarumL.)。《本草纲目》记:“春采枸杞叶,名天精草;夏采花,名生长草;秋采籽,名枸杞子;冬采根,名地骨皮”[2]。中药枸杞子为宁夏枸杞的干燥成熟果实,其性味甘平,归肝、肾经,另一常用中药地骨皮是枸杞或宁夏枸杞的干燥根皮,具有凉血、除热、清肺降火的功效[3]。从宁夏枸杞中分离纯化的天然活性成分主要包括生物碱类、黄酮类、苯丙素类、类胡萝卜素、多糖类等[4,5]。现代药理研究表明,宁夏枸杞具有抗氧化、抗肿瘤、降血糖、降血脂、肝保护、神经保护、视力保护等作用[6,7]。
为拓宽枸杞类植物中的生物活性成分类型,进一步加深对宁夏枸杞药效物质基础的认识,丰富宁夏枸杞开发利用的理论基础,本实验采用多种色谱分离技术和波谱手段,系统分离了宁夏枸杞根和茎部,确定了12个化合物(图1),其均为首次从该植物中分离得到。对分离得到的化合物进行细胞活力和体外抗炎活性测试,发现化合物2能显著地抑制NO释放活性,为后续寻找宁夏枸杞中具有抗炎活性的天然活性成分提供了一些科学依据。
1 仪器与材料
1.1 仪器与试剂
液相用水(广东怡宝公司生产纯净水20180407);BP211D 电子天平(Sartorouius公司);硅胶(青岛海洋化工厂0180011);KQ5200E 型超声波清洗器仪(昆山市超声仪器有限公司);TLC 预制板(青岛海洋化工厂20170919);Eyela 旋转蒸发仪;ODS(Silicycle 公司76231);色谱级甲醇(山东禹王公司20180426016);液相分析色谱柱为Ultimate XB-C18(5 μm,4.6× 250 mm)(美国Welch 公司);Sephadex LH-20(Pharmacia 公司10179062);液相半制备色谱柱为Ultimate XB-C18(5 μm,10× 250 mm) (美国Welch 公司);核磁用氘代试剂(Merck公司PR-286431012517MEI);Bruker AV-300、AV-400和AV-600 型核磁共振仪(德国布鲁克公司);LC-100 型液相色谱仪(上海伍丰科学仪器有限公司);Agilent 6120 LC/MS TOF 质谱仪(美国安捷伦科技公司);Agilent 1200 型高效液相色谱仪(美国安捷伦科技公司);Waters Synapt G2 TOF 高分辨质谱仪(英国沃特世公司);四甲基偶氮唑盐(MTT,Sigma MKCC5045);Thermo Scientific酶标仪(美国Thermo Scientific公司);胎牛血清(杭州四季青公司18120502);DMEM培养基(美国Gibco公司2047946);青-链霉素(美国Hyclone公司1881460),其他试剂均为分析纯。
1.2 药材来源
本实验所用宁夏枸杞干燥根、茎采集时间为2015年10月,采集地为甘肃省酒泉市瓜州县,鉴定人为中国科学院昆明植物研究所刘恩德博士,经鉴定该药材为茄科植物宁夏枸杞(LyciumbarbarumL.)的干燥根和茎。

图1 化合物1~12的化学结构Fig.1 Chemical structures of compounds 1-12
1.3 细胞株
从暨南大学药学院冻存细胞库中复苏得本实验所用的巨噬细胞RAW 264.7。
2 实验方法
2.1 提取与分离
将10 kg宁夏枸杞干燥根和茎晾干,粉碎后加乙醇(10倍量,95%)进行两次热回流提取,再用乙醇(80%)进行一次热回流提取,均为2 h/次,过滤,合并三次提取液,经浓缩后得640 g总浸膏。向总浸膏中加入水悬浮(适量),先后用石油醚、乙酸乙酯萃取,得到萃取液后分别浓缩,最终获得石油醚部位萃取物(107.3 g)、乙酸乙酯部位萃取物(145 g)。石油醚部位(107.3 g)经硅胶柱洗脱(石油醚/乙酸乙酯100∶0→0∶100)再经TLC分析后合并,得Fr.1-20共20个馏分。其中Fr.4经硅胶柱多梯度洗脱(二氯甲烷/甲醇100∶0→0∶100)后,得到化合物12(415.8 mg)。乙酸乙酯部位(145 g)先后经硅胶柱洗脱(二氯甲烷/甲醇100∶0→0∶100)以及TLC分析合并,得到18个馏分Fr.1-18。其中Fr.3经硅胶柱洗脱(二氯甲烷/甲醇100∶0→0∶100),再通过TLC 分析合并得到10个子馏分Fr.3-1~ Fr.3-10。Fr.3-3经半制备液相色谱(甲醇/水60∶40)制备得到化合物9(13.8 mg)。Fr.3-7经过Sephadex LH-20凝胶柱色谱等度洗脱(二氯甲烷-甲醇50∶50),得到化合物6(16.3 mg),Fr.3-10经过Sephadex LH-20凝胶柱色谱等度洗脱(二氯甲烷-甲醇50∶50),得到4个子馏分Fr.3-10-1 ~ Fr.3-10-4,其中Fr.3-10-4经半制备液相色谱(甲醇/水55∶45)制备得到化合物7(2.5 mg)。Fr.6经硅胶柱色谱梯度洗脱(二氯甲烷/甲醇100∶0→0∶100),再通过TLC合并得到7个子馏分Fr.6-1 ~ Fr.6-7。Fr.6-2经过Sephadex LH-20凝胶色谱柱等度洗脱(二氯甲烷-甲醇50∶50),得到化合物8(2.8 mg)。同时,Fr.6-2-3经半制备液相色谱(甲醇/水58∶42)制备得到化合物11(9.7 mg)。Fr.8经过ODS开放柱多梯度洗脱(甲醇-水1∶5→100∶0),得到8个子馏分Fr.8-1~Fr.8-8。Fr.8-5经硅胶柱洗脱(二氯甲烷/甲醇100∶0→0∶100)得到化合物3(2.4 mg)。Fr.8-6经过Sephadex LH-20凝胶色谱柱以纯甲醇系统洗脱,得到Fr.8-6-4再经半制备液相色谱(甲醇/水65∶45)制备得到化合物10(5 mg),Fr.8-6-7经半制备液相色谱(甲醇/水60∶40)制备得到化合物2(5.3 mg)。Fr.13经过ODS开放柱梯度洗脱(甲醇-水1∶5→100∶0),得到个子馏分Fr.13-1~Fr.13-8,其中Fr.13-6经半制备液相色谱(甲醇/水55∶45)制备得到化合物1(7.8 mg)。Fr.15经硅胶柱洗脱(二氯甲烷/甲醇100∶0→0∶100),并且经TLC合并得到10个子馏分Fr.15-1~ Fr.15-10,其中Fr.15-5再经过ODS开放柱多梯度洗脱(甲醇-水1∶5→100∶0)得到Fr.15-5-1,该馏分经半制备液相色谱(甲醇/水45∶55)制备得到化合物4(7 mg)。Fr.15-7经过Sephadex LH-20 凝胶色谱柱以纯甲醇系统洗脱,得到化合物5(5 mg)。
2.2 细胞培养
将小鼠巨噬细胞系RAW 264.7在DMEM培养基(含10%胎牛血清)中培育,培育条件为37 ℃、5% CO2,待细胞长满培养皿底部的80%面积,将对数生长期的细胞取出用于实验。
2.3 细胞活力测试
RAW 264.7细胞用DMEM培养液(含10%胎牛血清)到96孔板(4×104个细胞/孔,体积为100 μL/孔)。将细胞置培育箱中培养24 h(培育箱条件:37 ℃、5%CO2)后吸出培养液,加入待测化合物(不同浓度)及阳性对照药(槲皮素)的培养液, 24 h 后将上清液除去,在96孔板中加入MTT (5 mg/mL/孔),温度为37 ℃,4 h后弃去MTT,加入DMSO (200 μL/孔),置摇床上低速震荡10 min,在观察到结晶充分溶解后,在570 nm处用酶标仪测量各孔的OD值,计算化合物的IC50值[8]。
2.4 抗炎活性测试
本实验中通过抑制一氧化氮(NO)生成实验检测化合物抗炎活性,检测模型为小鼠巨噬细胞RAW 264.7(LPS诱导),采用Griess试剂显色法评估一氧化氮生成量。将RAW 264.7细胞用DMEM培养液(10%胎牛血清)稀释,之后接种到96孔板(4×104个细胞/孔,每孔体积100 μL)。在37 ℃、5%CO2的恒温培育箱培育24 h后,吸出培养液,加入待测化合物(不同浓度)及阳性对照药(槲皮素)的培养液(培养液中预先加入100 ng/mL LPS)。再经24 h后,将各孔上清液吸出,移至新的96孔板,每孔加入100 μL混合溶液(Griess A:B为1∶1)。离心1 min(3000 rpm)后移至黑暗处反应10 min。在540 nm波长下用酶标仪测定各孔OD值,计算化合物的IC50值[8]。
3 实验结果
3.1 化合物结构鉴定
化合物1黄色油状(CH3OH);HR-ESI-MS:m/z352.114 9 [M + Na]+,确定其相对分子质量为329,分子式为C18H19NO5;1H NMR (300 MHz,CD3OD)δ:6.46 (2H,d,J=15.9 Hz,H-2),7.44 (2H,d,J=15.6 Hz,H-3),3.44 (1H,dd,J=5.1,13.5 Hz,H-1′a),3.54 (1H,dd,J=5.1,13.5 Hz,H-1′b),4.73 (1H,dd,J=4.8,7.8 Hz,H-2′),7.11 (1H,d,J=1.8 Hz,H-2″),6.81 (1H,d,J=5.4 Hz,H-5″),7.02 (1H,dd,J=2.1,8.1 Hz,H-6″),7.22 (2H,d,J=8.5 Hz,H-2″′,6′″),6.78 (2H,d,J=8.5 Hz,H-3′″,5″′),3.87 (3H,s,4′″-OCH3);13C NMR (75 MHz,CD3OD) δ:169.5 (C-1),118.6 (C-2),142.2 (C-3),48.3 (C-1′),73.4 (C-2′),134.7 (C-1″),111.5 (C-2″),149.9 (C-3″),149.3 (C-4″),116.5 (C-5″),123.3 (C-6″),128.2 (C-1′″),128.4 (C-2′″,6′″),116.1 (C-3′″,5′″),158.1 (C-4′″),56.4 (4′″-OCH3)。以上数据与文献[9]报道基本一致,故鉴定化合物1为N-[2-(3,4-dihydroxyphenyl)-2-hydroxyethyl]-3-(4-methoxyphenyl)prop-2-enamide。
化合物2淡黄色粉末(CH3OH);HR-ESI-MS:m/z366.132 9 [M + Na]+,确定其相对分子质量为343,分子式为C19H21NO5;1H NMR (600 MHz,CD3OD)δ:3.47 (2H,dd,J=8.1,13.8 Hz,H-1′),3.89 (3H,s,3′″-OCH3),3.22 (3H,s,2′-OCH3),4.25 (1H,dd,J=4.2,8.4 Hz,H-2′),7.13 (1H,d,J=4.2 Hz,H-2′″),6.80 (2H,d,J=8.4 Hz,H-3″,5″),6.79 (1H,d,J=8.4 Hz,H-5″′),6.48 (1H,d,J=15.6 Hz,H-2),7.03 (1H,dd,J=1.8,8.4 Hz,H-6′″),7.17 (2H,d,J=8.4 Hz,H-2″,6″),7.44 (1H,d,J=16.2 Hz,H-3);13C NMR (150 MHz,CD3OD) δ:47.1 (C-1′),56.4 (3′″-OCH3),56.8 (2′-OCH3),83.3 (C-2′),111.5 (C-2′″),116.3 (C-3″,5″),116.5 (C-5′″),118.6 (C-2),123.3 (C-6′″),128.3 (C-1′″),129.2 (C-2″,6″),131.4 (C-1″),142.2 (C-3),149.3 (C-3′″),149.9 (C-4′″),158.6 (C-4″),169.2 (C-1)。以上数据与文献[10]报道基本一致,故鉴定化合物2为3-(4-hydroxy-3-methoxyphenyl)-N-[2-(4-hydroxyphenyl)-2-methoxyethyl]acrylamide。
化合物3白色粉末(CH3OH);HR-ESI-MS:m/z298.111 0 [M- H]-,确定其相对分子质量为299,分子式为C17H17NO4;1H NMR (600 MHz,CD3OD)δ:3.43 (1H,dd,J=7.8,13.8 Hz,H-1′a),3.53 (1H,dd,J= 3.6,13.8 Hz,H-1′b),4.72 (1H,dd,J=4.8,7.8 Hz,H-2′),6.78 (2H,d,J=8.4 Hz,H-5′,7′),6.78 (1H,d,J= 9 Hz,H-6,8),6.44 (1H,d,J=15.6 Hz,H-2),7.22 (2H,d,J=9.0 Hz,H-4′,8′),7.41 (2H,d,J=9 Hz,H-5,9),7.45 (1H,d,J= 15.6 Hz,H-3);13C NMR (150 MHz,CD3OD)δ:47.8 (C-1″),73.5 (C-2′),116.1 (C-5′,7′),116.7 (C-6,8),118.3 (C-2),127.7 (C-4),128.5 (C-4′,8′),130.6 (C-5,9),134.7 (C-3′),142.0 (C-3),158.1 (C-7),160.6 (C-6′),169.6 (C-1)。以上数据与文献[11]报道基本一致,故鉴定化合物3为N-trans-coumaroyloctopamine。
化合物4黄色油状(CH3OH);HR-ESI-MS:m/z658.273 5 [M + Na]+,确定其相对分子质量为635,分子式为C34H41N3O9;1H NMR (600 MHz,CD3OD)δ:6.35 (2H,s,H-3),7.58 (1H,s,H-8),6.84 (1H,s,H-2′),6.59 (1H,s,H-5),2.48 (2H,m,H-2),2.23 (2H,m,H-4′,8′),6.94 (2H,d,J=16.8 Hz,H-2″,6″),6.68 (2H,d,J=16.8 Hz,H-3″,5″),2.60 (2H,t,J=14.4 Hz,H-7″),3.22 (2H,m,H-8″),3.14 (2H,m,H-1′″),1.48 (4H,br.s,H-2″′),3.24 (2H,m,H-4″′),1.91 (3H,s,N-COCH3),3.57 (6H,s,3′,5′-OCH3);13C NMR (150 MHz,CD3OD)δ:127.1 (C-1),109.0 (C-2,6),148.7 (C-3,5),138.0 (C-4),138.4 (C-7),132.6 (C-8),170.6 (C-9),132.3 (C-1′),118.2 (C-2′),147.3 (C-3′),146.2 (C-4′),118.3 (C-5′),127.1 (C-6′),29.8 (C-7′),37.7 (C-8′),175.0 (C-9′),131.2 (C-1″),130.7 (C-2″,6″),116,2 (C-3″,5″),156.8 (C-4″),35.6 (C-7″),42.3 (C-8″),40.2 (C-1),27.7 (C-2),28.0 (C-3),40.6 (C-4),173.6 (N-COCH3),22.6 (N-COCH3),56.3 (3′,5′-OCH3)。以上数据与文献[12]报道基本一致,故鉴定化合物4为(E)-2-(4,5-dihydroxy-2-{3-[(4-hydroxyphenethyl)amino]-3-oxopropyl}phenyl)-3-(4-hydroxy-3,5-dimethoxyphenyl)-N-(4-acetamidobutyl)acrylamide。
化合物5白色粉末(DMSO);HR-ESI-MS:m/z641.251 1 [M + H]+,确定其相对分子质量为640,分子式为C36H37N2O49;1H NMR (600 MHz,DMSO-d6)δ:4.61 (1H,s,H-1),3.58 (1H,s,H-2),7.28 (1H,s,H-4),6.73 (1H,s,H-5),6.37 (1H,d,J=2.4 Hz,H-2′),6.54 (1H,d,J=6.4 Hz,H-5′),6.28 (1H,dd,J=2.4,6.4 Hz,H-6′),6.87 (2H,d,J=6.4 Hz,H-2″′,6′″),6.62 (2H,d,J=6.4 Hz,H-3″,5″),6.66 (2H,d,J=6.4 Hz,H-3′″,5′″),6.96 (2H,d,J= 9.0 Hz,H-2″,6″),3.23 (2H,m,H-α),3.10 (2H,m,H-α′),2.61 (2H,t,J=7.2 Hz,H-β),2.46 (2H,t,J=7.2 Hz,H-β′),3.83 (3H,s,6-OCH3),3.47 (3H,s,8-OCH3),7.68 (1H,t,J=7.2 Hz,-NH),8.15 (1H,t,J=7.2 Hz,-NH′);13C NMR (150 MHz,DMSO-d6)δ:38.8 (C-1),47.3 (C-2),126.4 (C-3),132.0 (C-4),107.7 (C-5),147.2 (C-6),141.0 (C-7),145.7 (C-8),122.7 (C-4a),124.2 (C-8a),170.7 (C-2a),167.3 (C-3a),134.7 (C-1′),115.1 (C-2′),143.5 (C-3′),144.6 (C-4′),115.1 (C-5′),118.1 (C-6′),129.6 (C-1″,1″′),129.5 (C-2′″,6′″),115.1 (C-3″,5″),155.6 (C-4″,4′″),115.1 (C-3′″,5′″),129.5 (C-2″,6″),40.1 (C-α),40.3 (C-α′),34.3 (C-β),34.4 (C-β′),56.8 (6-OCH3),60.8 (8-OCH3)。以上数据与文献[13]报道基本一致,故鉴定化合物5为1,2-dihydro-6,8-dimethoxy-7-hydroxy-1-(3,4-dihydroxyphenyl)-N1,N2-bis[2-(4-hydroxyphenyl)ethyl]-2,3-naphthalene dicarboxamide。
化合物6无色油状(CH3OH);HR-ESI-MS:m/z441.151 2 [M + Na]+,确定其相对分子质量为418,分子式为C22H26O8;1H NMR (300 MHz,CD3OD)δ:3.14 (2H,m,H-1,5),3.84 (1H,s,H-4b,8b),3.87 (12H,m,3′,5′,3″,5″-OCH3),4.26 (2H,m,H-4a,8a),4.71 (2H,d,J=6.4 Hz,H-2,6),6.66 (4H,d,J=6.4 Hz,H-1′,6′,1″,6″);13C NMR (75 MHz,CD3OD)δ:55.5 (C-1,5),56.8 (C-3′,5′,3″,5″-OCH3),72.8 (C-4,8),87.6 (C-2,6),104.5 (C-2′,6′,2″,6″),133.1 (C-1′,1″),136.1 (C-4′,4″),149.3 (C-3′,5′,3″,5″)。以上数据与文献[14]报道基本一致,故鉴定化合物6为(+)-syringaresinol。
化合物7白色粉末(DMSO);HR-ESI-MS:m/z281.102 1 [M + H]+,确定其相对分子质量为280,分子式为C14H16O6;1H NMR (400 MHz,DMSO-d6)δ:3.13 (1H,m,H-5),3.59 (1H,m,H-1),3.75 (6H,s,3′,5′-OCH3),3.93 (1H,d,J=9.2 Hz,H-4b),4.20 (1H,d,J=8.4 Hz,H-8b),4.35 (1H,d,J=7.6 Hz,H-4a),4.48 (1H,d,J=7.6 Hz,H-8a),4.62 (1H,d,J=10.4 Hz,H-6),6.63 (2H,s,H-2′,6′);13C NMR (100 MHz,DMSO-d6)δ:45.9 (C-5),48.4 (C-1),56.3 (C-3′,5′-OCH3),69.7 (C-8),70 (C-4),86.3 (C-6),102.8 (C-2′,6′),129.8 (C-1′),134.9 (C-4′),147.3 (C-3′,5′),178 (C-2)。以上数据与文献[15]报道基本一致,故鉴定化合物7为zhebeiresinol。
化合物8黄棕色固体(CH3OH);HR-ESI-MS:m/z289.071 7 [M- H]-,确定其相对分子质量为288,分子式为C15H12O6;1H NMR (600 MHz,CD3OD)δ:2.70 (1H,d,J=12.6 Hz,H-3β),3.07 (1H,d,J=12.6 Hz,H-3α),5.29 (1H,t,J=12.6 Hz,H-2),5.88 (1H,s,H-8),5.90 (1H,s,H-6),6.92 (1H,s,H-2′),6.79 (2H,d,J=1.8 Hz,H-5′,6′);13C NMR (150 MHz,CD3OD)δ:44.1 (C-3),80.5 (C-2),96.2 (C-8),97.0 (C-6),103.3 (C-10),114.7 (C-2′),116.2 (C-5′),119.2 (C-6′),131.8 (C-1′),146.5 (C-3′),146.9 (C4′),164.8 (C-9),165.5 (C-5),168.4 (C-7),197.7 (C-1)。以上数据与文献[16]报道基本一致,故鉴定化合物8为(±)-eriodictyol。
化合物9白色粉末(CH3OH);HR-ESI-MS:m/z153.054 8 [M + H]+,确定其相对分子质量为152,分子式为C8H8O3;1H NMR (400 MHz,CD3OD)δ:9.75 (1H,s,-CHO),7.46 (1H,s,H-2),7.44 (1H,d,J=8.0 Hz,H-5),6.95 (1H,d,J=7.6 Hz,H-6),3.94 (3H,s,4-OCH3);13C NMR (100 MHz,CD3OD)δ:56.4 (4-OCH3),111.2 (C-2),116.4 (C-6),128.0 (C-5),130.4 (C-1),149.8 (C-3),155.2 (C-4),192.0 (C-1′)。以上数据与文献[17]报道基本一致,故鉴定化合物9为isovanilin。
化合物10白色粉末(CH3OH);HR-ESI-MS:m/z247.090 2 [M + H]+,确定其相对分子质量为246,分子式为C14H14O4;1H NMR (600 MHz,CD3OD)δ:7.44 (2H,br.s,2,2′-OH),6.77 (2H,d,J=8.4 Hz,H-3,3′),7.02 (2H,d,J=8.4 Hz,H-4,4′),7.11 (2H,s,H-6,6′),3.88 (6H,s,5,5′-OCH3);13C NMR (150 MHz,CD3OD)δ:127.7 (C-1,1′),150.4 (C-2,2′),116.3 (C-3,3′),123.9 (C-4,4′),149.2 (C-5,5′),111.6 (C-6,6′),56.3 (5,5′-OCH3)。以上数据与文献[18]报道基本一致,故鉴定化合物10为5,5′-dimethoxybiphenyl-2,2′-diol。
化合物11黄色粉末(CH3OH);HR-ESI-MS:m/z315.141 7 [M + H]+,确定其相对分子质量为314,分子式为C18H18O5;1H NMR (600 MHz,CD3OD)δ:2.76 (1H,t,J=7.8 Hz,H-2″),3.46 (1H,t,J=6.6 Hz,H-1″),3.88 (1H,s,3-OCH3),7.12 (2H,s,H-2),6.72 (1H,d,J=12.8 Hz,H-3′,5′),6.80 (1H,d,J=8.4 Hz,H-5),6.40 (1H,d,J=8.4 Hz,H-8),7.02 (2H,d,J=7.2 Hz,H-6),7.05 (1H,d,J= 8.4 Hz,H-2′,6′),7.43 (1H,d,J=13.6 Hz,H-7′);13C NMR (150 MHz,CD3OD)δ:35.8 (C-2″),42.5 (C-1″),56.4 (3-OCH3),111.5 (C-2),116.3 (C-3′,5′),116.5 (C-5),118.7 (C-8),123.2 (C-6),128.3 (C-1),130.7 (C-2′,6′),131.3 (C-1′),142.0 (C-7),149.3 (C-3),149.8 (C-4),156.9 (C-4′),169.2 (C-9)。以上数据与文献[19]报道基本一致,故鉴定化合物11为p-hydroxyphenethyltrans-ferulate。
化合物12白色粉末(CHCl3);HR-ESI-MS:m/z581.451 9[M + Na]+,确定其相对分子质量为558,分子式为C36H62O4;1H NMR (300 MHz,CDCl3)δ:0.88 (3H,t,J=6.3 Hz,H-26′),1.70 (2H,m,H-2′),3.91 (3H,s,3-OCH3),4.19 (2H,t,J=12.6 Hz,H-1′),7.02 (1H,s,H-2),6.91 (1H,d,J=8.1 Hz,H-5),7.06 (1H,d,J=8.1 Hz,H-6),7.61 (1H,d,J=15.9 Hz,H-7),6.29 (1H,d,J=15.9 Hz,H-3),5.98 (1H,s,-OH),1.25 (46H,br.s,(CH2)23);13C NMR (75 MHz,CDCl3)δ:14.3 (C-26′),22.8 (C-25′),26.1 (C-3′),28.9 (CH2),29.4 (CH2),29.5 (CH2),29.7 (CH2),29.7 (CH2),29.8 (CH2×2),29.8 (CH2×14),32.1 (C-1),56.0 (3-OCH3),64.7 (C-1′),109.4 (C-2),114.8 (C-5),115.7 (C-8),123.1 (C-6),127.1 (C-1),144.8 (C-7),146.9 (C-3),148.0 (C-4),167.5 (C-9)。以上数据与文献[20]报道基本一致,故鉴定化合物12为E-ferulic acid hexacosyl ester。
3.2 细胞活力及抗炎活性实验结果
从宁夏枸杞根及茎中分离得到的12个化合物(1~12)的细胞毒活性和抗炎活性结果见表1。具有显著抗炎活性的为化合物2,其IC50值为17.00 ± 1.11 μmol/L,小于阳性对照药槲皮素(IC50=17.21 ± 0.50 μmol/L)。比较化合物2和3的结构与活性,可初步推测该类化合物抑制NO生成的活性与R2、R3上的取代基团有关,本研究选取了与化合物2具有相同骨架的化合物13、14,进一步测试了它们的细胞毒活性与抗炎活性,结果发现具有阿魏酰酪胺骨架的一类化合物,R3上的取代基团是其抗炎活性的关键,其活性大小关系为:R3为甲氧基 > R3为氢取代 > R3为羟基,且当R3上为羟基取代时,化合物无抗炎活性。
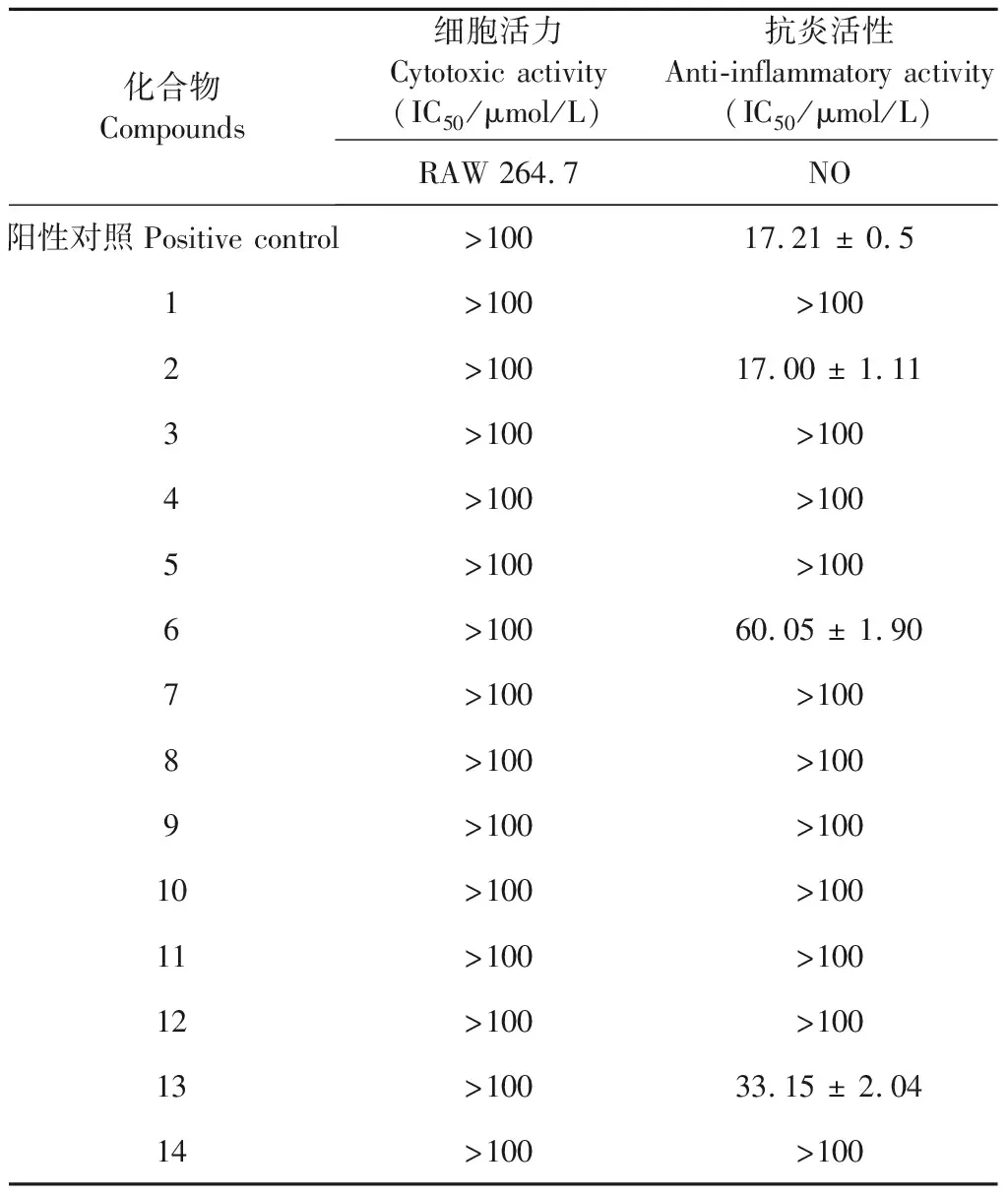
表1 化合物1~14的细胞毒活性和抗炎活性
注:阳性对照药为槲皮素,化合物13为N-trans-feruloyltyramin,14为(2S,E)-N-[ 2-hydroxy-2-(4-hydroxyphenyl)ethyl]ferulamide其结构见图1。Note:Quercetin was used as positive control,compound 13 is N-trans-feruloyltyramin,and 14 is (2S,E)-N-[2-hydroxy-2-(4-hydroxyphenyl)ethyl]ferulamide.Their structures are shown in Fig 1.
4 结论
本研究从宁夏枸杞根和茎部分离鉴定了12个化合物,均为首次从该植物中分离得到。此外,对这12个化合物进行了细胞毒活性和抗炎活性测试,发现化合物2具有明显的抗炎活性,其活性略强于阳性对照药槲皮素。通过比较化合物2、3、13、14的活性结果,推测具有阿魏酰酪胺骨架的一类化合物,R3上的取代基团是其抗炎活性的关键,其活性大小关系为:R3为甲氧基 > R3为氢取代 > R3为羟基,且当R3上为羟基取代时,化合物无抗炎活性。本研究结果为后续寻找宁夏枸杞中具有抗炎活性的天然活性成分提供了一些科学依据,丰富了医药和天然产物开发提的理论基础。
