甜菊耐寒相关基因SrDREB1As的克隆与转录因子特性分析
2019-10-11张婷杨永恒孙玉明侯孟兰李丕睿原海燕黄苏珍徐晓洋
张婷,杨永恒,孙玉明,侯孟兰,李丕睿,原海燕,黄苏珍,徐晓洋
(江苏省中国科学院植物研究所/南京中山植物园,南京210014)
0 引言
甜菊(Stevia rebaudiana Bertoni)为菊科(Asteraceae)多年生草本植物,原产于巴拉圭、巴西等地,因其叶中富含甜味成分,在原产地已有数百年的食用历史。研究证实甜菊叶中甜菊糖苷的甜度约为蔗糖的300~400倍,并具有低热量,预防和辅助治疗肥胖症、糖尿病、高血压和高血糖等优点[1-2],因此已被广泛应用于食品、饮料及医药等领域,甜菊亦成为继甘蔗和甜菜之后最具开发前景的天然糖料作物。
甜菊自19世纪70年代被从原产地引种后,目前全球主要栽培国家有中国、肯尼亚、巴拉圭、巴西和阿根廷等,其中中国的甜菊栽培面积约占全球的80%以上,主要的栽培省份包含江苏、安徽和山东等地[3-4],近年来随着日照长度较长、病虫害发生较轻等区域优势,甘肃、新疆和内蒙等省份逐渐成为甜菊的优势产区。然而由于甜菊喜好温暖湿润环境,最适生长温度在25℃左右,而上述省份常会遭受低温冷害甚至冻害,因此为了适应西北和北方地区寒冷的气候条件,防止甜菊叶产量和品质的下降,提高甜菊植株的耐寒能力也已成为甜菊育种的重要目标之一。除了通过传统杂交育种手段对甜菊目标性状进行改良之外,分子生物学手段也逐渐被应用于甜菊育种工作中。Kim等已通过转基因手段获得RA苷合成关键糖基转移酶基因SrUGT76G1超表达的甜菊植株,结果发现转基因植株中RA苷和STV苷的比例明显提高而总苷含量没有明显变化[5],因为RA苷相比于STV苷而言具有甜度更高、口感更优良等特点[6],因此表明转化SrUGT76G1基因可以提高甜菊植株的糖苷品质。Zheng等发现过表达糖苷合成路径较上游SrDXS1和SrKAH基因均可提高总糖苷含量[7]。之前的研究主要关注糖苷合成路径基因的挖掘,关于甜菊抗性分子生物学方面的研究较少。
AP2/ERF类转录因子家族是植物特有的一类转录因子家族,它们的家族成员均含有由60个左右氨基酸组成的保守结构域,即AP2结构域。根据结构域的数量及序列的相似性,可将该家族进一步分为AP2、ERF、RAV、CBF/DREB和特异蛋白AL079349即Soloist五个亚家族[8],其中DREB亚家族基因被广泛证实参与植物对非生物胁迫的响应,这个家族基因可以结合在启动子含有DRE/CRT(A/GCCGAC)元件的启动子上从而调控其表达[9-10]。DREB亚家族又可进一步被分为A-1~A-6 6个亚组,其中A-1亚组基因与植物的耐寒性密切相关[11]。模式植物拟南芥包含6个该亚组成员,其中DREB1A、DREB1B和DREB1C基因均可迅速受冷胁迫诱导表达,另外其过表达亦均可提高拟南芥的耐寒性[12-14]。因此,本研究根据课题组的甜菊转录组数据库拟通过同源克隆的方法在甜菊中获得DREB亚家族A-1亚组基因,另外通过亚细胞定位和转录激活活性实验进一步对基因功能进行研究,为以后通过转基因手段获得耐寒性提高的甜菊植株奠定基础。
1 材料与方法
1.1 实验材料与种植条件
实验所用的‘中山6号’甜菊植株保存于江苏省中国科学院植物研究所甜菊种质资源圃。用于亚细胞定位的烟草植株种植于小方盆中(营养土∶蛭石=2∶1),放于光照培养箱中培养,光周期为16 h光照,8 h黑暗,昼夜温度为23℃/18℃,光照强度为80~100 µmol/(m2·s)。
1.2 实验方法
1.2.1 RNA提取及基因全长克隆
取生长在资源圃的‘中山6号’甜菊叶片,速冻于液氮中,然后-80℃保存,用于RNA提取。利用TAKARA公司Trizol提取RNA步骤进行甜菊叶片总RNA提取。RNA的反转录采用TAKARA公司的PrimeScript 1stStrand cDNA Synthesis Kit(D6110A)并依据试剂盒操作步骤进行mRNA的反转录得到cDNA。

表1 研究所用PCR引物Table 1 The PCR primers used in thisstudy
根据课题组已有的‘中山6号’不同发育时期叶片的转录组数据库,利用拟南芥AtDREB1A(NCBI登录号为ABD42992)基因序列进行同源性查找,得到两条相似性最高的基因序列,将这两条序列提交NCBI数据库进行基因全长比对,然后设计基因全长引物SrDREB1A1-F/R和SrDREB1A2-F/R进行全长克隆(引物序列见表1),全长克隆的高保真酶选用TOYOBO公司的KOD,并按照说明书上步骤进行PCR扩增。扩增得到的片段构建在TAKARA公司的pMD19-T载体上,然后转化大肠杆菌感受态DH5α并涂布于含有氨苄抗性的平板上,过夜培养。挑取生长出的菌落进行PCR验证,然后选取阳性克隆进行测序,进而得到基因全长序列。
1.2.2 进化树构建及结构域分析
在NCBI网站上下载与SrDREB1A同源的氨基酸序列,利用MEGA 5.0软件对所有序列进行进化树构建,选择Neighbor-joining方法,Bootstrap参数值选择1 000[15]。另外将SrDREB1A1和SrDREB1A2蛋白序列提交NCBI网站进行序列分析,明确保守结构域位置,之后通过DNAMAN软件进行同源多序列比较,并标注保守结构域所在位置。
1.2.3 转录激活活性鉴定
选择合适的带有酶切位点的接头引物SrDREB1A1-BD-F/R和SrDREB1A2-BD-F/R(引物序列见表1)对构建在pMD19-T上的目的基因进行扩增,同时对pGBKT7空载体进行双酶切,然后通过重组方法将SrDREB1A1和SrDREB1A2构建在pGBKT7载体上。转化大肠杆菌感受态DH5α后,挑选阳性克隆送公司测序。应用Clontech酵母转化试剂盒将SrDREB1A1-BD、SrDREB1A2-BD、BD空载阴性对照质粒分别转化酵母菌株Y2H感受态细胞,并涂布于缺陷培养基SD/-Trp上。30℃倒置培养2~3 d后,挑取单克隆菌落,在0.9%NaCl溶液中打散后吸取相同体积的菌液点于SD/-His-Ade和SD/-His-Ade+X-α-gal培养基上。30℃倒置培养2~3 d后观察菌落生长和显色情况并拍照记录。
1.2.4 亚细胞定位
选择合适的带有酶切位点的接头引物SrDREB1A1-GFP-F/R和SrDREB1A2-GFP-F/R(引物序列见表1)对目标片段进行扩增,然后通过同源重组的方法将SrDREB1A1和SrDREB1A2构建在pCAMBIA1305-GFP载体上。将测序正确的质粒转化农杆菌菌株EHA105。挑取阳性农杆菌菌落至含有卡纳和利福平的LB液体培养基中,28℃震荡培养至OD值达到1.0左右。吸取400µL菌液与等量的P19菌液混合,离心后用重悬液充分悬浮菌体,并在室温放置2~4 h。用1 mL去针头的注射器吸取适量菌液,从烟草叶片的背部小心注射到叶肉组织中。烟草正常培养2~3 d后,用双面刀片切取注射部位叶片,倒置放于载玻片上并用激光共聚焦显微镜(LSM 700,Carl Zeiss)观察荧光发生情况[16]。
2 结果与分析
2.1 SrDREB1As基因克隆与结构分析
通过同源克隆方法我们在甜菊中获得了两个DREB类基因。进化分析发现这两个基因都属于A-1亚组,分别与紫荆泽兰和菊花中的CBF及DREB1A亲缘关系最近,因此将其分别命名为SrDREB1A1和SrDREB1A2(图1A)。结构分析发现SrDREB1A1和SrDREB1A2均具有一个典型的AP2结构域(图1B)。SrDREB1A1ORF全长660 bp,编码219个氨基酸残基,通过BioXM软件预测的蛋白分子量为24.58 kDa,等电点为5.42。SrDREB1A2ORF全长630 bp,编码209个氨基酸残基,预测的蛋白分子量和等电点分别为23.21 kDa和5.41。
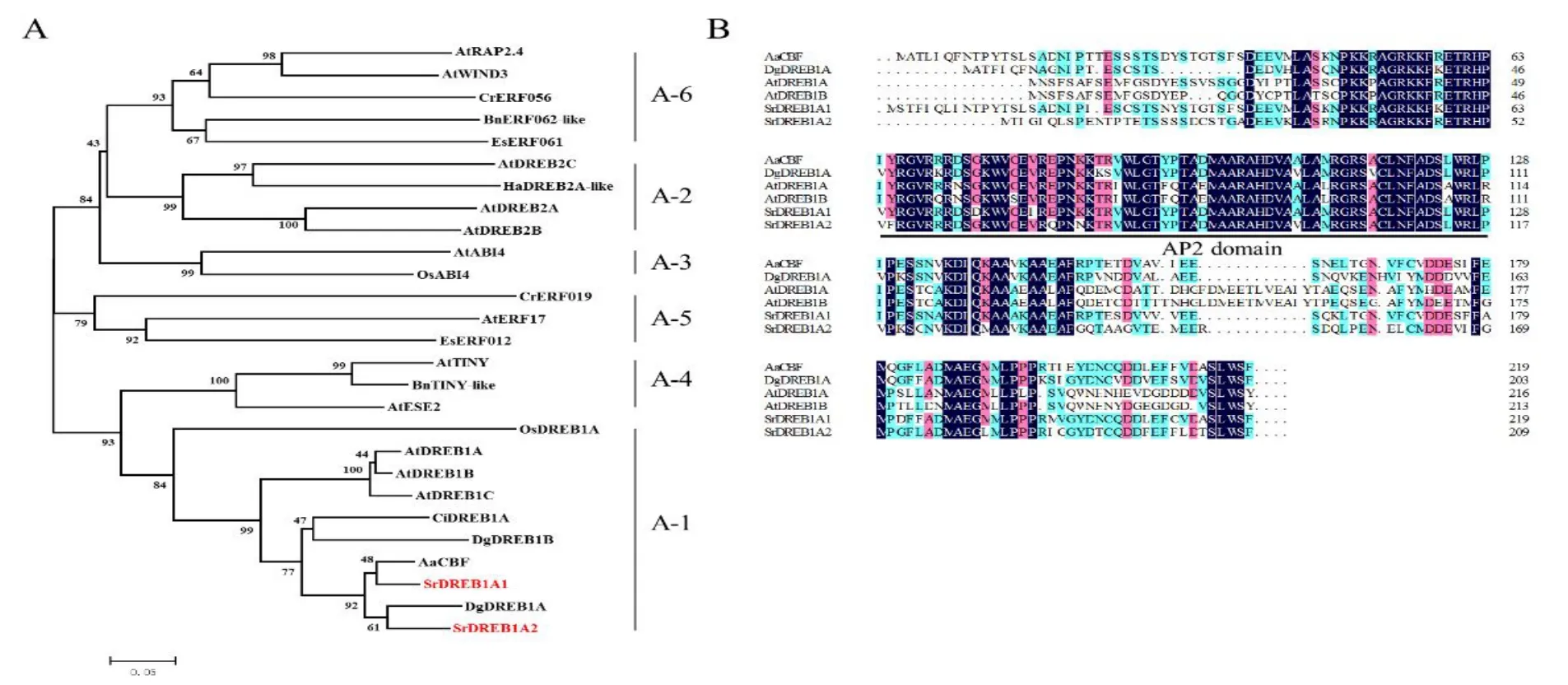
图1 SrDREB1A1和SrDREB1A2进化树(A)和结构域分析(B)Fig.1 Phylogenetic analysis(A)and domain comparison(B)of SrDREB1A1 and SrDREB1A2
2.2 SrDREB1A1和SrDREB1A2转录激活活性分析
为了鉴定其转录活性,分别将SrDREB1A1-BD和SrDREB1A2-BD载体转化入酵母细胞中。在SD/-His-Ade缺陷培养基上培养3 d后发现,转化SrDREB1A1-BD和SrDREB1A2-BD的酵母细胞生长良好,并且能在添加X-α-gal的培养基上显蓝色,而转BD空载体的阴性对照的菌落则不能正常生长(图2)。以上结果表明,SrDREB1A1和SrDREB1A2均具有转录激活活性。因此这两个转录因子在甜菊植株体内可能是通过激活下游胁迫响应相关基因的表达来调控耐寒性。

图2 SrDREB1A1和SrDREB1A2转录激活活性分析Fig.2 Transactivation activity analysis of SrDREB1A1 and SrDREB1A2
2.3 SrDREB1A1和SrDREB1A2亚细胞定位
转录因子进核对其行使转录调控功能具有重要的作用。通过激光共聚焦显微镜观察发现,转化GFP空载体的烟草叶片细胞在细胞核和细胞质中都可以观察到绿色荧光信号的产生,而转化SrDREB1A1-GFP和SrDREB1A2-GFP载体的烟草叶片只在细胞核中特异地观察到绿色荧光信号(图3)。以上结果表明,SrDREB1A1和SrDREB1A2主要定位在细胞核,具有典型转录因子的功能。
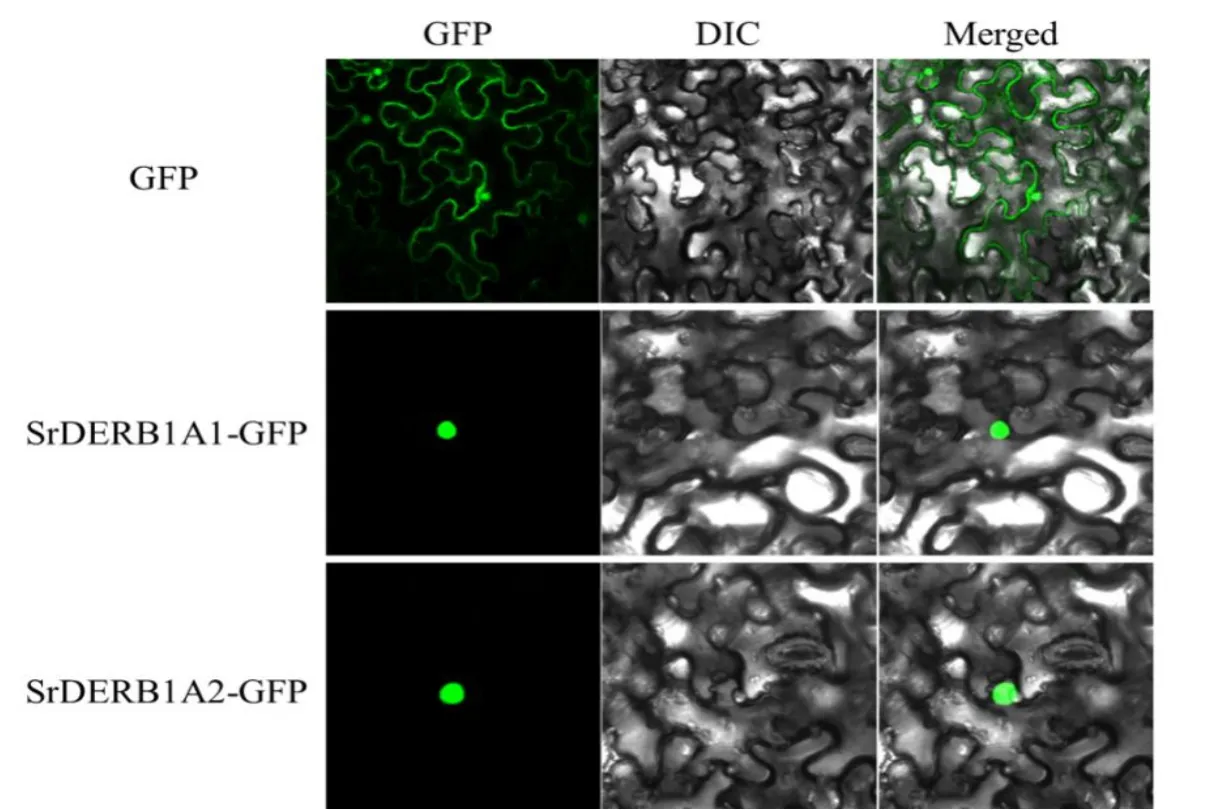
图3 SrDREB1A1和SrDREB1A2的亚细胞定位Fig.3 Subcellular localization of SrDREB1A1 and SrDREB1A2
3 讨论
开展甜菊耐寒性的研究对于进一步扩大甜菊的种植区域及延长寒冷地区甜菊的生育期都具有重要作用,然而目前关于这方面的研究较少,并且主要集中在栽培措施的改善及生理指标的测定等方面,例如,汤其坤利用重离子辐照方法筛选甜菊耐寒性品系,发现低温条件下甜菊幼苗抗氧化酶活性可作为评价耐寒性的生理指标,并得到了两个耐寒性较好的单株[17]。杨敬敏等用60Co-γ和离子束注入甜菊5个杂交组合F1代种子,发现诱变处理有助于选育耐寒甜菊品种[18]。孙廷甲等发现河西走廊地区早春冻害会导致甜菊叶片及茎间末梢组织受损、根系发育受阻从而导致叶片及地上部干物质量明显减少,并且提出了一些具体的防控措施,包括:增施磷酸二氢钾底肥、移栽前后及时灌水、中耕培土和烟熏升温防冻等[19]。除了这些农艺措施外,Peynevandi等还发现外源施加多胺可以提高甜菊的耐低温能力[20]。然而随着分子生物学的发展,通过分离相关抗性基因、分析抗性机理及通过基因编辑技术等手段获得遗传改良的甜菊新种质必将成为以后的发展方向。因此本研究首次在甜菊中克隆了正向调控耐寒性的基因SrDREB1A1和SrDREB1A2,并对它们与其他物种的同源性进行比对,发现与紫荆泽兰及菊花的DREB1A类亲缘关系较近,紫荆泽兰和菊花都属于菊科植物,相比于拟南芥和水稻而言在遗传关系上与甜菊的关系较近,因此表明聚类分析的准确性。A-1亚组基因在多个物种中均可提高植株的耐寒性[21-22],表明此类基因的功能保守性,也暗示SrDREB1A1和SrDREB1A2可正向调控甜菊的耐寒性。SrDREB1A1和SrDREB1A2均具有转录激活活性并且定位在细胞核,表明它们具有典型的转录因子功能,并且可能通过直接结合下游目标基因的启动子序列进而激活其表达,从而达到正向调控甜菊耐寒性的效果。本研究构建的pCAMBIA1305-GFP-SrDREB1As载体是由35 S启动子驱动,因此也可作为之后转基因的表达载体使用。综上,本研究克隆了2个正向调控甜菊耐寒性的DREB类转录因子,为以后甜菊耐寒性分子育种提供候选基因资源,具有十分重要的理论与实际研究意义。
