利用ISSR构建甜菜品种指纹图谱
2019-10-11齐少玮闫彩燕郭佳吴则东兴旺
齐少玮 ,闫彩燕 ,郭佳 ,吴则东 ,兴旺
(1.国家甜菜种质中期库/黑龙江大学,哈尔滨150080;2.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨150080;3.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;4.哈尔滨师范大学,哈尔滨150025)
0 引言
自21世纪以来,我国甜菜种子市场引起国外育种公司注意,国外育种公司生产的甜菜品种具有易存活、产量高、质量好、种子处理技术先进等优点[1]。当前国外的甜菜品种几乎占据了中国甜菜种子的全部市场,其中进口比重较大的是德国和比利时,各占37.2%和36.8%,其次是意大利,占14.6%,进口种子的77.6%用于种植生产原料;我国的国产新品种也在不断研发中[1]。但与此同时市场上开始出现了一些假冒伪劣的甜菜种子,由于引进的种子多采用包衣或丸粒化处理,购买者无法从外形上辨别甜菜品种,也没有完善的技术手段进行检验,导致出现某品种纯度不够或品种张冠李戴的情况,这种情况严重损害了农民以及育种家的利益,因此开发出一套快速、准确鉴定甜菜品种的方法成为当务之急。
品种鉴定可以检验种子中是否掺入了其他品种,保证品种的真实性和一致性,世界各国都十分重视品种真实性及纯度的鉴定,我国也针对品种鉴定制定了一系列的法律法规来规范种子市场。以往采用形态学方法[3],如种子形状、颜色、大小等。由于甜菜遗传基础比较狭窄、亲缘关系较近[4-5],能真正应用于鉴定中的形态特征又比较少,使这种方法检测周期时间长、不易区分,形态学辨别相近品种较为困难。DNA分子标记技术是近年来发展起来的一种较为理想的遗传标记形式,目前已广泛应用到了甜菜育种各方面,其主要包括RAPD[6-7]、AFLP[3,7]、SSR[8]、SNP[9],这些标记表现出基因之间的实际遗传变异水平,得到的结果更加直接、准确,已在生物学领域得到了广泛应用。以分子标记为基础构建的DNA指纹图谱则可以有效鉴定作物品种,指纹图谱针对每一个品种都有其独特性、差异性,使其鉴定结果准确、可靠的同时,又节省了大量的时间,是快速、简单、高效的科学鉴别手段,近年来已经在多种作物鉴定研究中得到了快速发展,是当前鉴定品种、构建指纹图谱和进行遗传多样性分析的主要方法[3,10-11]。
ISSR(Inter-simple sequence repeat,简单重复序列间区)是Zietkiewicz等人于1994年提出的一种新型分子标记技术[12],其原理是用锚定的微卫星DNA做引物,在3′端或5′端随机加入2~4个核苷酸,利用单一引物进行扩增。ISSR引物具有通用性,它结合了SSR、RAPD和AFLP分子标记的技术优点,即引物设计简单、重复性好、多态性高、开发应用成本较低等。目前,国内外ISSR分子标记技术在植物遗传多样性分析研究、构建指纹图谱、品种鉴定等方面已有了广泛应用[11]。Wu等[13]利用14个ISSR引物对33个李子品种进行遗传多样性分析并确定了其种群结构,发现其遗传变异主要发生在群体内部;Hossein等[14]利用22个ISSR引物对苦味和甜味阿魏进行遗传分化研究,结果表明ISSR分子标记适合于研究其种群的遗传多样性,可将相同属的种群与相似的种质区分开;谢玥等[15]用筛选出的10条ISSR引物扩增了25个猕猴桃品种,对其进行品种和种质资源材料遗传多样性分析并构建出ISSR指纹图谱,在相似系数水平为0.604时,可将试验品种聚为3类。但截止到目前,我国有关ISSR甜菜品种DNA指纹图谱构建有研究基础,但报道还不多,刘华君等[16]、付增娟等[17]首先建立了一套适合于甜菜ISSR优化反应体系及程序并进行了验证,使用优化后的体系和筛选的引物,仅用1条ISSR引物就成功地区分了10个甜菜品种并建立了指纹图谱;刘巧红等[18]利用2条ISSR引物可以将10个甜菜品种完全区分出来。
本试验以39个甜菜品种为试验材料,运用ISSR分子标记技术构建甜菜品种指纹图谱的研究,以期为快速鉴定甜菜品种提供科学的理论依据,为育种家维护权利提供技术支持以及保护农民的利益。
1 材料与方法
1.1 试验材料、试剂及仪器
1.1.1 试验材料
试验所用的品种均由农业农村部全国农业技术中心提供,所有品种都在黑龙江大学农作物研究院温室中进行栽培,并在黑龙江大学甜菜遗传育种重点实验室进行试验分析。品种来源及其名称见表1。
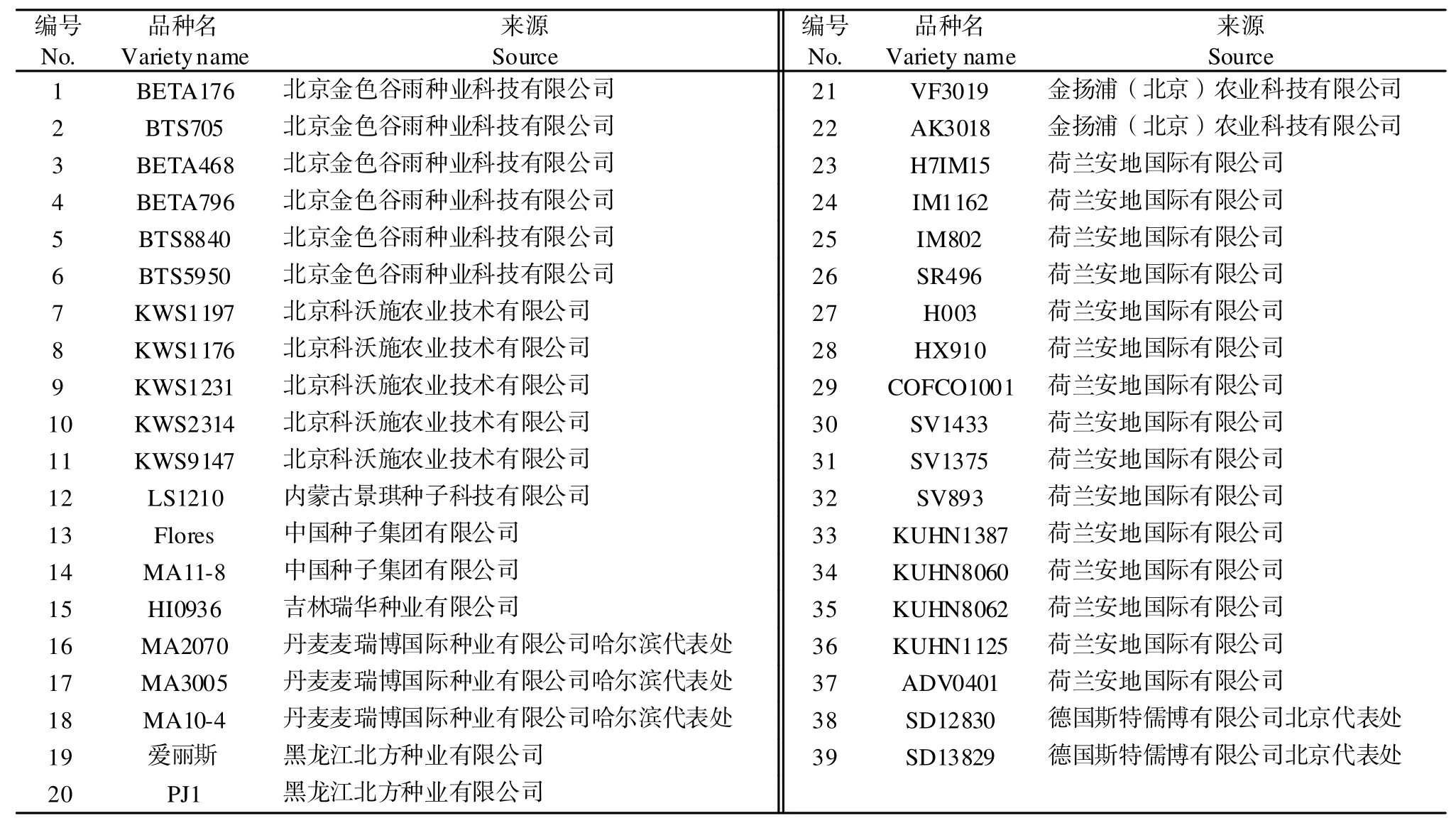
表1 供试验的甜菜品种Table 1 Sugar beet varieties for trial
ISSR引物:试验所用的引物序列均来自美国加拿大哥伦比亚大学设计并公布的100条ISSR引物,试验引物都是由上海生工生物有限公司合成的,采用HAP纯化。
1.1.2 主要试剂
CTAB、Mix、Loading Buffer、琼脂糖、TEMED、TBE、EDTA、硼酸、乙醇、冰醋酸、硝酸银、氢氧化钠、甲醛等(实验室所用药品均购于哈尔滨瀚博化学试剂公司)。
1.1.3 仪器设备
震荡研磨机(Retsch MM40)、紫外分光光度计(Thermo NanoDrop 2000)、高速冷冻离心机(Thermo Scientific SorvallStratos)、PCR仪(Applied BiosystemsVeriti)、电泳槽(北京六一仪器公司)、电泳仪(Bio-Rad PowerPAC 200)、迷你混合仪(MIULAB Mini-10K)、微孔板离心机(MIULAB MINIP-2500)、简洁型白光透射仪(海门麒麟GL-800)等。
1.2 试验方法
1.2.1 DNA的提取
将要进行试验的甜菜种子播种于黑龙江大学农作物研究院温室营养钵中,待种子长出4片真叶时,每个品种取5株,用剪子将幼苗剪断后装入2 mL离心管,在每个离心管中加入一颗钢珠并在管盖及管壁上做好标记。将所有样品放入液氮中浸泡3~5 min,然后用震荡研磨机以30 r/s的频率震荡1 min 30 s,震荡并确认所有样本均已被打碎后,使用CTAB法[19]进行DNA的提取。
最后利用紫外分光光度计测量DNA的纯度及浓度,在管壁上进行标记,并将其浓度稀释至10 ng/μL。
1.2.2 ISSR-PCR反应体系
PCR总反应体系为5 μL,其中含有Mix 2.5 μL,引物(质量浓度为10 μmol/L)0.2 μL,模板DNA(质量浓度为10 μmol/L)1 μL,最后加入灭菌双蒸水补充至5 μL,振荡混匀。
1.2.3 ISSR-PCR反应程序
反应程序为:94℃预变性4 min;94℃变性30 s,65℃退火30 s,72℃延伸30 s,退火温度从65~51℃每降一度循环进行2次;94℃变性30 s,50℃退火30 s,72℃延伸30 s,15个循环;最后72℃延伸5 min;4℃保存。
1.2.4 聚丙烯酰胺凝胶电泳检测
在扩增后的产物中加入1 μL Loading Buffer,用微孔板离心机进行离心。使用6%的非变性聚丙烯酰胺凝胶对扩增产物进行电泳检测,电泳缓冲液为0.5×TBE,电压设定为180 V,电泳90 min。电泳结束后,利用快速银染法[20]进行漂洗、染色、显影成像,并置于简洁型白光透射仪上拍照记录。
1.3 数据记录
记录成像清晰的DNA扩增条带,对比不同品种的条带有无重复。统计每个品种ISSR扩增图谱在同一位置上有无条带,如果有条带记为1,无条带记为0,构建“0,1”矩阵,将统计结果输入Excel表格,统计条带数和多态性比率。应用Mega软件对数据进行聚类分析。多态性位点百分率P=(k/n)×100%,其中k为多态性位点的数目;n为检测到的位点总数[6]。
2 结果与分析
2.1 ISSR引物筛选与多态性分析
利用前期筛选的多态性好的引物ISSR826和ISSR827对39个试验材料的基因组进行扩增。这2条引物共扩增出27个条带,其中多态性条带数为23条,平均多态性比率为85.2%,扩增出的DNA片段基本集中在150~400 bp之间,一小部分片段超过400 bp。ISSR826引物共扩增出7条谱带,其中有5条条带为多态性条带,多态性比率为71.4%。ISSR827引物共扩增出20条谱带,其中有18条条带为多态性条带,平均多态率为90.0%。这2条引物扩增出的条带数和多态性水平有较大差异。2条引物的扩增结果见图1和图2。

图1 ISSR826引物的扩增结果Fig.1 Amplification results of ISSR826 primers

图2 ISSR827引物的扩增结果Fig.2 Amplification results of ISSR827 primers
2.2 39个甜菜品种的聚类分析
利用Mega7.0软件进行聚类分析并处理编辑,结果见图3。
根据亲缘关系的远近,在所有品种中HX910和XV1433与其余所有品种的亲缘关系最远,可以单独分为一支。将剩下的37个品种作为第二支,根据亲缘关系继续分成了6组,其中MA11-8又与其他品种亲缘关系较远,单独分成第一组;第二组为 KWS2314、SR496、KWS1176、IM1162、BETA796、COFCO1001、LS1210、H7IM15;第 三 组 为 Flores、VF3019、SV1375;第 四 组 为 ADV0401、IM802;第 五 组 为 MA2070、BTS705、KWS1231、KUHN8060、AK3018、KUHN1225、SV893、SD12830、BETA468、H003;第 六组为 PJ1、BTS5950、BTS8840、爱 丽 斯 、KUHN8062、HI0936、SD13829、BETA176、MA3005、KWS1197、KUHN1387、MA10-4、KWS9147。在所有分支中,第五组和第六组所含品种数量较多,分别为10个(占总数的25.6%)和13个(占总数的33.3%)。

图 339个甜菜品种的聚类分析图Fig.3 Cluster analysis of 39 sugar beet varieties
由结果分析可知,试验品种的亲缘关系与其所在公司的关系并不大,各公司的各个品种在每一小组中都有不同程度的分布。但也有个别同公司品种聚在一起的情况,如BTS8840和BTS5950。这说明每个公司在育种时及投放市场时,并没有全部采用亲缘关系较近的亲本,它们的品种父母本组合广泛、多样化。
2.3 构建ISSR指纹图谱
利用ISSR826、ISSR827对39个甜菜品种的扩增谱带进行分析,这2条引物对应的大部分品种都有其独特的特征谱带,其中利用引物ISSR827可以区分37个品种,ISSR827无法区分品种22和34号品种,而这2个品种可以利用ISSR826区分出来。在实际生产应用中,只要用相应的引物对所鉴定的品种进行扩增,利用特征谱带法,将扩增结果与标准指纹图谱进行条带对比,就可鉴别品种的真实性和纯度。将这2条引物组合在一起,即ISSR826和ISSR827就可以完全区分出39个甜菜品种,由此利用这2条引物构建了全部39份甜菜品种的数字指纹图谱。
3 讨论与结论
以往依靠表型特征等方法鉴别甜菜品种的方法受环境等因素影响大,鉴别难度大、错误率较高,加之甜菜种质资源的不断扩充、品种数量的不断增加,品种间的相似度也逐渐增高、亲缘关系越来越近,所以采用传统的分析鉴定方法来区分甜菜品种也愈发困难。由于DNA受环境等因素影响较小,多态性高,利用DNA扩增的分子标记方法已经成为鉴定甜菜品种及其他作物品种的主要方法。加之ISSR分子标记技术在甜菜品种鉴定上的应用较少,本试验运用两条ISSR引物ISSR826、ISSR827扩增条带构建的指纹图谱,运用特征谱带法就可以将39个甜菜品种的真实性和纯度区分鉴定出来。这说明ISSR是一种较为理想的构建甜菜品种指纹图谱的分子标记技术,证明了其在遗传多样性研究及亲缘关系分析中具有巨大的应用价值,加快了甜菜分子生物学各领域的发展,为ISSR分子标记在甜菜种质鉴别及在其他作物的应用上做出了贡献。
本研究筛选出的2条ISSR引物对于特定的品种具有特征谱带,在单独使用时均可鉴定分别出一定数量的品种。随着甜菜品种数量的增加,其原有的特征谱带可能与新品种的扩增条带重复一致,且应用引物数量有限、条带数量不够多,所以此方法如今只能针对一些特别实验范围、特别品种。若想获得更多的特征谱带,还需进行大量的核心引物筛选。目前所开发的ISSR引物仅有100条,能真正应用于甜菜作物的ISSR引物更具有局限,未来随着分子生物学的不断发展、引物不断设计开发,能筛选应用的核心引物将越来越多。将几个引物组合运用,将结果补充到现有的图谱中,构建品种更多更丰富的指纹图谱,为甜菜品种纯度及真实性的鉴定提供强大的理论支撑,使每一个甜菜品种都有其专门的分子身份证,未来有望为育种家选育携带优良性状的品种提供辅助[21]。
本实验在100条ISSR引物中筛选出合适的2条引物作为核心引物,运用这2条ISSR核心引物,成功构建了39个甜菜品种的指纹图谱,可用于甜菜品种的鉴定。
