牡蛎Cra g 1蛋白大鼠致敏模型的建立与分析
2019-10-10张江涛张瑞雪方磊魏颖凌空周明谷瑞增鲁军李国明
张江涛,张瑞雪,方磊,魏颖,凌空,周明,谷瑞增,鲁军,李国明
(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京,100015)
食物过敏一直是人们所面临的重要安全问题和公共卫生问题。据统计,有2%~3%的成年人,6%~8%的儿童受到食物过敏的影响[1]。大多数的食物过敏都属于免疫球蛋白E(IgE)介导的Ⅰ型过敏反应[2]。
牡蛎(生蚝)是世界第一大养殖贝类,也是我国四大养殖贝类之一[3]。近年来,随着人们对贝类等水产品消费水平的升高,由食用牡蛎所引发的过敏反应也引起我们的重视。水产品中常见的过敏原有小清蛋白、原肌球蛋白、精氨酸激酶、胶原蛋白、肌钙结合蛋白等[4-6],其中原肌球蛋白是牡蛎的主要过敏原[7]。牡蛎的原肌球蛋白被命名为Crag1,其相对分子质量在37 kDa左右,主要二级结构为α-螺旋[8-10]。目前人们对虾、蟹等其他水产品过敏原的研究相对较多,而对牡蛎过敏原表位信息的研究较少,至今尚未明确。
国内外研究大多集中在牡蛎过敏原Crag1的体外实验(如热处理、酶解等工艺)方面,迄今为止还没有关于建立牡蛎动物致敏模型的相关报道。在多数情况下,引起人类过敏的食物,也会引起动物的过敏反应,因此通过建立动物致敏模型,展开深入机理研究是非常必要的[11]。棕色挪威大鼠(BN大鼠)是具有高IgE反应性的品系,BN大鼠在致敏原刺激下,能产生较高水平的特异性IgE、IgG抗体,具有较强的致敏免疫反应[12]。报道显示,雌性BN大鼠较雄性BN大鼠而言更易致敏[13]。另外本实验组先前通过基因重组的方式成功表达、纯化并鉴定了牡蛎过敏原Crag1蛋白[14],这也为本实验奠定了相应的基础。与天然提取的Crag1相比,重组表达的提取过程相对简单、产物纯度更高。因此本实验的目的是利用重组牡蛎Crag1蛋白来致敏雌性BN大鼠,通过观察BN大鼠的全身主动过敏反应、体重、体温、免疫器官指数,检测其血清中总IgE、sIgE、sIgG和血浆中组胺释放量、血象等指标的变化,HE染色观察肠道组织、肝组织以及肾组织的病理变化,甲苯胺蓝染色观察肠道组织的肥大细胞脱颗粒情况,来初步建立牡蛎Crag1蛋白BN大鼠致敏模型,为下一步细胞致敏模型的建立和基因重组所构建的低致敏性牡蛎突变Crag1的过敏原性评价提供基础。
1 材料与方法
1.1 实验材料
雌性棕色挪威大鼠(BN大鼠):(6~8周龄,24只),由维通利华动物公司提供,许可证号为SCXK(京) 2016-0006;牡蛎Crag1蛋白,通过基因重组的方式获得;大鼠IgE酶联免疫试剂盒、大鼠组胺试剂盒,上海酶联免疫生物公司;辣根过氧化物酶标记的山羊抗大鼠IgE、辣根过氧化物酶标记的山羊抗大鼠IgG、抗凝剂EDTA-2K、TMB显色液、弗氏佐剂、弗氏不完全佐剂、内毒素去除试剂盒,Sigma公司。
1.2 实验方法
1.2.1 牡蛎Crag1蛋白的制备与纯化
登陆NCBI网站,根据GenBank提供的牡蛎原肌球蛋白Crag1基因序列(登录号AB444943.1),设计引物,提取牡蛎总RNA,反转录cDNA,与pET21a载体连接,构建重组质粒pET21-Crag1。然后将重组质粒导入大肠杆菌BL21中,筛选阳性菌落。
将重组大肠杆菌(BL21)在最佳条件下扩大培养并诱导表达,收获细胞沉淀,将细胞沉淀重悬于溶液(Tris-HCl pH 8.0)中并超声处理(开启3 s,关闭3 s,20 min),离心(15 000 r/min,30 min,4 ℃)后通过0.22 μm过滤膜过滤。将过滤的蛋白质溶液加载到KTA-快速蛋白质液相色谱(FPLC)系统的带Ni2+的Hi-Trap螯合HP柱上,用高浓度咪唑洗脱结合在Ni-柱上的Crag1。另外在原核蛋白表达中,细菌内毒素去除是比较重要的一个环节,细菌内毒素是细菌的死体或代谢产物,可引起发热、内毒素休克、血管凝血等症状[15-17]。通过内毒素去除试剂盒,除去Crag1蛋白溶液中的内毒素,使内毒素含量控制在0.1 EU/μg以下。
用BCA法测蛋白浓度,并贮存在-20 ℃备用。重组Crag1蛋白与天然Crag1蛋白先前实验的鉴定与比对确保了无差异性[14],为动物免疫奠定了基础。
1.2.2 BN大鼠的免疫
雌性BN大鼠在饲养1周后无异常反应,将其随机分为2组,牡蛎Crag1蛋白致敏组和PBS对照组,每组各12只,免疫前采血制备阴性血清。实验组采用灌胃与腹腔注射相结合的方式致敏(如图1)。在第4、11、18、24、31、39天灌胃1 mL的Crag1蛋白(1 mg/mL);在第1、7、14、28天腹腔注射1 mL的Crag1,(腹腔注射时,第一次注射Crag1与弗氏佐剂等体积混合,之后注射与弗氏不完全佐剂等体积混合,混合之后浓度为1 mg/mL;在第42天用2 mg/mL的Crag1灌胃和腹腔注射进行激发。对照组进行相同的操作,试剂改为PBS溶液(pH 7.4)。分别于第7,14,21,28,35,42天内眦取血,离心分离血清,用于测定总IgE、特异性IgE和特异性IgG。于14、28、35、42 d眦取血于EDTA-2K抗凝管中,离心分离血浆,用于测定组胺的含量的变化。
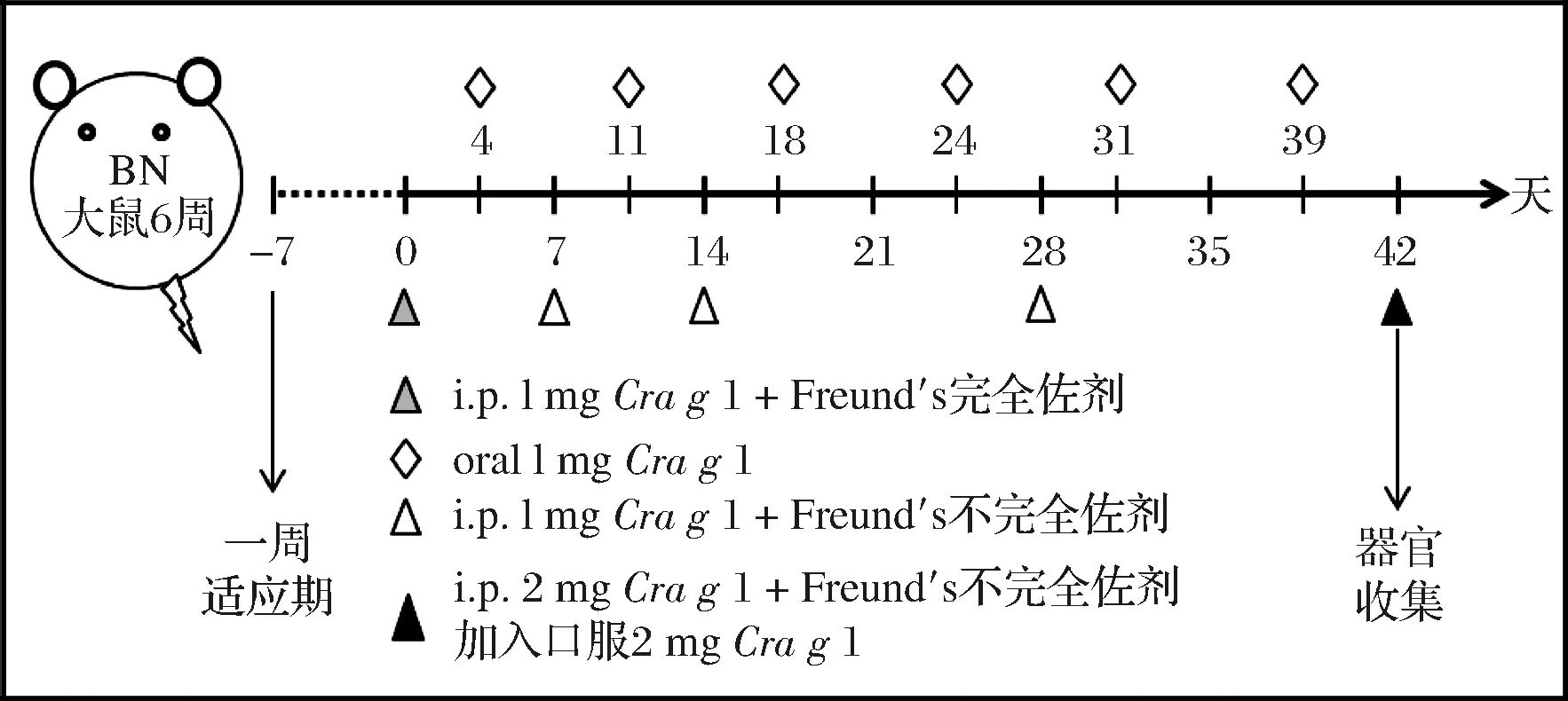
图1 BN大鼠的致敏流程Fig.1 Sensitization procedure of BN rats
1.2.3 BN大鼠的全身主动过敏反应评价
在第42天通过灌胃和腹腔注射高浓度牡蛎Crag1蛋白进行激发,激发前后30 min进行体温测量,观察BN大鼠体温变化情况,然后观察大鼠的全身过敏反映症状,并按照何仁静[18]过敏评分表(表1)进行评定其表型过敏级数。

表1 过敏反应级数Table 1 Allergy reaction grade
注:-表示没有过敏;±表示一级过敏;++表示三级过敏;+++标识四级过敏;++++表示五级过敏。
平均过敏级数达到2级即可判定为发生表型过敏反应。平均反应级数和过敏率计算公式如式(1)、式(2):
(1)
(2)
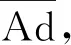
1.2.4 BN大鼠体重、免疫脏器和其他主要脏器指数变化
致敏期间,每周称体重1次,计算平均体重,激发取血后处死BN大鼠,无菌取出胸腺和脾脏,以及肾脏、肝脏,计算脏器指数,如公式(3)所示。

(3)
1.2.5 BN大鼠血象指标变化
实验于第14、28、42天取血于含有抗凝剂EDTA-2K抗凝管中,血浆通过血球分析仪分析白细胞计数、中性粒细胞计数、淋巴细胞计数、嗜酸性细胞计数等血象指标。
1.2.6 血清中总IgE、特异性IgE、特异性IgG和血浆中组胺的含量测定
BN大鼠血清中特异性IgE(特异性IgG)测定:通过间接ELISA法进行检测,用浓度为20 μg /mL的牡蛎Crag1蛋白进行96孔板包被,4 ℃孵育过夜;PBST洗涤3次,350 μL的5%脱脂奶粉37 ℃封闭1 h; 洗涤3次,加入2%脱脂奶粉稀释的BN大鼠血清(1∶100)100 μL,室温下孵育3 h;洗涤3次,每孔加入100 μL稀释(1∶5 000)的HRP标记的山羊抗大鼠IgE(或IgG),37 ℃孵育1 h;洗涤5次,每孔加入100 μL TMB底物显色液,避光孵育30 min,最后加入50 μL 2 mol/L的H2SO4终止实验,用酶标仪在450 nm 测OD值。阴性对照用未免疫的BN大鼠血清,以PBS为空白对照调零。
BN大鼠血清中总IgE、血浆中组胺的含量测定,均按照ELISA试剂盒的操作说明进行。
1.2.7 BN大鼠脏器、肠道病理切片观察
在第42天取完血后,取其回肠、肝脏、肾脏,用10%的多聚甲醛固定,固定合适时间后修剪;用不同浓度梯度的乙醇脱水,浸蜡并包埋,之后切片,苏木精-伊红染色(HE染色),显微镜下观察组织病理变化并拍照;甲苯胺蓝染色观察肠道肥大细胞脱颗粒情况。
1.3 统计学分析
用Mircrosoft Excel 2010及Origin Pro 8.0进行数据统计分析,组间检验采用t检验,P<0.01 具有极显著差异(用**表示);P<0.05 具有显著差异(用*表示)。
2 结果与分析
2.1 BN大鼠的全身主动过敏反应结果及体温变化
在第42天激发实验后,对照组BN大鼠无任何异常,均未出现过敏症状;实验组大鼠表现出不同级别的过敏症状:不断对鼻子、耳朵、头周围以及腹部进行抓挠,眼睛或者嘴巴周围浮肿,活动减少;有3只出现颤抖、抽搐等症状。根据表1进行具体过敏反应级数统计,结果如图2所示。
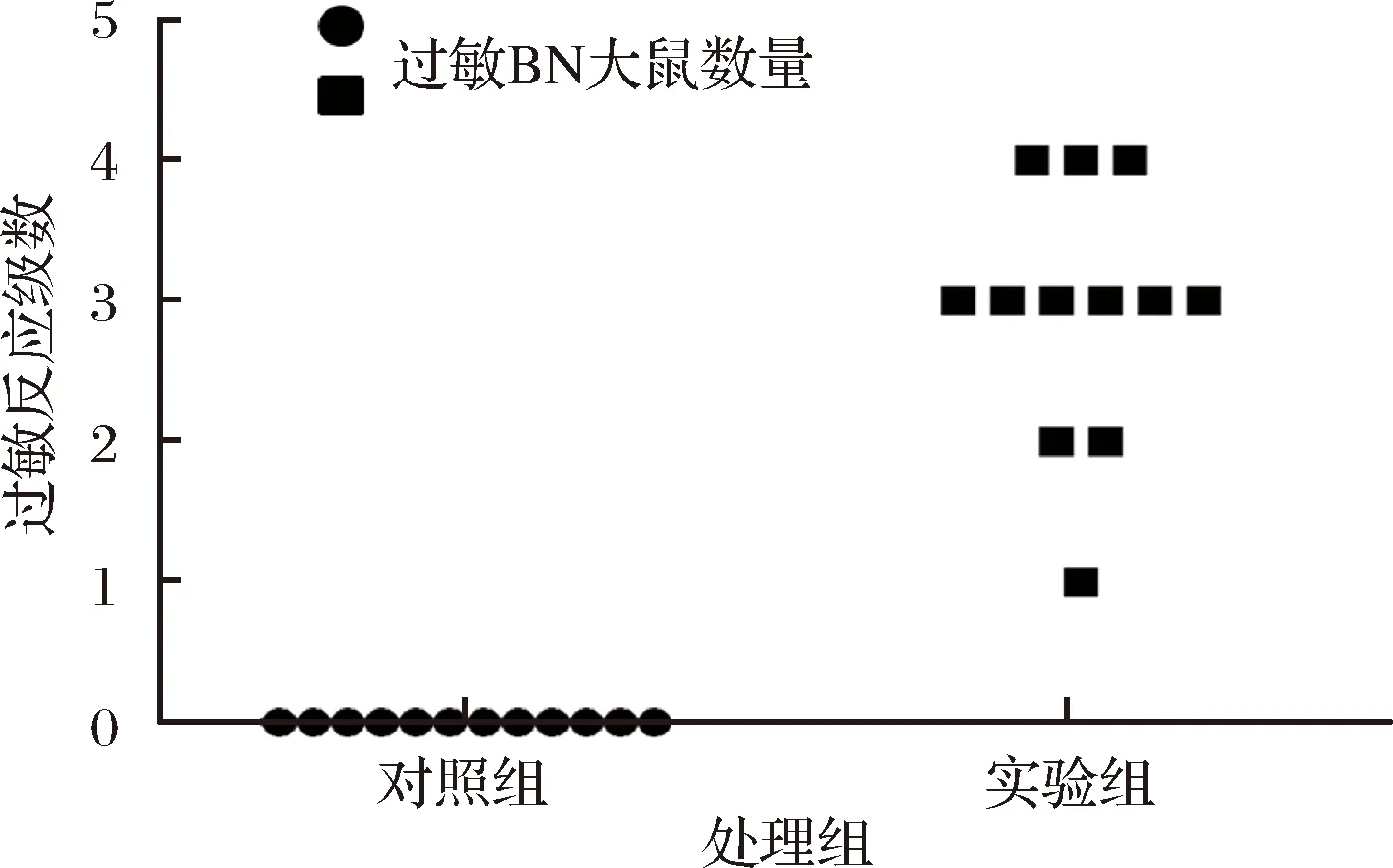
图2 BN大鼠的过敏反应级数Fig.2 Allergic reaction series of BN rats
体温变化情况如表2所示,在高浓度牡蛎Crag1蛋白进行激发前,对照组与实验组体温无明显差异,都在(38±0.7)℃。大剂量激发后,对照组BN大鼠升高约0.5 ℃,而实验组出现体温下降情况,比对照组平均体温降低2 ℃,表明牡蛎过敏原蛋白Crag1可以引起BN大鼠体温下降。李晓烨等[19]通过热带螨重组Blot5变应原诱导小鼠致敏时也出现类似现象。

表2 BN大鼠激发前后的体温变化Table 2 Changes in body temperature before and after challenge in BN rats
注:*表示不同组间差异显著(P<0.05);**表示不同组间差异极显著(P<0.01),下同。
2.2 BN大鼠体重变化、免疫脏器和其他主要脏器指数
2.2.1 BN大鼠体重变化
体重变化情况如图3所示,所有BN大鼠体重均呈现出递增状态,但对照组与实验组增长速度呈现出一定差异,在0~7 d差异不明显,之后实验组大鼠体重明显轻于对照组,第42天平均体重差接近20 g。牡蛎Crag1蛋白对BN大鼠体重产生了一定的影响,可能是由于过敏反应使其健康状态受到影响,使其消化系统乃至吸收系统出现损伤,最终表现为体重增长缓慢。
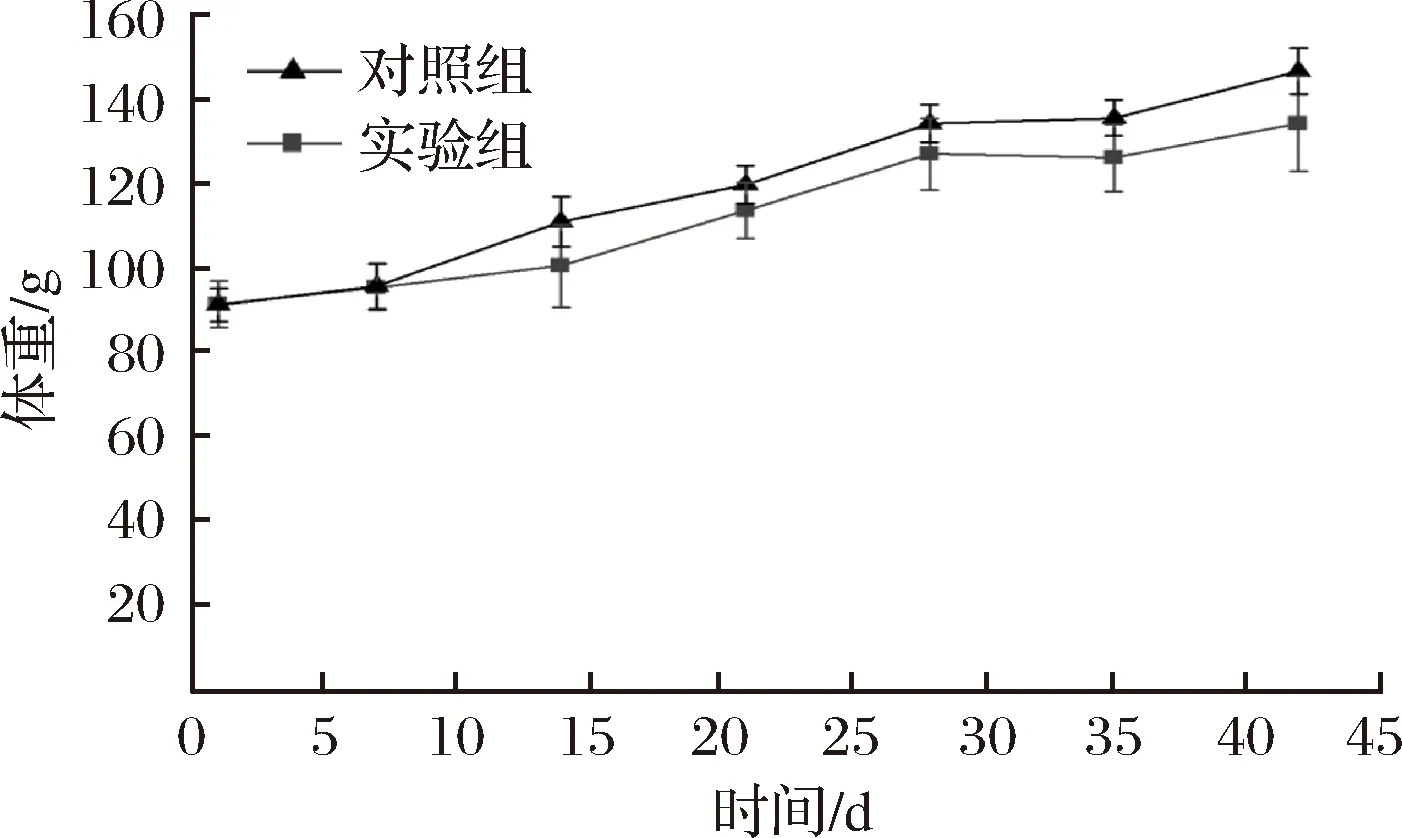
图3 BN大鼠体重变化Fig.3 BN rat body weight changes
2.2.2 免疫脏器和其他主要脏器指数
脏器指数如表3所示,实验组与对照组的胸腺、脾脏、肾脏、肝脏指数均呈现出显著性差异,实验组脏器指数明显高于对照组。过敏反应属于免疫应答反应,胸腺和脾脏都是主要免疫器官,胸腺为T细胞分化、成熟的场所,对外周免疫器官和免疫细胞具有调节作用[20];脾脏能激活B细胞使其产生大量的抗体,是T细胞和B细胞的定居场所,也是免疫应答发生的场所[21]。胸腺和脾脏指数明显增大,可能是牡蛎Crag1蛋白所引起的过敏反应导致免疫器官肿大。
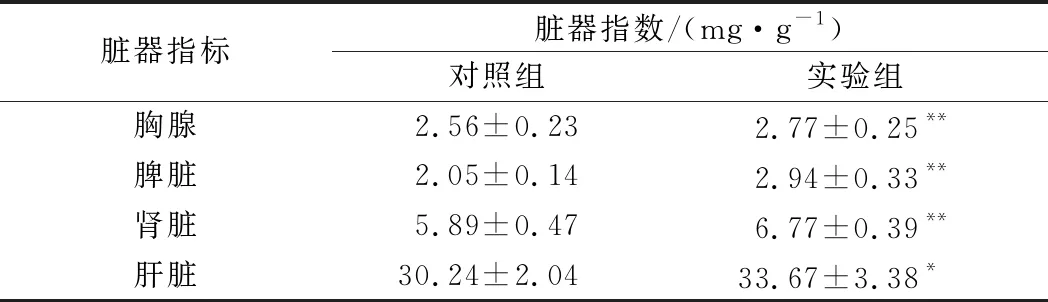
表3 BN大鼠脏器指数Table 3 BN rat organ index
2.3 BN大鼠血象指标变化情况
过敏反应是指已产生免疫的机体在再次接受相同抗原刺激时所发生的一系列过敏现象[22]。与此同时,机体内细胞也会发生一系列的应激反应,其数量和种类也会发生变化。白细胞的数目随机体的健康状态不同而有很大波动,明显增加或者减少。白细胞主要起防卫作用,白细胞并不是均一的细胞群,根据其形态、功能和来源部位可以分为三大类:粒细胞、单核细胞和淋巴细胞,不同种类的白细胞以不同的方式参与机体的防御反应[23]。由表4可以看出,实验组大鼠白细胞数量随着免疫时间的增加而增加,而对照组略微降低;在第28天呈现出显著性差异,第42天激发后显示出极显著差异,这表明BN大鼠在免疫期间一直处于过敏状态。中性粒细胞在第14天呈现出极显著差异,淋巴细胞与嗜酸性粒细胞变化不大,且嗜酸性细胞稍有所降低,其原因有待深入探究;从总体趋势看,实验组中性粒细胞、淋巴细胞、嗜酸性粒细胞数量升高。研究表明,嗜酸性粒细胞在过敏反应的调节中起重要作用,当肥大细胞或者嗜碱性粒细胞的表面IgE与相应的抗原结合诱发过敏反应时,会产生ECF-A吸引嗜酸性粒细胞聚集,并释放组胺酶分解组胺,释放芳基硫酸酯酶分解白三烯,消除过度炎症反应[24]。这些血象指标的明显变化也进一步证明了实验组BN大鼠对Crag1蛋白产生了过敏反应。
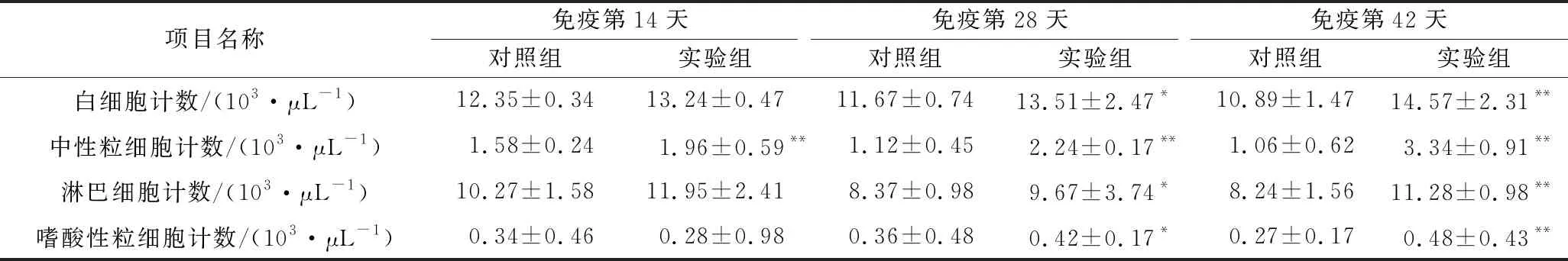
表4 BN大鼠白象指标变化Table 2 Changes in bliood index of BN rats
2.4 血清中总IgE、特异性IgE、特异性IgG的含量变化
2.4.1 BN大鼠血清中总IgE的含量
IgE在I型过敏反应中起着及其重要的作用,其与效应细胞上的IgE高亲和力受体(FcεR I)结合,从而触发细胞内一系列信号转导,使肥大细胞发生脱颗粒并释放大量炎性介质是过敏性疾病的重要发病机制[25]。如图4所示,随着致敏时间的增加,实验组大鼠体内总IgE含量也不断升高,对照组稍有波动但始终维持在10 μg/mL左右。第7天实验组和对照组的总IgE含量呈现出显出性差异,到第42天实验组总IgE含量达到44 μg/mL,接近于对照组的3倍。另外,实验组第42天与第7天相比有极显著性差异。免疫期间实验组总IgE含量不断升高,对照组基本不变,可以推断实验组BN大鼠产生了严重的过敏反应。
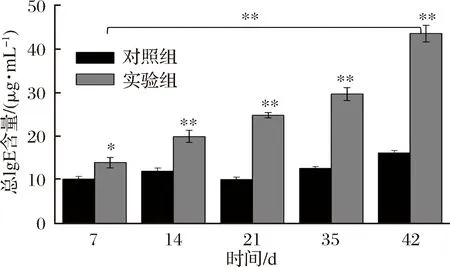
图4 BN大鼠血清总IgE含量Fig.4 Total serum IgE content in BN rats注:*表示不同组间差异显著(P<0.05);**表示不同组间差异极显著(P<0.01)。下同。
2.4.2 血清中特异性IgE(sIgE)水平测定
不同时期BN大鼠血清的特异性IgE水平变化如图5-A所示,血清特异性IgE抗体的测定,可以明确过敏反应是由哪种致敏原引起的。从第14天到第42天,实验组特异性IgE抗体水平呈增加趋势,且明显高于对照组。在激发实验后,实验组特异性IgE达到对照组的2.5倍,与第14天实验组特异性IgE水平相比也有极显著性差异。由此可见,BN大鼠的过敏反应是由牡蛎Crag1蛋白引起的。
第42天激发后12只实验组大鼠血清的特异性IgE水平结果,如图5-B所示。12只实验组BN大鼠均呈现出较高的特异性IgE水平,与对照组有显著性差异,再次从血清方面证实了所有实验组大鼠均出现了过敏反应,过敏原为牡蛎Crag1蛋白。图5-C显示了对牡蛎过敏的人血清与BN大鼠过敏血清的特异性IgE水平比较,人、鼠的过敏血清与对照组相比均有极显著性差异,成功获得其种属特异性Crag1致敏血清。
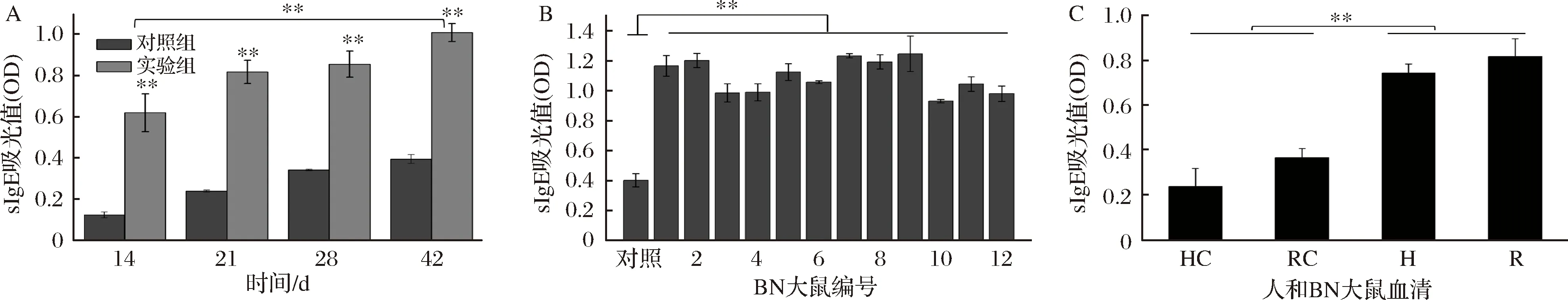
A-BN大鼠特异性IgE变化情况;B-第42天激发后特异性IgE;C-人和BN大鼠的特异性IgE比较; HC-正常人血清;RC-对照组BN大鼠血清图5 BN大鼠的IgE变化Fig.5 IgE changes in BN rats
2.4.3 血清中特异性IgG(sIgG)的变化
由图6可以看出,致敏期间BN大鼠的特异性IgG的变化情况,实验组随着致敏时间增加而增加。动物体内的sIgG、sIgE、总IgE往往与致敏原敏感性密切相关,血清sIgG的出现也表明发生过敏反应[26]。然而对照组sIgG水平低于实验组,在第14天和第42天呈显著性差异,但其也有升高趋势,具体原因有待进一步探究。
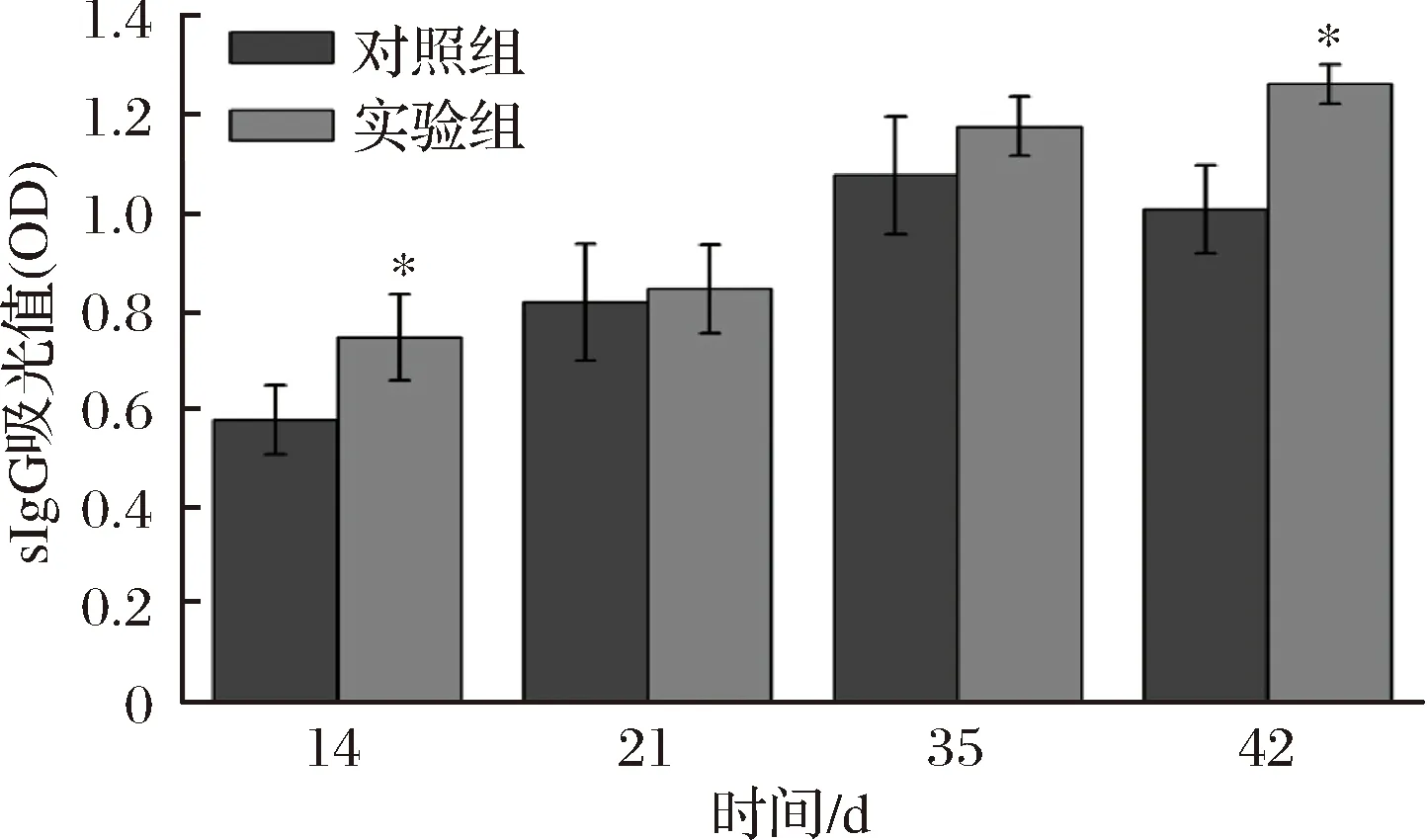
图6 BN大鼠特异性IgG变化Fig.6 BN rat-specific IgG changes
2.5 血浆中的组胺含量
组胺含量的测定结果如表5所示,实验组明显高于对照组,且随着致敏周期不断增加,第35天达到约48 ng/mL,比对照组高60%。组胺也是过敏反应中一个重要的检测指标,组胺由组氨酸脱羧基而成,组织中的组胺是以无活性的结合型存在于肥大细胞和嗜碱性粒细胞的颗粒中,当机体受到过敏原刺激时会引起这些细胞脱颗粒,并释放出组胺等物质,与组胺受体作用产生病理生理效应[27]。

表5 BN大鼠血浆中组胺的含量 单位:ng/mL
2.6 HE染色和甲苯胺蓝染色结果
肠道、肝脏、肾脏的HE染色如图7所示。由图7-A1可以看出,模型组小肠绒毛上皮脱落、紊乱,固有层水肿、小血管充血、大量炎症细胞浸润,对照组(7-A2)小肠上皮完好,未见明显炎症症状。实验组(7-B1)肝中央静脉及肝窦均显著扩张充盈血液,部分肝细胞索断裂,萎缩,血液融合,形成淤血带,出现轻度的炎性细胞浸润;对照组肝脏(图7-B2)基本无异常。SCUDAMORE等[28]研究表明,鼠经口致敏模拟食物过敏中,其空腔发生超敏反应。炎症反应导致肠道通透性增加,小肠受损,不能被降解的大分子蛋白类过敏原通过门静脉进入肝脏,因而引起肝脏中的免疫反应,最终导致肝组织损伤。另外由图7-C1可以看出,实验组肾小球分叶明显,并伴有少量嗜中性粒细胞及其他炎性细胞浸润,肾小球血管扩张充血;对照组(图7-C2)的肾小球结构清晰,肾小管管腔结构清楚,分泌物少。可能是由于过敏反应产生大量的嗜酸细胞,进入肾脏组织,造成模型组BN大鼠的肾脏损害。
由图7-D1可以看出模型组的肠固有层肥大细胞聚集增多,脱颗粒肥大细胞胞膜破裂,边界不规则,呈弥散状,对照组的大鼠肠道(图7-D2)固有层肥大细胞少,胞膜完整.轮廓清晰,大部分不脱颗粒。肥大细胞是目前公认的免疫细胞,是速发型过敏反应的主要效应细胞。其表面存在于IgE结合的受体FcεR I,当机体初次接触过敏原时,其B细胞产生的IgE的Fc片段会与肥大细胞表面的FcεR I受体结合;当再次接触过敏原时,IgE的Fab片段会与抗原相结合,促使肥大细胞产生脱颗粒状态,从而分泌组胺、白介素等细胞因子,从而引发一系列的过敏反应[29-31]。因此肥大细胞的数量及脱颗粒情况能够良好地反映组织过敏情况。由此可以推断实验组BN大鼠肠道发生了较严重的过敏反应。
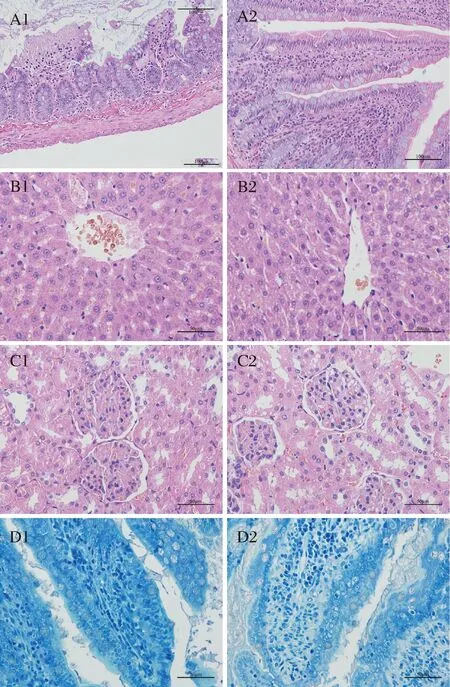
A1-模型组空肠HE染色;A2-对照组空肠HE染色;B1-模型组肝脏HE染色; B2-对照组肝脏HE染色性;C1-模型组肾脏HE染色;C2-对照组肾脏HE染色;D1-模型组空肠甲苯胺蓝染色;D2-对照组空肠甲苯胺蓝染色。图7 器官HE与甲苯胺蓝染色结果Fig.7 results of organ HE and toluidine blue staining
3 结论
随着全球对海产品消费量的增加,牡蛎过敏现象日益普遍。研究表明,牡蛎主要过敏原Crag1蛋白(原肌球蛋白)的氨基酸序列在多类动物中具有很高的同源性,高同源性使易发生交叉反应。动物模型是检测过敏原最直接可行的方式,本实验利用重组的Crag1蛋白通过经口灌胃与腹腔注射相结合的方式进行免疫BN大鼠,有效避免了经口致敏方式可能导致的免疫耐受问题。针对Crag1蛋白建立BN大鼠致敏模型为研究食物过敏原致敏机制及其体内免疫调节提供较好的工具,也为临床上预防及治疗食物过敏提供了重要的理论依据。
本实验从BN大鼠的表型过敏级数以及体重、体温等方面反映了实验组大鼠发生了过敏反应;此外,可能是由于过敏反应使脏器受损,从而体重低于对照组,脏器指数明显高于对照组;实验组白细胞、中性粒细胞、淋巴细胞以及嗜酸性粒细胞数量均出现升高现象;另外,致敏期间实验组抗体水平(总IgE、sIgE、sIgG)以及组胺释放量也出现升高现象;染色结果表明实验组脏器出现病变损伤,肠道肥大细胞脱颗粒现象严重。Th2型淋巴细胞水平及其释放相关细胞因子的水平以及相关通路也将在下一步细胞实验中深入探究。本实验成功建立并分析了牡蛎Crag1蛋白大鼠致敏模型,获得了Crag1动物致敏血清,为下一步细胞致敏模型的建立和基因重组所构建的低敏性牡蛎突变Crag1的过敏原性评价提供基础。
