黄病毒E蛋白N-糖基化研究进展
2019-10-10潘昱婷贾仁勇
潘昱婷,贾仁勇,3*
(1.四川农业大学禽病防治研究中心,四川成都611130;2.四川农业大学预防兽医研究所,四川成都611130;3.动物疫病与人类健康四川省重点实验室,四川成都611130)
糖基化是蛋白质一种重要的翻译后修饰调控机制。在真核细胞中,糖基化的合成主要包括:N糖基化、O 糖基化及糖基磷脂酰肌醇锚3 种途径。新生肽链合成时或合成后,糖链与肽链中特定序列(Asn-X-Thr/Ser,其中X 为除脯氨酸外的任意氨基酸)的天冬酰胺(N)相连接,所以将该糖基化类型称为N 连接糖链,又称N糖基化[1]。在真核细胞中,N糖基化的合成在内质网和高尔基体中完成,糖蛋白中N 连接聚糖在内质网中将预先生成的寡糖转运至新生肽链的天冬酰胺残基中,再将其转移至高尔基体内进一步修饰,并在高尔基体糖苷酶和糖基转移酶的作用下,生成3 种类型的N 连接糖链:高甘露糖型(High mannose type)、杂合型(Hybrid type)及复合型(Complex type)(图1)。
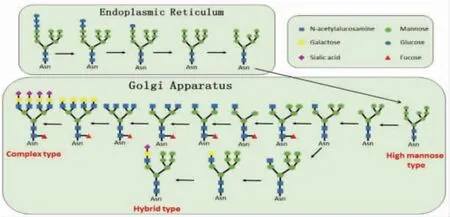
图1 N- 糖基化的合成途径
黄病毒(Flavivirus)是主要由节肢动物传播的一类单股正链RNA 病毒[1],其基因组编码3 种结构蛋白:衣壳蛋白(Capsid protein,C)、膜蛋白前体/ 膜蛋白(Precursor membrane/Membrane protein,prM/M)和包膜蛋白(Envelope protein,E),其中包膜蛋白(即E蛋白)是病毒侵染过程中的关键蛋白,它能够被细胞表面受体识别,介导病毒的吸附与侵入,并参与病毒同质膜的融合[2]。黄病毒E蛋白大多数属于糖蛋白,含一个或多个潜在的N糖基化位点,位点的数量和位置也存在差异,如蜱传脑炎病毒(Tick-borne encephalitis virus, TBEV)[3]、 登革热病毒(Dengue virus,DENV)[4]、西尼罗河病毒(West Nile virus,WNV)[5]、日本脑炎病毒(Japanese encephalitis virus,JEV)[6]、寨卡病毒(Zika virus,ZIKV)[7]和坦布苏病毒(Tembusu virus,TMUV)[8]等,在E蛋白aa153~aa156 位残基处存在潜在的N糖基。
1 黄病毒E蛋白N糖基化的功能
E蛋白是黄病毒生命周期中的重要物质,其N糖基化在病毒复制、增殖、释放等过程中发挥重要作用(表1)。
1.1 E蛋白N糖基化影响黄病毒的复制 E蛋白N糖基化对黄病毒在哺乳动物和蚊子细胞系中进行有效复制是非常必要的。研究表明DENV (16681 株)E蛋白aa67 处N糖基化位点缺失后严重影响病毒复制,使其无法产生新的感染性病毒,并严重影响其在哺乳动物细胞中的增殖;而aa153 处N糖基化位点缺陷的突变病毒仍然可以在哺乳动物细胞中复制,表明DENV E蛋白aa153 处N糖基化位点对病毒复制是非必需的,而aa67 处N糖基化位点对DENV 在哺乳动物细胞中的复制和增殖是必需的[10]。当WNV E蛋白N糖基化缺失后,病毒组装能力变弱,蛋白折叠效率显著降低,表明N糖基化在促进病毒蛋白折叠中发挥重要作用[17]。Zai 等将JEV (P3 株)E蛋白N糖基化的突变株与野生型病毒相比较,结果显示JEV E蛋白N糖基化的缺失同样降低了E蛋白的折叠效率[14]。
此外,研究者发现抑制E蛋白N糖基化的形成还将导致E蛋白分泌量显著降低,这意味着E蛋白N糖基化严重影响黄病毒感染细胞后的释放量[18]。在研究WNV E蛋白N糖基化时发现,其N糖基化有利于E蛋白更快速分泌[17]。Goto 等比较分析了TBEV (Oshima5 株,GenBank登录号:AB062003)E蛋白在N糖基化缺失和未缺失的情况下导致E蛋白分泌水平、生物学特性等的变化,结果显示,在E蛋白N糖基化缺陷的突变株中,E蛋白的分泌量降低至野生型病毒E蛋白分泌量的10 %,且当E蛋白aa66 和aa153 处均具有N糖基化位点时,其分泌的E蛋白水平比野生型病毒分泌的蛋白水平高出4 倍[9]。对ZIKV 的研究也发现,E蛋白N糖基化对E蛋白的分泌也有相似影响,Mossenta 等揭示了ZIKV (MR766 株,Gen-Bank 登录号:AEN75266.1)E蛋白N糖基化的缺失导致ZIKV E蛋白的分泌受损,推测缺失N糖基化的修饰致使E蛋白折叠受损进而影响该蛋白的分泌[15]。这些数据均充分表明N糖基化在黄病毒E蛋白分泌过程中发挥着重要作用。

表1 黄病毒E蛋白N糖基化位点Table 1 N-glycosylation of the E protein in flaviviruses
1.2 E蛋白N糖基化影响黄病毒的感染性 黄病毒E蛋白N糖基化与病毒的感染性也密切相关,其中DENV 较为典型。DENV E蛋白中具有两个潜在的N糖基化位点,Mondotte 等发现DENV E蛋白中的两处N糖基化功能有所差异,将E蛋白aa153 处N糖基化位点敲除后,DENV的感染性明显降低;而敲除E蛋白aa67 处的N糖基化位点后,DENV 仍然可以感染哺乳动物细胞并进行复制和翻译,但没有产生新的感染性病毒颗粒,结果显示该病毒E蛋白aa153 处N糖基化修饰与病毒的感染性密切相关[19]。而TBEV (Oshima5 株)E蛋白N糖基化的缺陷则可以影响病毒粒子的折叠及其稳定性,尽管E蛋白的总体水平保持不变,但由于E蛋白缺乏N糖基化修饰,导致病毒颗粒的感染性降低[20]。类似现象在ZIKV 中也存在,即E蛋白N糖基化缺失后使ZIKV 对哺乳动物细胞的感染性降低[15]。与此相反,Hanna 等在研究WNV 时得出了与之不同的结果,他们将哺乳动物、禽类和蚊子细胞分别感染Ⅰ型、Ⅱ型WNV 和敲除了E蛋白N糖基化位点的Ⅱ型WNV,结果显示E蛋白N糖基化的敲除增强了病毒的感染性,且该现象在蚊子细胞中尤为显著[17],不同黄病毒E蛋白N糖基化功能试验结果存在差异。因此,E蛋白N糖基化对病毒感染力的作用机制有待进一步深入探究。
1.3 E蛋白N糖基化影响黄病毒的毒力 E蛋白作为黄病毒的主要抗原,与病毒的致病性密切相关。研究表明,WNV E蛋白N糖基化对病毒的致病性和病毒对小鼠的神经侵袭力均具有重要作用[12]。据报道,近期欧洲与北美洲暴发的WNV 病是由毒力较强的病毒所致,而一些早期流行的WNV 分离株则毒力较低。随后有研究显示引起近期大规模疾病暴发的WNV (PaH651 株,GenBank 登录号:AF001560;Heg101 株,GenBank 登录号:AF001568)在其E蛋白中均具有N糖基化位点,而早期毒力较低的流行WNV 分离株(ArD78016 株,GenBank 登录号:AF001556;EntM63134 株,GenBank 登录号:AF001573)E蛋白中则无N糖基化位点[13]。Beasley 等将WNV 强毒株与弱毒株进行比较,分析其E蛋白中氨基酸序列,显示强毒株E蛋白氨基酸序列中具有导致N糖基化基序丧失的差异氨基酸,为了确定增强WNV 神经侵袭力的分子决定簇,采取定点敲除了WNV (NY99 株,GenBank 登录号:AF196835)的N糖基化位点后,发现该突变病毒株神经侵袭力衰减到与弱毒野生型病毒相当的水平,从而证实了E蛋白N糖基化具有影响WNV 毒力的能力,该结论同Khaled 等试验结果一致[21]。此外,也有研究显示TBEV (16681 株)E蛋白中N糖基化的缺失,可以降低病毒在猿猴与蚊子细胞中的病毒滴度,并且观察到病毒缺失株对小鼠的神经毒力也显著降低[10]。
1.4 E蛋白N糖基化是影响DC-SIGN 与病毒互作的关键部位 树突状细胞- 特异性细胞间黏附分子-3 捕获非整合素(Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integri,DC-SIGN)为钙依赖性C 型凝集素家族的成员,在病毒与树突状细胞相互作用之间起着重要作用[22]。该凝集素DC-SIGN 受体对不同病原体中的N糖基化均具有亲和力,也是DENV 和WNV 的主要细胞受体[23]。研究显示:DC-SIGN 与DENV 之间的相互作用发生在E蛋白的N糖基化处[24],Navarro 等证实了DENV 可以通过E蛋白N糖基化与DC-SIGN 相互作用影响病毒的感染性,在E蛋白aa67 和aa153 残基处具有N糖基化位点的DENV 比仅在E蛋白aa67 处含N糖基化位点的DNEV 能够更加有效地与DC-SIGN 相互作用[11]。研究ZIKV 结果发现,E蛋白N糖基化可以通过与DC-SIGN 结合抑制下游免疫信号传导途径从而加速ZIKV 对机体的侵袭[25]。
2 黄病毒N糖基化的应用
E蛋白N糖基化不但可以维持抗原构象,屏蔽潜在的中和表位,而且还与病毒的感染性及毒力紧密相关,因此,可以利用N糖基化修饰研发新型黄病毒疫苗。Roby等制备了针对E蛋白aa154 处缺失N糖基化的昆津病毒(KUNV)疫苗,得到了较为理想的结果[26]。有学者构建了含野生型JEVprME基因和突变型JEVprME基因的核酸疫苗,结果显示:采用prME蛋白aa154 处N糖基化缺失的核酸疫苗免疫的小鼠能够完全抵抗JEV 的攻击,佐证了prME蛋白aa154 处N糖基化位点的缺失显著增强了该核酸疫苗的免疫原性,随后开展了该核酸疫苗对猪的免疫保护性的深入探究[27]。也有学者使用反向疫苗学方法,从黄病毒基因组中筛选出具有N糖基化的抗原基因作为候选疫苗,对该抗原基因进行高通量克隆、蛋白表达,再对纯化后的抗原进行体内外评价以期获得能够抵抗病毒的疫苗[28]。这些研究均表明了黄病毒E蛋白N糖基化对黄病毒新型疫苗的研发有着重要作用,但具体如何应用N糖基化对E蛋白的影响来研制相关疫苗尚待探究。
有研究显示在DENV 严重感染时,使用α- 糖苷酶类药物可以抑制DENV 的复制,从而减少患者体内的病毒载量,达到控制病情及防止病情恶化的作用,其机制主要是通过药物抑制机体糖基化酶,从而抑制病毒蛋白糖基化,进而抑制病毒的复制[29]。葡萄糖苷酶抑制剂也可以用于抗病毒,该抑制剂可以阻碍病毒蛋白质的糖基化过程,并降低病毒与CD4+T 细胞的结合能力,在抗病毒药物研发方面有着广泛的前景[30]。有研究指出具有N糖基化的DENV 感染可以被某些碳水化合物结合剂(Carbohydratebinding agents,CBAs)有效阻断,该CBAs 可以通过与DENV E蛋白N糖基化的结合,阻碍DC-SIGN 介导的病毒向T 淋巴细胞传播而直接抑制病毒感染,起到抗病毒效果[31]。更有通过针对抗体药物N糖基化结构进行糖工程改造制备糖链优化的抗体药物,该药物可以进一步提高抗体药物疗效,并优化药物稳定性,这是单克隆抗体药物的研发新思路。
3 展 望
近年来关于黄病毒E蛋白N糖基化对病毒生命周期影响的研究越来越多,黄病毒依赖E蛋白N糖基化实现病毒侵入宿主细胞、病毒复制和病毒释放等功能,还与病毒毒力、感染性密切相关。虽然已经对黄病毒E蛋白N糖基化进行了大量的探究,其理论已被逐步应用于抗病毒新型疫苗及相关药物的研发,但黄病毒E蛋白N糖基化的功能及其作用机制尚不十分清晰,药物研发与应用尚需深入研究。
