热应激条件下猪肠道糖皮质激素受体的表达变化
2019-10-10雍艳红于天月李俊玉吴莲云胡灿颖巨向红
雍艳红,于天月,张 骞,李俊玉,方 彪,吴莲云,胡灿颖,巨向红*
(1.广东海洋大学深圳研究院,广东深圳518108;2.广东海洋大学动物医学系,广东湛江524088;3.广东海洋大学动物科学系,广东湛江524088)
热应激可致猪采食量下降、肠绒毛变短、隐窝变浅、粘膜损伤和腹泻[1],出现典型的炎性肠病(IBD)特征。随后的研究显示,热应激猪肠道细胞氧化应激水平增高,细胞凋亡大量出现,肠道黏膜完整性损伤明显[2]。但这些病变发生的分子机理尚不清楚,阻碍了防控措施的进一步实施。
糖皮质激素受体(Glucocorticoid receptor,GR)主要存在于细胞浆中,在不与糖皮质激素(GC)结合时,能够与两分子的热休克蛋白90 (Heat shock protein 90,HSP90)结合形成复合体,此时GR 的DNA结合区被HSP90 覆盖,不能发挥生理作用[3]。前期发现,热应激上调猪血浆GC 的表达,但肠道炎症过程依然增强,推测热应激可能调节了肠道GR 的表达而影响了GC 的抗炎效应。本研究检测了热应激猪肠道GR 的分布及表达水平,为进一步阐述热应激诱发猪炎性肠病的分子机理奠定基础。
1 材料与方法
1.1 实验动物及实验样品采集 48 头2 月龄健康土杂猪(杜洛克♂×雷州黑猪♀)购自湛江某猪场,平均体重15±2 kg。购买后于环境温度20±3 ℃、相对湿度70 %~80 %的动物房适应14 d。全价饲料饲喂,每日早、中、晚各1 次,自由饮水。受试动物随机分为2 组(实验组与对照组),每组24 头。对照组常规饲养,热应激组饲养于环境温度为35±1 ℃的人工气候温室。分别在实验开始后的第1 d、7 d、14 d 和21 d 颈动脉放血迫杀受试动物,采集其十二指肠、盲肠和结肠组织,PBS 漂洗3 次,液氮冻存后转-80 ℃保存,用于总蛋白提取。取结肠、十二指肠和盲肠组织,10 %的福尔马林溶液固定待用。
1.2 主要试剂 GR (L224)多克隆抗体购自南京巴傲得生物科技有限公司;羊抗兔HRP-IgG、小鼠抗人β-actin 多克隆抗体和抗体稀释液购自上海碧云天生物技术有限公司;蛋白酶抑制剂、RIPA 细胞裂解液、BCA 微量蛋白定量试剂盒、SDS-PAGE 凝胶试剂盒、ECL 化学发光液均购自康为世纪生物科技有限公司。
1.3 免疫组织化学染色检测GR 分布特征 取福尔马林固定的肠道组织,常规方法制作石蜡切片。柠檬酸缓冲液修复抗原,PBS 冲洗3 次,免疫染色强力通透液作用5 min,3 %过氧化氢避光孵育10 min,PBS 漂洗3 次,1 %牛血清封闭60 min,加入Anti-GR (L224)多克降抗体(1∶250)于4 ℃过夜孵育,TBS漂洗3 次,加入羊抗兔HRP-IgG (1∶2 000)于37 ℃孵育30 min,DAB 显色5 min~10 min,苏木精复染1 min,1 %盐酸酒精分化1 s~2 s,流水冲洗,封片,显微镜下观察GR 的分布。
1.4 Western blot 检测GR 表达量 称取50 mg 肠道组织经裂解法提取组织全蛋白,利用BCA 检测试剂盒检测蛋白浓度,调整蛋白浓度后与5×Loading buffer 以1:4 比例混匀,100 ℃变性5 min 后,经SDS-PAGE 电泳检测。以小鼠抗人β-actin 多克隆抗体(1∶1 000)、Anti-GR (L224)多克隆抗体(1∶250)为一抗,羊抗兔HRP-IgG 为二抗(1∶2 000),进行western blot 检测。采用Image J 软件分析灰度值,计算目标蛋白相对表达量,用独立样本T 检验进行差异显著性分析。
2 结果与讨论
2.1 GR 分布特征的免疫组织化学染色检测结果双盲法对GR 在各肠段的表达进行判定。结果显示,热应激第1 d,实验组猪盲肠粘膜层GR 的表达量显著降低;热应激第14 d,在实验组猪盲肠和结肠的粘膜层中GR 的表达量较对照组升高;实验组猪十二指肠的GR 表达量在热应激的第7 d 和14 d 的表达显著升高(表1、图1)。
GR 是转录因子核受体超家族的成员[4-5],对GC的生理功能起负调节作用[6]。Raddatz 等检测了溃疡性结肠炎和克罗恩病患者肠道GR 的分布,发现其主要分布于结肠的隐窝、上皮细胞和免疫细胞中[7]。马伟慧等人研究了全氟辛酸(PFOA)对哮喘小鼠气道炎症、外周血炎症介质IL-4、IFN-γ 以及肺组织GR表达的影响,发现GR 蛋白表达在支气管上皮细胞、气道平滑肌细胞及血管平滑肌细胞胞浆内较多[8]。本研究检测了热应激条件下猪肠道GR 的分布与表达情况,表明GR 主要表达于肠道组织的粘膜层,这可能由于黏膜层与肠腔中的食糜和微生物等抗原物质距离较近,从而参与了肠道稳态维持过程有关。
2.2 GR 表达量的western blot 检测结果 Western blot 结果显示,与对照组相比实验组猪十二指肠的GR 表达量显著上调(p<0.05),且在热应激第14 d 达峰值。与对照组相比,实验组猪结肠的GR 表达量也显著上调(p<0.05),第14 d 达峰值,实验组猪盲肠的GR 表达量显著降低(p<0.05)(图2)。
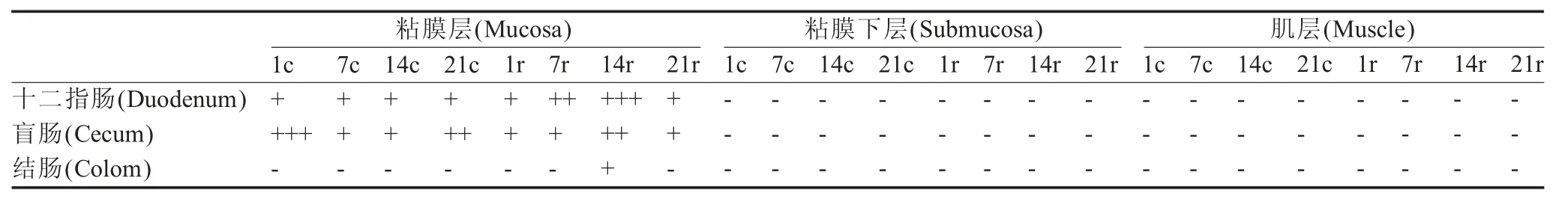
表1 热应激猪肠道GR 的分布特征Table 1 Characteristic of GR distribution in intestinal gut of heat stressed pigs

图1 热应激猪肠道粘膜层GR 的免疫组织化学染色结果(200x)Fig.1 The results of immunohistochemical staining for intestinal gut of heat stressed pigs in mucous layer (200x)
据报道,在热应激条件下HSP90 mRNA 表达量增加,同时鸡外周血淋巴细胞中GR mRNA 的表达量也出现增加趋势,由此推测GR 可能参与了热应激的调节过程。赵红波等研究发现,热应激下鸡GC 表达量升高,而GC 表达量过高会破坏淋巴细胞,为抵御淋巴细胞的过度破坏,机体下调了GR表达量,但作者均没有检测GR 蛋白的表达水平[9]。另外,在炎热气候条件下母猪妊娠后期GRα mRNA优先在肺脏和脾脏中表达,其次是肝脏和肾脏,在脑、卵巢和心脏中的表达量最低。也有学者认为GR 几乎在所有细胞内均有表达,但在不同组织或不同细胞内的亚型有差异[10]。在本研究中,热应激第1 d、7 d 和14 d,十二指肠和结肠中GR 表达量明显升高,且在第14 d 达峰值。推测随着热应激的进程,肠道微生物群落的结构发生变化,有益菌数量下降,而致病菌数量增多,肠道粘膜的炎症过程增强,导致了GR 表达量上调。
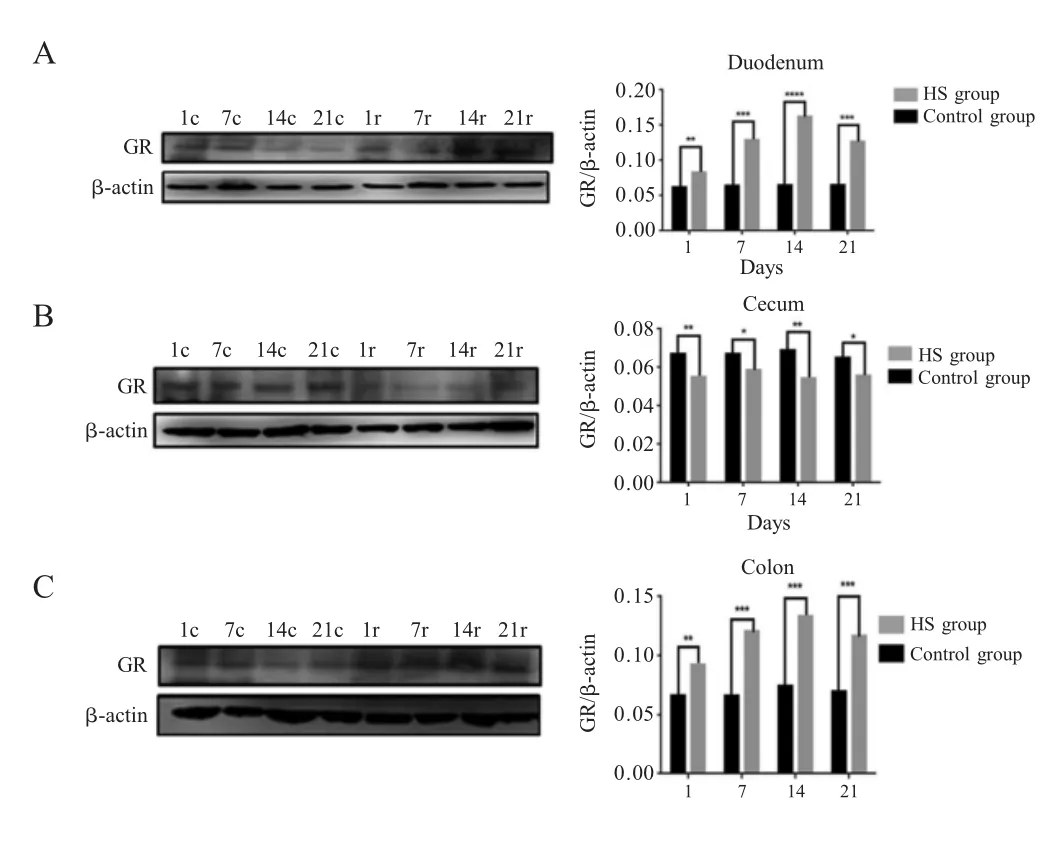
图2 受试猪不同肠段中GR 蛋白表达水平Fig.2 Expression level of GR protein in different intestinal gut of pigs
