锌对邻苯二甲酸酯类暴露致雄性生殖毒性的干预作用
2019-10-10孙悦杨柳史弘毅李安琪戴绮梦金思伊高海涛
孙悦,杨柳,史弘毅,李安琪,戴绮梦,金思伊,高海涛
(温州医科大学 公共卫生与管理学院预防医学系,浙江 温州 325035)
邻苯二甲酸酯类(phthalates,PEs)是环境雌激素,其作为塑化剂应用于塑料制品,在生活中广泛存在。根据国标GB9685-2016,某些PEs在食品接触塑料材料中的最大使用量高达43%[1]。PEs易从塑料中逸出,使人暴露其中。据报道,我国人群总PEs暴露水平为23~159 μg·kg-1·d-1,可能处在风险中[2]。研究表明,PEs暴露可致动物生殖功能损伤[3],与男性生殖功能障碍相关[4]。PEs暴露具有多种类、长期、低剂量的特点。前期研究发现,PEs混合物(MIXPs)长期低剂量暴露可致大鼠雄性生殖功能损伤[5-6]。锌与生殖功能和精子生成密切相关,锌缺乏可致雄性生殖功能损伤[7-8];而锌干预可抑制氟、铝暴露所致的雄性生殖毒性[9-10],提示锌可能对PEs暴露诱导的雄性生殖功能损伤有保护作用。本研究模拟人群PEs暴露的实际特点,探讨了锌对MIXPs暴露诱导小鼠雄性生殖毒性的干预作用。
1 材料和方法
1.1 试剂与仪器 邻苯二甲酸丁苄酯(BBP)、邻苯二甲酸正二丁酯(DBP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)和分析纯均购于上海阿拉丁公司;ZnSO4·7H2O购于北京国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒、总超氧化物歧化酶(SOD)活性、总抗氧化能力(T-AOC)、丙二醛(MDA)试剂盒均购于上海碧云天生物技术有限公司;小鼠睾酮(T)试剂盒购于南京建成生物工程研究所。EnSpire酶标仪为德国珀金埃尔默公司产品,ECLIPSE Ti-E倒置显微镜为日本尼康公司产品,IKA T10高速分散器为德国IKA公司产品,Centrifuge 5417R离心机为德国Sigma公司产品。
1.2 实验方法 MIXPs为3 种PEs的等毒性混合物,根据其每日可耐受摄入量(TDI)值[2],按BBP:DBP:DEHP=10:5:1 的质量比等毒性混合。以0.5%羧甲基纤维素钠(CMC-Na)溶液为赋形剂,配制MIXPs悬浊液。36 只雄性ICR小鼠购于上海斯莱克实验动物有限责任公司动物许可证号:SCXK(沪)2017-0005,1 月龄,SPF级屏障系统中经过1 周适应环境后,按体质量随机分为3组,每组12只。MIXPs组小鼠经口灌胃MIXPs 160 mg·kg-1·d-1;MIXPs+ZnSO4组经口灌胃MIXPs 160 mg·kg-1·d-1,同时经口给予ZnSO450 mg·kg-1·d-1;对照组每天经口灌胃等容量0.5% CMC-Na;连续干预90 d,记录动物的精神状态。干预处理结束后,禁食8 h,麻醉后眶静脉取血,3 000 r/min离心10 min,取上清液,超低温保存备用。引颈处死小鼠,测量体长和肛殖距,解剖,取睾丸、睾丸脂肪、精囊、附睾,称质量。取适量脏器组织,液氮冷冻后,移至-80 ℃冻存,备用。
1.3 精子畸形率检测 根据文献[11],取小鼠两侧附睾,37 ℃水浴条件下加入1 mL PBS并剪碎,制成精子悬液,取0.5 mL精子悬液加入1.5 mL PBS,四层擦镜纸滤除组织碎片,滤液以1 000 r/min离心5 min。吸去上清液,剩余少量液体与沉淀摇匀后,制片,干燥,甲醇固定5 min,晾干,2%伊红水溶液染色1 h,蒸馏水淋洗。晾干,200倍显微镜下观察精子形态,记录畸形数,计算精子畸形率。
1.4 脏器组织匀浆液制备 取超低温冻存的睾丸组织0.1 g,按1:10加入预冷的0.9%氯化钠溶液,剪碎,冰水浴中匀浆,4 ℃ 12 000 r/min离心10 min,取上清液,储存于冰水混合物中,备用。BCA蛋白测定试剂盒测定其中的蛋白质水平。
1.5 睾酮及睾丸组织抗氧化水平检测 取上述血清和睾丸组织上清液适量,按照小鼠睾酮ELISA试剂盒使用说明检测血清和睾丸组织中的睾酮水平。按照SOD、MDA、T-AOC试剂盒的使用说明测定睾丸组织中SOD、MDA、T-AOC水平。
1.6 统计学处理方法 采用SPSS17.0软件进行统计学分析。计量资料用表示,多组间比较用单因素方差分析,两两比较用LSD-t法,计数资料用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组小鼠一般情况比较 对照组小鼠精神状态良好,皮毛油亮顺滑,较活跃;MIXPs组精神稍萎靡,部分小鼠生殖器周围毛色泛黄,皮毛粗糙;MIXPs+ZnSO4组小鼠精神状态相对较好,个别小鼠生殖器周围毛色泛黄,皮毛略有粗糙。3组小鼠体质量在实验期间均呈增长趋势;解剖时MIXPs组小鼠体质量较对照组明显降低,而MIXPs+ZnSO4组较MIXPs组显著升高(均P<0.05)。与对照组比,MIXPs组体长和肛殖距显著降低(P<0.05);而与对照组比,MIXPs+ZnSO4组体长并无显著改变,差异无统计学意义(均P>0.05);与MIXPs组比,MIXPs+ZnSO4组肛殖距显著增长(P<0.05)。见图1。
2.2 3 组小鼠雄性器官质量比较 与对照组比,MIXPs组小鼠睾丸周围脂肪组织质量明显下降(均P<0.05);而与对照组比,MIXPs+ZnSO4组睾丸、睾丸周围脂肪、附睾、精囊质量差异无统计学意义(均P>0.05);与MIXPs组比,MIXPs+ZnSO4组睾丸周围脂肪量显著增加(P<0.05)。见图2。
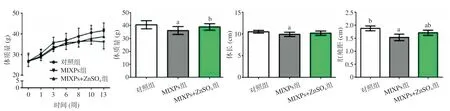
图1 3组小鼠体质量增长曲线以及解剖时的体质量、体长、肛殖距比较

图2 3组小鼠的睾丸、睾丸周围脂肪组织、附睾、精囊质量比较
2.3 3组小鼠精子畸形率和形态比较 精子畸形率:对照组为10.42%,MIXPs组为52.25%,MIXPs+ZnSO4组为18.59%。与对照组比,MIXPs组小鼠精子畸形率显著升高(P<0.01);与MIXPs组比,MIXPs+ZnSO4组精子畸形率显著降低(P<0.01);而与对照组比,MIXPs+ZnSO4组差异无统计学意义(P>0.05)。对照组小鼠精子形态正常,精子头部有钩,尾部健壮,见图3A;MIXPs组精子形态表现为自身折叠、断尾、尾部瘦弱等,见图3B;MIXPs+ZnSO4组精子形态几乎与正常无差别,见图3C。
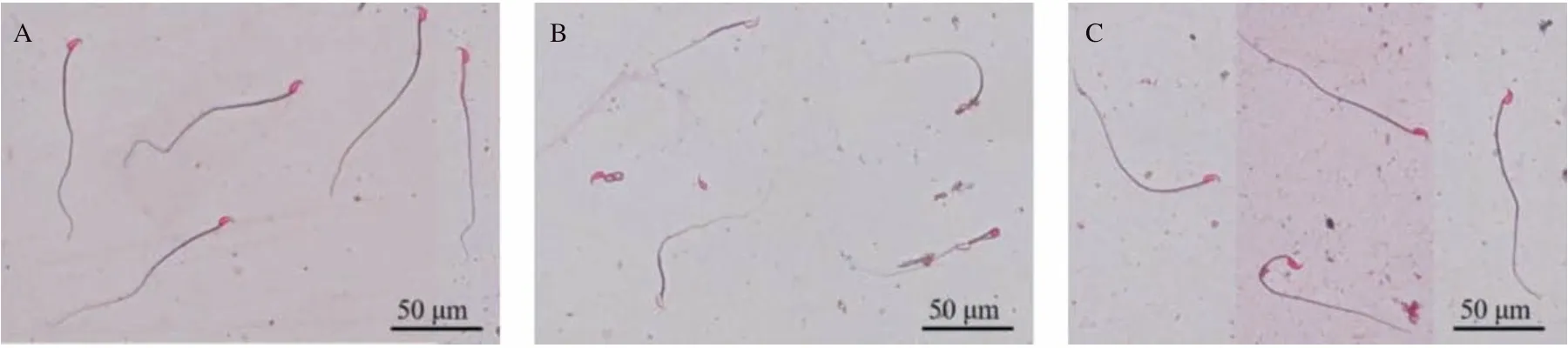
图3 3组小鼠精子形态比较(伊红Y染色)
2.4 3组小鼠血清和睾丸组织睾酮水平比较 与对照组比,MIXPs组血清睾酮水平显著降低(P<0.05);与对照组比,MIXPs+ZnSO4组差异无统计学意义(P>0.05),但显著高于MIXPs组(P<0.05)。3组间睾丸组织睾酮水平差异均无统计学意义(P>0.05)。见图4。
2.5 3组睾丸组织抗氧化指标检测比较 与对照组比,MIXPs组睾丸组织SOD水平显著降低(P<0.01);与对照组比,MIXPs+ZnSO4组差异无统计学意义(P>0.05);与MIXPs组比,MIXPs+ZnSO4组显著升高(P<0.01)。与对照组比,MIXPs组睾丸组织MDA水平显著降低(P<0.05);与对照组比,MIXPs+ZnSO4组差异无统计学意义(P>0.05);与MIXPs组比,MIXPs+ZnSO4组显著升高(P<0.05)。3组小鼠间均睾丸组织T-AOC水平差异无统计学意义(P>0.05)。见图5。
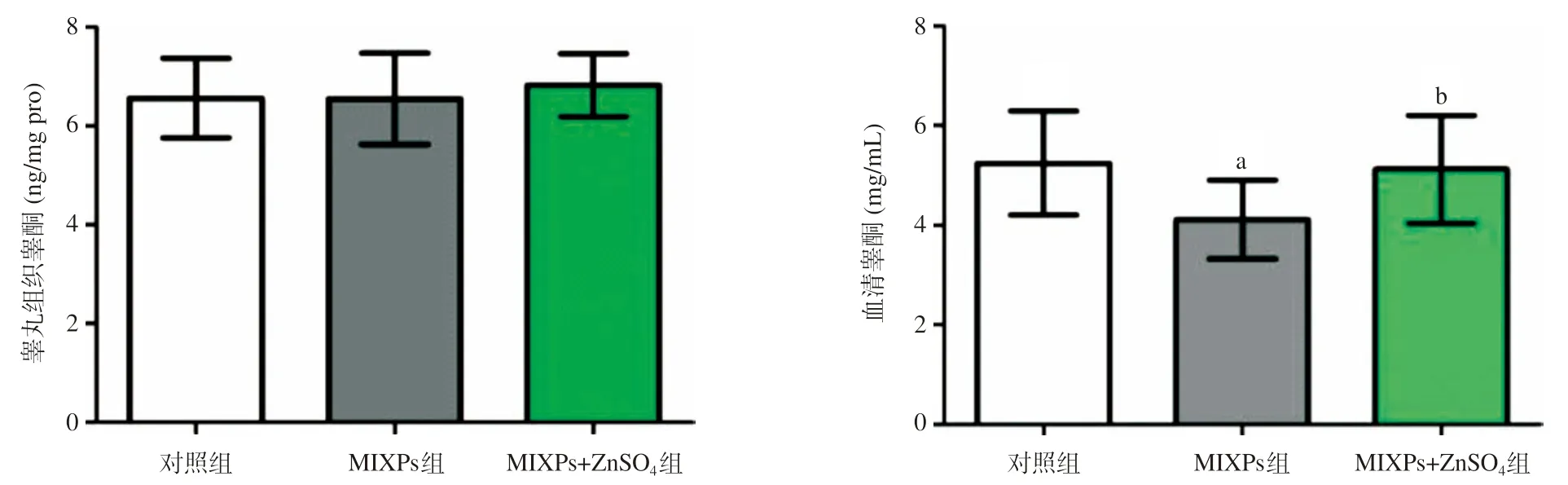
图4 3组小鼠血清和睾丸组织睾酮水平比较
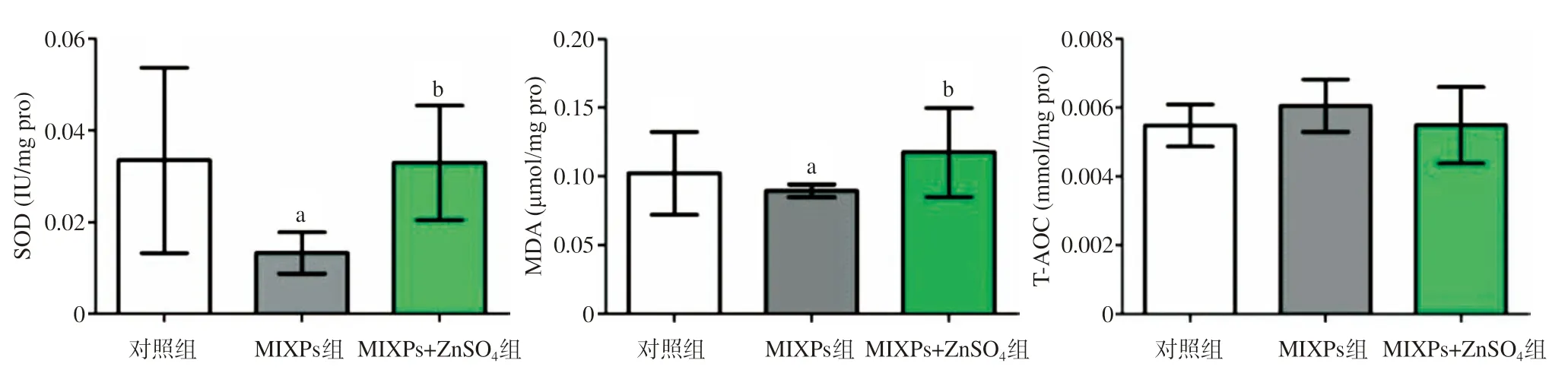
图5 3组小鼠睾丸组织中SOD、MDA和T-AOC水平比较
3 讨论
本研究模拟人群长期低剂量混合物暴露的实际特征,研究了BBP、DBP、DEHP 3种常见PEs塑化剂的等毒性混合物的雄性生殖毒性,以及锌对MIXPs暴露致雄性生殖毒性的干预作用。根据前期研究[5,10],设定MIXPs的暴露剂量为160 mg·kg-1·d-1,ZnSO4的干预剂量为50 mg·kg-1·d-1。处理90 d发现MIXPs暴露改变了小鼠生殖器官质量、肛殖距、血清睾酮水平及精子形态等,产生了生殖毒性;而锌能够抑制这些参数的改变,从而抑制MIXPs的生殖毒性。
本研究干预过程中发现,MIXPs组小鼠精神稍萎靡,活跃性降低,个别小鼠生殖器周围毛色泛黄,皮毛粗糙,体质量降低,身长缩短,提示MIXPs暴露对小鼠产生毒性作用;这与前期研究[5]结果相一致;而MIXP+ZnSO4组小鼠这些参数均无明显的变化。另一方面,脏器质量的显著改变是机体出现损伤的重要指标[12]。睾丸周围脂肪可保护睾丸免受伤害。肛殖距与生殖功能呈正相关,肛殖距是生殖功能损伤的敏感性指标。本研究中,MIXPs组肛殖距明显缩短,睾丸周围脂肪含量降低,说明MIXPs暴露对大鼠产生了生殖毒性。精子形态观察和显著提升的精子畸形率佐证了MIXPs的雄性生殖毒性。本研究中,MIXPs+ZnSO4组小鼠肛殖距、睾丸周围脂肪较MIXPs组均有明显增加,精子形态改善,精子畸形率显著降低,说明锌对MIXPs暴露诱导的生殖毒性有抑制作用。在CHEMEK等[13]的研究中,锌能够提高妊娠期及哺乳期镉暴露致子一代雄性大鼠的生殖器官的相对质量,如睾丸和附睾,对大鼠雄性生殖系统有保护作用,与本研究结果类似。
睾酮主要由睾丸间质细胞合成和分泌,具有维持肌肉强度及质量、维持骨质密度及强度、维持雄性第二特征和生殖功能、增强免疫力等作用。据报道,PEs暴露能够降低血清睾酮水平[14-15],其原因可能是:PEs暴露下调了一些关键蛋白的表达,如StAR、P450scc、CYP17、17β-HSD和3β-HSD,从而抑制睾酮的合成[16-17]。本研究结果显示,MIXPs组小鼠睾丸组织睾酮水平未发生明显变化,提示MIXPs暴露可能没有影响小鼠的睾酮合成;而MIXPs组小鼠血清睾酮水平显著降低,提示MIXPs暴露可能影响了睾酮的分泌,这可能与下丘脑-垂体-睾丸轴负反馈调节系统有关[5]。睾酮维持着精子的正常发育,而血清睾酮水平降低可能是MIXPs组小鼠精子畸形率升高的内在原因。MIXPs+ZnSO4组小鼠血清睾酮水平较MIXPs组有显著的提升,提示锌可抑制MIXPs暴露致血清睾酮水平改变,从而维持小鼠正常的雄性生殖功能。
诸多研究显示,PEs暴露可诱导氧化应激,对雄性生殖功能造成损伤。研究表明,DBP(250~500 mg·kg-1·d-1)经口暴露2周可致大鼠附睾组织中谷胱甘肽过氧化物酶(GSH-Px)、SOD活性降低,MDA水平升高,诱导附睾损伤[18]。类似的,DBP(100~500 mg·kg-1·d-1)腹腔注射致睾丸组织氧化应激,干扰大鼠性激素合成、精子生成,损伤其生殖能力[19]。DEHP(50、150、450 mg·kg-1·d-1)经口连续暴露2周致睾丸组织中SOD、过氧化氢酶(CAT)、GSH-Px以及T-AOC降低,MDA水平升高,产生氧化应激,对大鼠雄性生殖系统造成损伤[20]。本研究中,MIXPs组小鼠睾丸组织中SOD、MDA水平均显著降低,而T-AOC无显著改变,提示MIXPs暴露可能导致小鼠抗氧化体系紊乱,使氧自由基水平增加,从而对睾丸组织造成损伤。MIXPs+ZnSO4组小鼠睾丸组织各抗氧化指标较对照组均无明显改变,提示锌能够改善小鼠的抗氧化体系,从而保护睾丸组织免受氧自由基的攻击。
综上所述,MIXPs长期暴露可诱导小鼠睾丸组织氧化应激,血清睾酮水平降低,导致精子畸形率升高,损伤其雄性生殖功能;而锌能够抑制MIXPs暴露诱导的雄性生殖功能损伤。
