非小细胞肺癌患者病理组织中MTH1的表达和临床意义的研究
2019-09-27张东伟孔晋亮蓝冰王丰杨朝生孙雪皎钟家将
张东伟 孔晋亮 蓝冰 王丰 杨朝生 孙雪皎 钟家将
1柳州市人民医院呼吸与危重症医学科545000;2广西医科大学第一附属医院呼吸与危重症医学科,南宁530021
肺癌是全球癌症相关死亡的主要原因,发病率高且严重危及人类的健康[1]。随着现代分子肿瘤学的进步,各种分子靶向治疗取得了长足的进步,但是肺癌的预后仍然很差[2],急需寻找新的预测肺癌预后分子标志物和新的治疗靶点。
癌症的发生是细胞在各种内外刺激下导致原癌基因和抑癌基因平衡失调的过程,其中氧化应激、缺氧和遗传障碍起重要的作用[3]。活性氧(reactive oxygen species,ROS)产生于多种细胞生物学活动中,ROS 通过氧化核苷酸和蛋白质,诱导基因突变和细胞衰老产生氧化应激作用[4]。ROS可氧化d GTP或DNA中的鸟嘌呤碱基而产生8-氧代-鸟嘌呤。在DNA复制时,DNA聚合酶可以在DNA模板中插入8-氧代-dGTP,从而导致A到C或G 到T 的颠换突变导致细胞增殖失控[5]。mut T 同系物1(mut T homolog 1,MTH1)是一种氧化型嘌呤核苷三磷酸酶,可以将8-氧代-dGTP水解成其单磷酸形式,从而阻止DNA聚合酶将8-氧代-d GTP插入基因组[6],对细胞基因组的稳态起到保护作用。
尽管一些研究提示靶向MTH1可抑制由肿瘤细胞系发展而来的肿瘤的增殖[6],但是MTH1在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达情况和临床意义尚不清楚。本研究通过免疫组织化学方法检测NSCLC 患者中MTH1蛋白的表达,及其与患者临床病理因素和生存率之间的关系。
1 对象与方法
1.1研究对象 选取2013年3月至2017年3月广西医科大学第一附属医院及柳州市人民医院接受手术治疗的NSCLC 患者197 例。其中,男120例,女77例;年龄(54.8±18.3)岁,年龄范围为38~83岁。纳入标准:年龄>18岁,病理诊断为NSCLC;术前未接受放化疗。排除标准:患者缺乏足够的肿瘤组织3例;术后诊断为小细胞肺癌2例,术后的随访资料不完整1例;术前行辅助化疗和放疗3例。最终纳入研究197例,对全部病理标准依据TNM 标准进行病理分期[7]。
所有调查患者均取得患者知情同意及书面授权,该研究为患者手术切除部位病理学研究,对患者无任何药物的干预及处理,无关于试验研究的躯体性和精神性损害,符合《赫尔辛基宣言》的研究原则。
1.2研究方法 患者入院后即刻收集年龄、性别、吸烟史、EGFR 突变等资料。患者手术后收集病理组织,采用免疫组织化学方法检测MTH1蛋白的表达。根据MTH1染色细胞占总癌细胞比例[18]确定评分:≤19%为1分,>19%且≤39%为2分,>39%且≤59%为3分,>59%且≤79%为4分,>79%为5分。当<60%的肿瘤细胞染色时,评定为MTH1高表达,相关患者进入MTH1 高表达组;≥60%的肿瘤细胞染色时,评定为MTH1低表达,相关患者进入MTH1 低表达组。分析MTH1表达与患者临床特征之间的关系。进一步绘制患者生存率和无瘤生存率的ROC 曲线,并采用Kaplan-Meier生存曲线法分析MTH1表达与患者预后之间的关系,依据Cox比例风险模型分析患者总生存率和无瘤生存率的独立影响因素。患者手术后即开始随访,术后的前3年每隔6 个月行1次胸部CT 和血液肿瘤标志物检查,以后每年进行1次胸部CT 检查,对怀疑复发的患者,采用PET 检查或病理活检确诊。
1.3病理组织MTH1的免疫组织化学 将患者组织块包埋在石蜡中,然后在切片机中切成所需的厚度(大约5μm)并贴在载玻片上,在含有4%的PFA 中进行切片的固定,通过在封闭缓冲液中在室温下孵育30 min来阻断一抗和组织之间的非特异性染色。根据制造商的说明使用针对MTH1蛋白特异性抗体[兔抗人MTH1抗体,美国西格玛奥德里奇(上海)贸易有限公司]进行稀释后,将切片与MTH1蛋白特异性抗体在2~8℃下孵育过夜,在洗涤缓冲液中洗涤载玻片3次,每次15 min,然后是根据制造商的说明将HRP缀合的抗兔IgG1(抗兔K4003 Dako,日本和光纯药公司)进行稀释,与切片进行孵育,在洗涤缓冲液中洗涤载玻片3次,每次15 min。使用DAB底(Brown)试剂盒(Boster)对MTH1的染色信号进行显色,用苏木精对组织标本进行复染以区分细胞核和细胞质。
1.4统计学分析 采用SPSS 19.0软件进行分析,计数资料比较采用Pearsonχ2分析;正态分布计量资料以例数(百分比)表示,采用t检验;采用Kaplan-Meier生存分析比较MTH1高、低表达组患者的无瘤生存率和总生存率差异;采用Cox单因素和多因素回归分析分析NSCLC 患者无瘤生存率和总生存率的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1NSCLC 患者的临床资料和MTH1表达情况
本研究共纳入197例NSCLC 患者,其中104例(52.8%)患者的吸烟指数>20包年;腺癌140例(71.1%),鳞状细胞癌42例(21.3%),其他类型为15 例(7.6%)。经免疫组织化学染色后,MTH1高表达组111例(56.3%),MTH1低表达组86例(43.7%)。见图1。
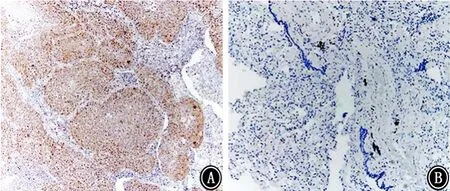
图1 非小细胞肺癌组织中MTH1高表达和低表达病理图片 免疫组织化学染色 ×100 A:MTH1高表达;B:MTH1低表达
2.2MTH1 高、低表达组临床资料比较 MTH1高表达和男性、吸烟指数≥20包年、鳞癌、TNM分期>Ⅰ期、肿瘤直径≥3 cm、淋巴结转移、胸膜浸润阳性、淋巴管浸润和血管浸润相关(P值均<0.05),见表1。
2.3MTH1高、低表达组总生存率及无瘤生存率比较 Kaplan-Meier 曲线的生存分析显示,MTH1高表达组的预后显著性低于MTH1低表达组。MTH1高表达组和MTH1低表达组5年总生存率分别为81.6%和92.3%(χ2=10.003,P=0.001),见图2;5年无瘤生存率分别为55.0%和83.7%(χ2=10.117,P<0.001)见图3。
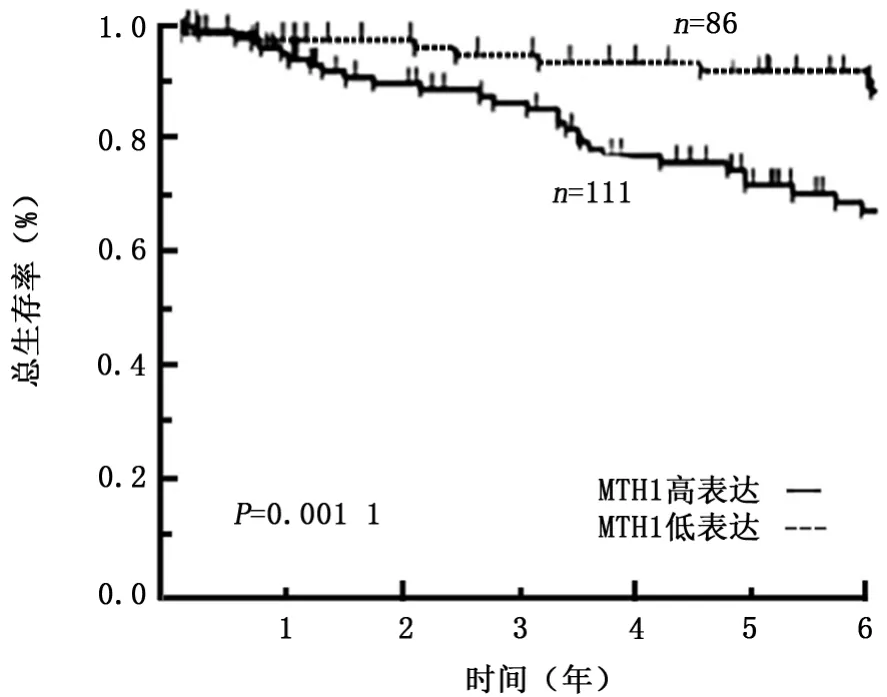
图2 MTH1高、低表达组患者的总生存率比较
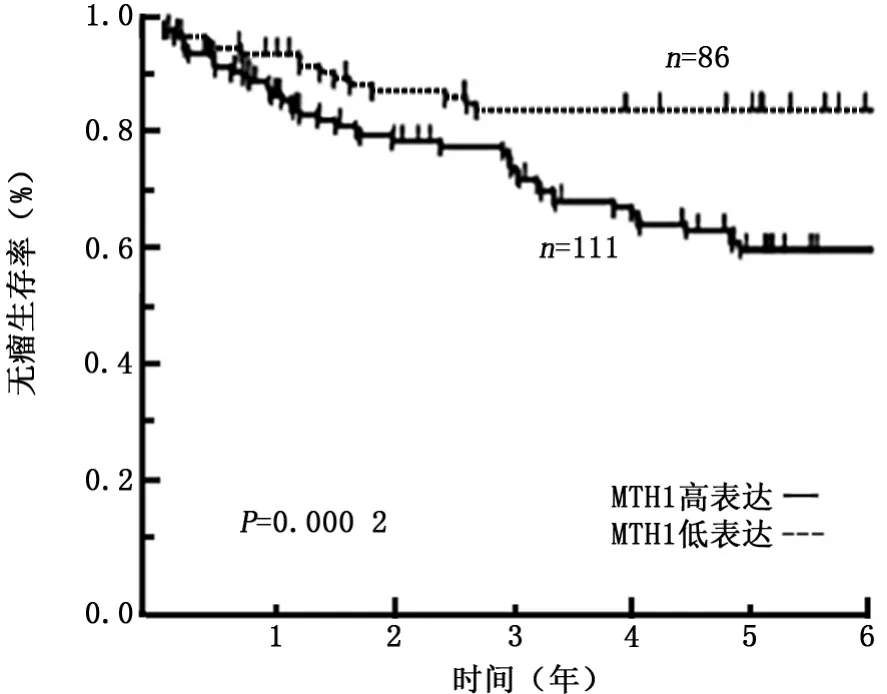
图3 MTH1高、低表达组患者的无瘤生存率比较
2.4MTH1高、低表达组在肺腺癌和肺鳞癌中总生存率及无瘤生存率比较 MTH1 高、低表达肺腺癌患者的5年总生存率分别为76.5%和95.4%(χ2=9.727 3,P=0.003 1),无瘤生存率分别为55.3%和85.3%(χ2=10.105 2,P=0.000 7)。见图4、图5。MTH1表达对鳞状细胞癌组织学患者的总生存率或无瘤生存率无显著影响。
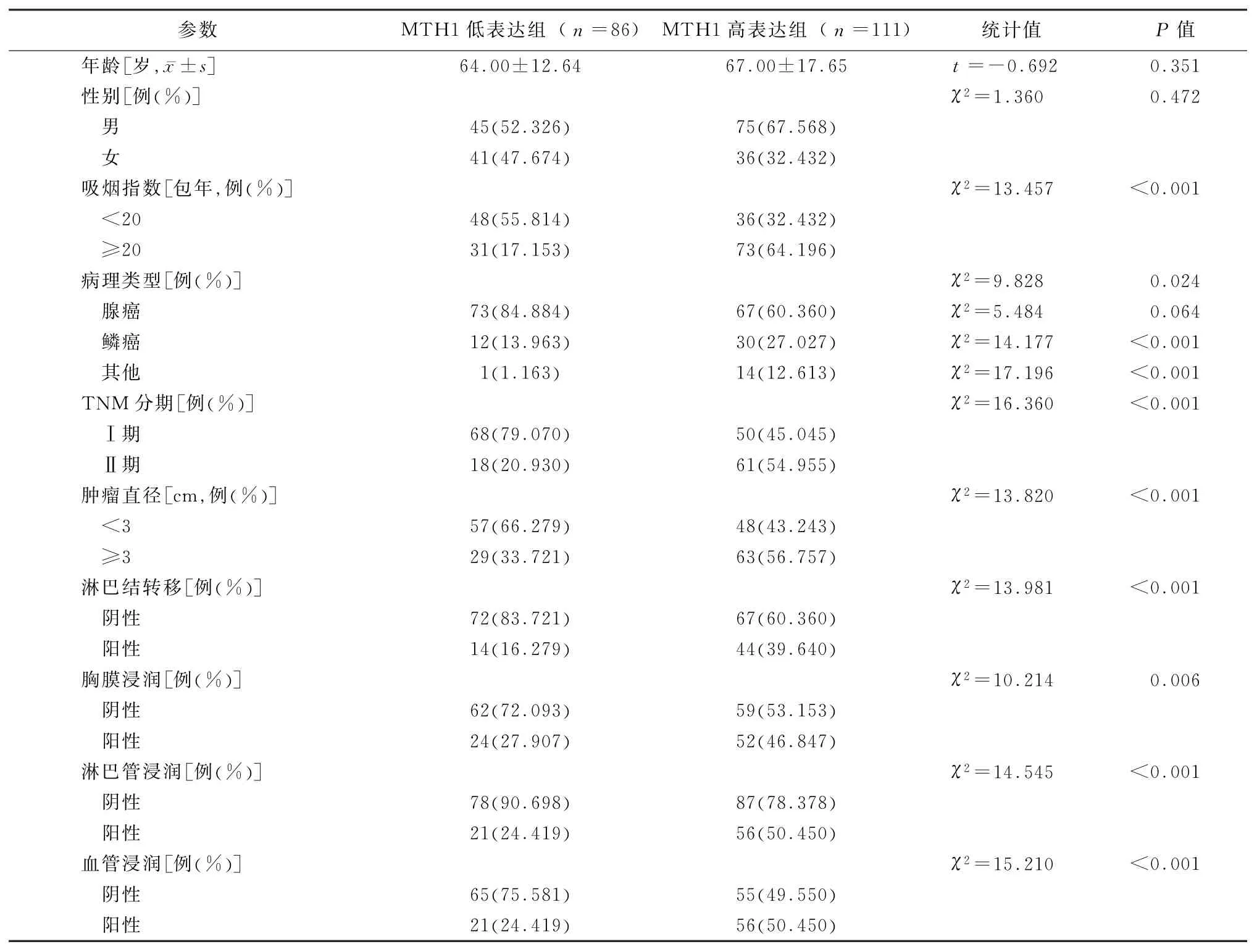
表1 MTH1高表达组与MTH1低表达组患者临床参数比较

图4 MTH1高、低表达组在腺癌中的总生存率比较
2.5NSCLC 患者总生存率的单因素和多因素分析 单因素分析显示TNM 分期、肿瘤直径、淋巴结转移、胸膜浸润、淋巴管浸润和血管浸润、MTH1表达是NSCLC 患者总生存率的危险因素。多因素分析提示MTH1 高表达(HR=1.713,95%CI:1.865~4.118,P=0.047)、淋巴结转移(HR=9.189,95%CI:2.824~39.457,P<0.001)、胸膜浸润(HR=2.216,95%CI:1.041~4.809,P=0.038)是NSCLC患者总生存率的独立危险因素。见表2。
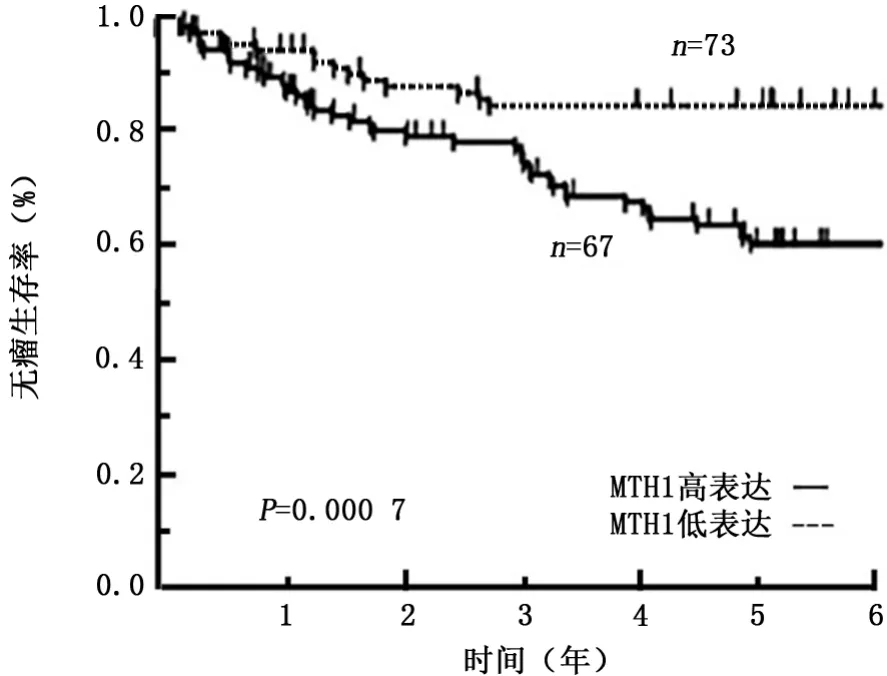
图5 MTH1高、低表达组在腺癌中的无瘤生存率比较
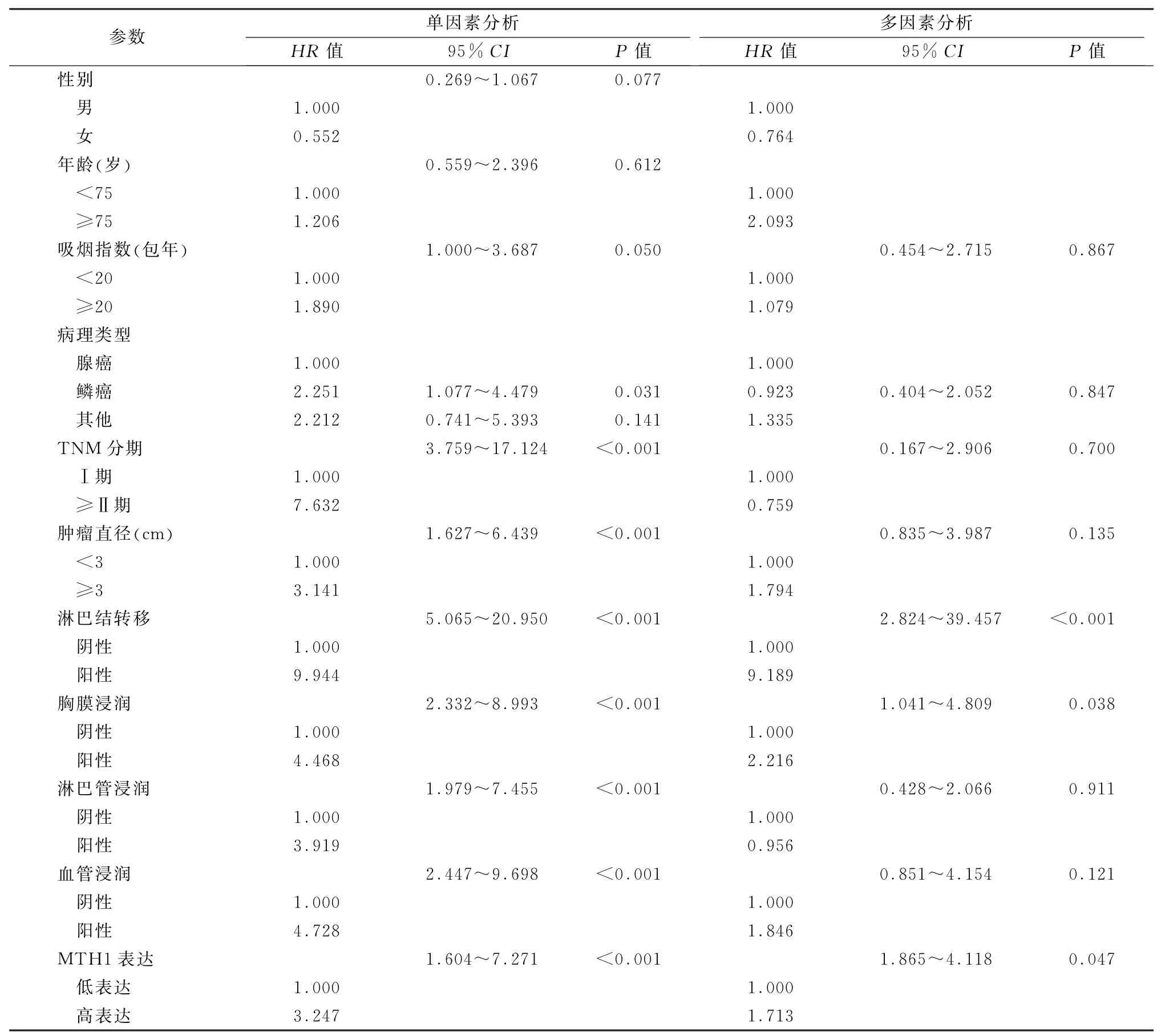
表2 非小细胞癌患者总生存率的单因素和多因素分析
2.6NSCLC患者无瘤生存率的单因素分析和多因素分析 单因素分析显示性别、吸烟程度、TNM分期、肿瘤直径、淋巴结转移、胸膜浸润、淋巴管浸润和血管浸润MTH1表达是NSCLC 患者无瘤生存率的危险因素。多因素分析提示MTH1高表达(HR=1.605,95%CI:1.627~3.248,P=0.039)和淋巴结转移(HR=4.501,95%CI:1.942~11.546,P<0.001)是NSCLC 患者无瘤生存率的独立危险因素。见表3。
3 讨论
MTH1是一种氧化型嘌呤核苷三磷酸酶,将8-氧代-d GTP水解成其单磷酸形式,通过清除核苷酸库中的氧化核苷酸来维持体细胞中遗传信息完整性,防止细胞在复制过程中将8-氧代G 掺入DNA[8]和8-氧代G 在细胞核中过度累积而导致细胞死亡。癌细胞生长环境常被发现具有比正常细胞更高的氧化应激水平,同时MTH1在癌细胞中高表达,表明MTH1有助于癌细胞增殖,这个观点已被Kennedy等[9]证实。然而,NSCLC中MTH1蛋白升高的临床意义尚不清楚。
在本研究中发现MTH1蛋白高表达与NSCLC患者的肿瘤恶性潜能(淋巴结转移和肿瘤分期晚期)有关。这些发现与先前评估肾细胞癌中MTH1 m RNA 表达的临床报道一致[10]。MTH1如何影响NSCLC的生物学行为的精确机制尚不清楚。推测可能的机制为:(1)MTH1的表达增加了NSCLC患者癌细胞的恶性潜能。在NSCLC 肺癌的癌细胞中,具有高侵袭性的肿瘤细胞可能较多的暴露在ROS刺激下,诱导MTH1高表达,修复DNA,行快速增殖,使得肿瘤细胞更具有向淋巴管、血管浸润和胸膜浸润的潜能。(2)癌细胞代谢研究提示,高侵袭性和进行性增殖癌细胞依赖于有氧糖酵解,实现DNA快速复制,分裂成子细胞并传播到身体其他部位[11]。这些机制表明癌细胞可能通过MTH1表达的增加逃避ROS所致的DNA损伤,从而表现出更高的恶性潜能,进而影响患者预后。
本研究还发现MTH1高表达患者的无瘤生存率和总生存率均低于MTH1低表达的患者。进一步的多因素分析显示MTH1高表达是患者无瘤生存率和总生存率的独立的预后因子。本研究显示重度吸烟(即吸烟指数≥20包年)患者MTH1高表达患者更多,吸烟则是氧化应激的触发因素,Asami等[12]表明吸烟量显著性增加肺组织中ROS的水平。结合本研究的发现,提示吸烟患者肺癌的癌细胞恶性潜能更高,该研究结果支持肿瘤细胞增殖可能需要MTH1的表达来对抗ROS所致的细胞DNA损伤有关。因此,MTH1可能是癌细胞氧化应激的标志物,也是肺癌患者生存期较差的指标[13]。
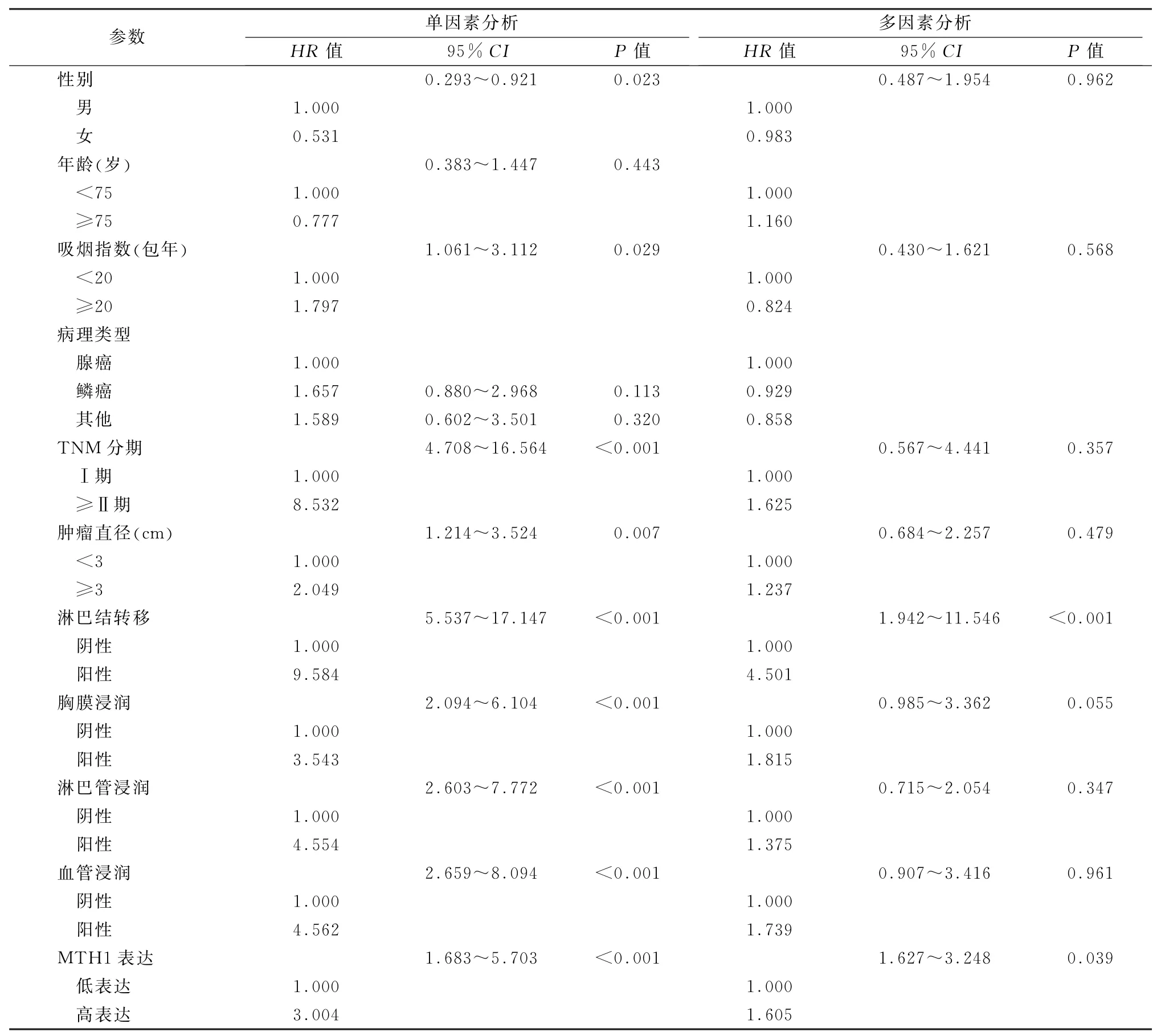
表3 非小细胞癌患者无瘤生存率的单因素和多因素分析
本研究有以下局限性:首先,本研究为单一机构中进行的回顾性研究,尚需要多中心大样本的研究验证;其次,免疫组织化学结果的评估标准问题,尽管本研究通过ROC 曲线寻找最佳的免疫组织化学评分的cut-off值,尚需要建立统一的标准来评估MTH1的表达状态来区分临床上亚组。肿瘤细胞中MTH1高表达的精确的机制尚需要进一步研究。
利益冲突所有作者均声明不存在利益冲突
