HE4在慢性阻塞性肺疾病的表达及意义
2019-09-27朱筱慧贾嫚许家艳孟亚奇乔莹莹姚欣
朱筱慧 贾嫚 许家艳 孟亚奇 乔莹莹 姚欣
1南京医科大学第一附属医院呼吸与危重症医学科210029;2苏州大学附属第三医院呼吸科,常州213003
COPD是一种常见的可以预防和治疗的疾病,以持续性呼吸道症状和气流受限为特征[1]。过去学者们认为COPD是慢性炎症性疾病,而近年来越来越多的研究发现,蛋白酶/抗蛋白酶失衡、氧化/抗氧化失衡等非炎症机制,亦是造成COPD气道重塑及气流不可逆受限的重要原因[2-3]。1964年,瑞典学者Laurell和Eriksson率先提出了蛋白酶/抗蛋白酶失衡假说,该假说目前已成为肺气肿发病的经典机制[4]。人附睾蛋白4(human epididymis protein 4,HE4)是1991年由Kirchhoff等[5]在男性附睾组织中发现的,与分泌性白细胞蛋白酶抑制剂(secretory leucocyte protease inhibitor,SLPI)和弹性蛋白酶抑制剂elafin具备同源性,均属于乳清酸性蛋白(whey acid proteim,WAP)抑制剂家族成员之一,后两者在多个系统均表现出一定的抗蛋白酶活性[6]。该家族成员可通过抑制基质金属蛋白酶、胰蛋白酶、糜蛋白酶等多种蛋白酶的活性从而保护肺组织,减轻肺组织的损伤。本研究通过检测稳定期COPD患者肺组织、造模小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)以及人支气管上皮细胞(human bronchial epithelial cells,16 HBE)HE4的表达水平,探索HE4与COPD的联系。
1 对象与方法
1.1人肺组织 本实验中研究对象肺组织由南京医科大学第一附属医院呼吸与危重症医学科提供。肺组织来源于因肺结节、肺大泡、肺癌等相关肺部疾病接受手术治疗的患者,若为肺部恶性肿瘤患者,肺组织则取自肿瘤病灶边缘5 cm 以外的范围。根据获得的肺组织患者的第一秒用力呼气容积(forced expiratory volume in the first second,FEV1)/FVC参数分为COPD组6 例(FEV1/FVC<70%)、对 照 组6 例(FEV1/FVC ≥70%)[1]。以上所有研究对象均对此实验有所知晓并同意进行,均签署了知情同意书。本研究通过南京医科大学第一附属医院医学伦理委员会批准(2018-SRFA-205)。
1.2动物及细胞来源 6周C57BL/6 雄性小鼠,获取于南京江宁区青龙山动物繁殖场,生产许可证号:SCXK(苏)2017-0001;16 HBE 获取于美国模式菌种收集中心。
1.3材料 香烟烟雾提取物(cigarette smoke extract,CSE,美国Philip Morris公司),HE4抗体(美国Fab Gennix 公司),小鼠HE4 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)Kit(中国华美公司),16 HBE(美国ATCC公司),1640 培养基(美国Gibco 公司),胎牛血清(美国Sciencecell公司)。引物由南京锐真生物公司生产,HE4引物序列:上游引物为5'-CAAGAGTGCGTCTCGGACAG-3';下游引物为5'-TTCATCTGGCCAGGACACTG-3',甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物序列:上游引物为5'-AGAAGGCTGGGGCTCATTTG-3';下游引物为5'-AGGGGCCATCCACAGTCTTC-3'。
1.4方法
1.4.1人肺组织免疫组织化学 首先,取得肺组织标本后,先用无菌的冰生理盐水反复冲洗肺组织去除标本上手术时残留的血液;其次,将肺组织完全浸没于4%的甲醛溶液中固定,并过夜;然后,石蜡块包埋,切成0.4 mm 厚的切片,烘片。HE染色,放置于光学显微镜下观察人肺组织的病理变化。免疫组织化学检测人肺组织HE4 蛋白表达,具体步骤如下:枸橼酸盐微波抗原修复、3%H2O2室温,均15 min,PBS溶液洗涤3次;山羊血清工作液37℃孵育1 h,加一抗(HE4抗体1∶200)过夜;滴加生物素标记的二抗(山羊抗鼠1∶2 000)37℃孵育1 h,TBS 缓冲液洗涤3 次;DAB显色,自来水终止显色;苏木精染色2 min;蒸馏水冲洗,盐酸酒精分化并水洗,45℃温水返蓝10 min;中性树脂片封片并镜检。采用Image-pro plus 7.0软件分析免疫组织化学切片:每组切片分别随机挑选5个200倍、400倍视野进行观察并拍照。胞质棕黄色为HE4染色阳性,测量HE4阳性的积分光密度值(integral optical density,IOD),计算IOD/area。
1.4.2动物造模 采用随机教学表法将24只6周C57BL/6雄性小鼠随机分为对照组和COPD组,每组12只。COPD组暴露于3 ppm 的臭氧,每周2次,每次3 h[7];对照组在相同条件下暴露于空气。分别于实验开始后1 周、3 周末次暴露24 h后,2组各取6 只小鼠处死取材。将小鼠右肺结扎,用1 ml注射器缓慢推入0.4 ml预冷的1×PBS至气管,30 s后缓慢回抽,将获得的左肺BALF放入EP管中。4℃,离心半径8 cm,1 500 r/min离心10 min,保存于-80℃冰箱。采用ELISA 检测臭氧造模小鼠BALF中HE4的浓度,严格按照说明书进行操作。
1.4.3细胞实验 分别用1%、2.5%、5%浓度的CSE预处理16 HBE细胞24 h,以无任何干预措施的细胞为对照组。移去培养基,以预冷的PBS清洗细胞,每孔加入1 ml Trizol提取总RNA,逆转录后加入SYBR Green行实时定量逆转录聚合酶链式反应。反应条件为:预变性95℃30 s→变性95℃5 s→退火60℃30 s→延伸72℃10 min,共40个循环。以GAPDH 为内参,采用2-ΔΔCT计算目的基因的相对表达量。
1.5统计学分析 采用SPSS 23.0统计学软件进行数据处理,计量资料以±s表示,组间数据比较采用LSD-t检验。计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1基本临床资料 2 组年龄、性别组成比较,差异无统计学意义(P值均>0.05),COPD组FEV1、FEV1%pred、FVC 及FEV1/FVC 均低于对照组(P值均<0.05),见表1。
2.2人肺组织中HE4 免疫组织化学染色及半定量 HE4主要分布于支气管上皮细胞,肺泡巨噬细胞也有少量表达(图1)。以IOD 值对HE4表达进行半定量分析,对照组肺组织HE4表达量为0.070±0.007,COPD组肺组织HE4 表达量为0.048±0.004,COPD组HE4 表达量低于对照组(t=2.267,P<0.05),见图2。
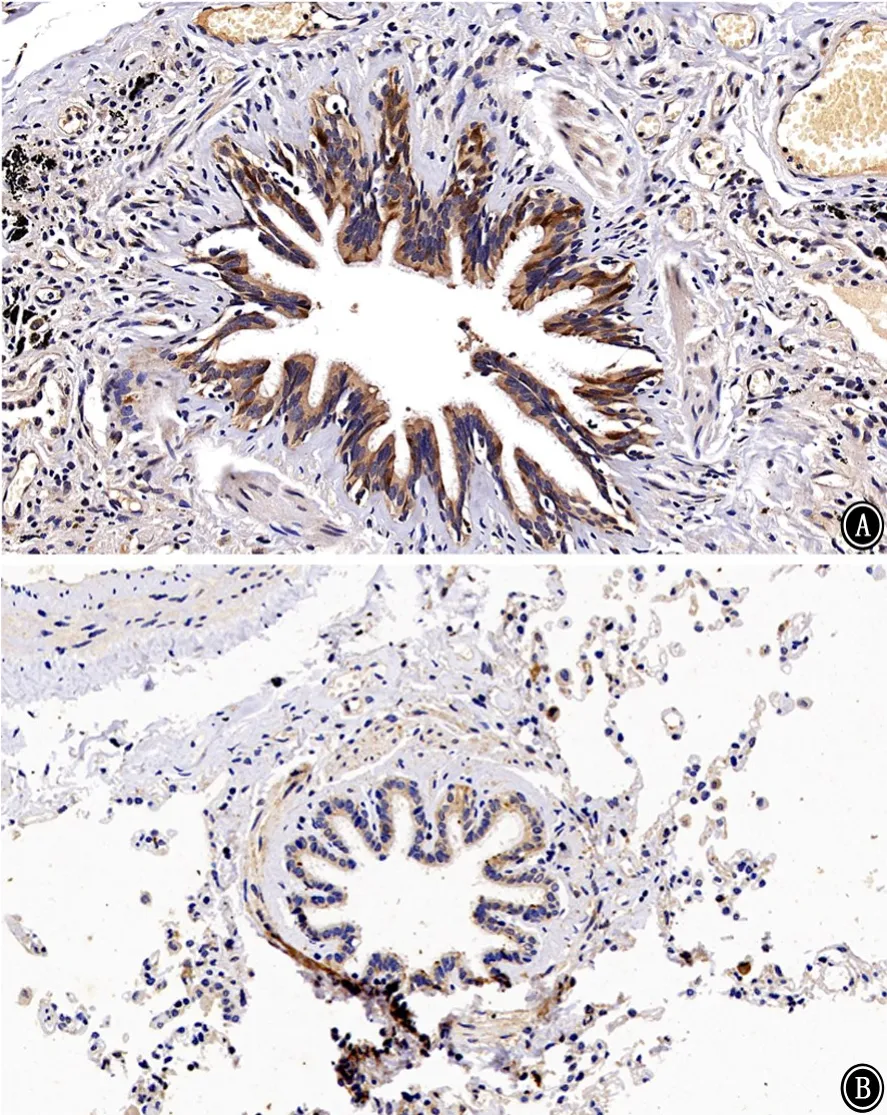
图1 人肺组织中人附睾蛋白4病理图片 免疫组织化学染色 ×400 A:对照组;B:COPD组
2.3COPD小鼠模型制备结果 对照组小鼠肺组织肺泡结构完整,无肺泡扩大;COPD组可见肺组织稀疏,肺泡隔减少、破坏,肺泡壁断裂,肺泡扩大、融合,肺大泡形成(图3),1周、3周时2组小鼠肺泡平均线性截距比较差异均有统计学意义(P值均<0.000 1),见图4。除了肺气肿表现,COPD组还出现了气道壁增厚及炎症细胞浸润,表明造模成功。

表1 临床病例基本资料
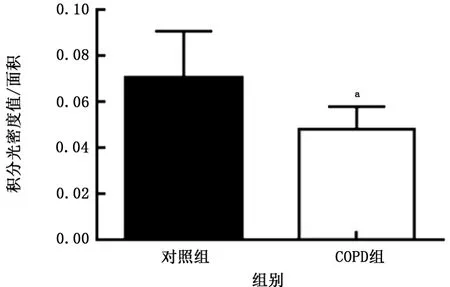
图2 2组肺组织支气管上皮细胞中人附睾蛋白4表达水平
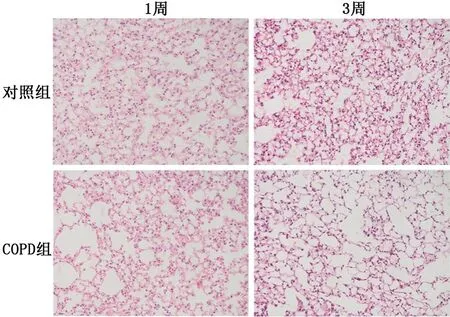
图3 2组小鼠肺组织病理学改变 HE ×200
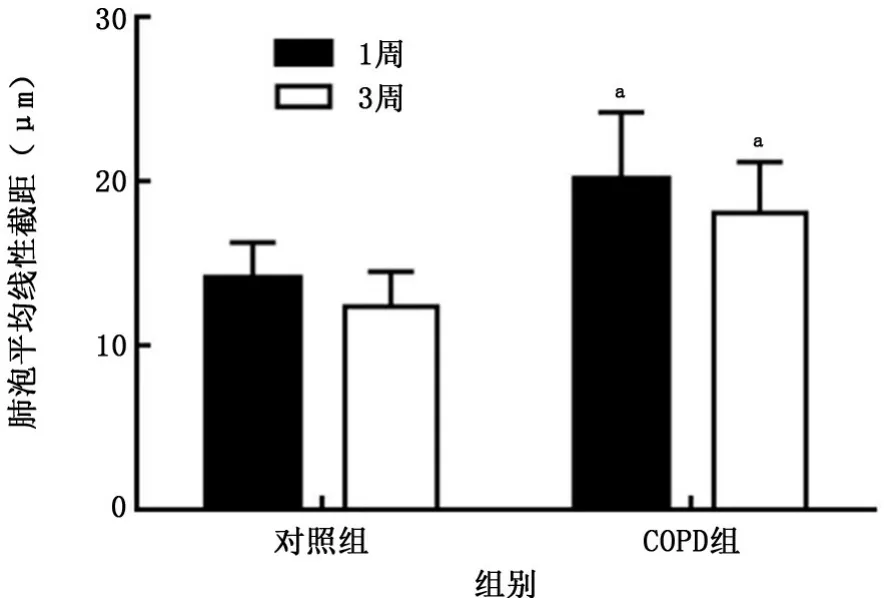
图4 2组小鼠肺泡平均线性截距情况
2.4HE4在BALF中表达情况 1周时,对照组小鼠BALF中HE4水平为(838.5±110.2)ng/L,COPD组为(463.1±107.0)ng/L;3周时,对照组小鼠BALF中HE4水平为(760.6±138.0)ng/L,COPD组为(403.4±52.27)ng/L。在1周、3周时,COPD组小鼠BALF中HE4水平均低于对照组,差异有统计学意义(t=2.423、2.987,P值均<0.05),见图5。
2.5HE4 m RNA 在CSE预处理16HBE中表达情况 与对照组比较,2.5%、5%CSE 干预细胞均明显抑制HE4 m RNA 的相对表达量,差异均有统计学意义(t=3.895、4.060,P值均<0.05),见图6。
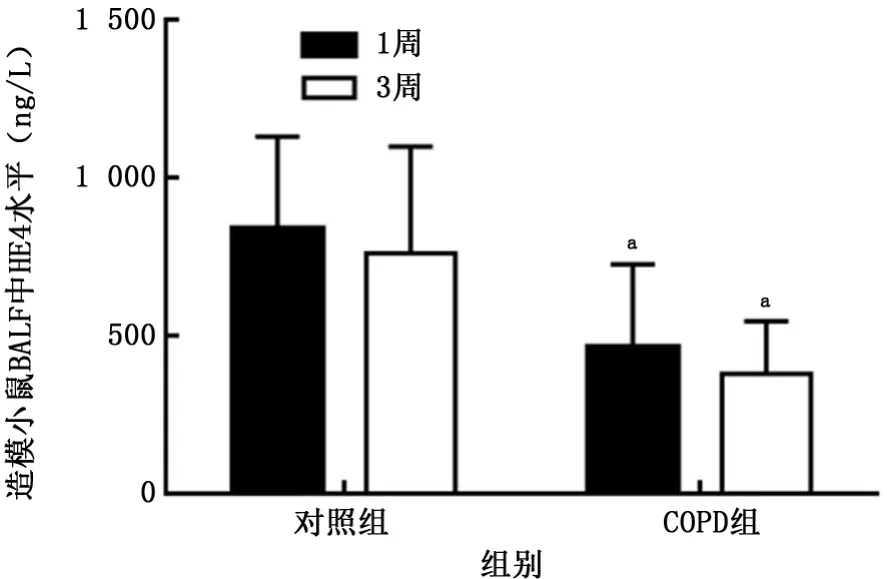
图5 2组小鼠支气管肺泡灌洗液中人附睾蛋白4情况

图6 各组人支气管上皮细胞中人附睾蛋白4 m RNA 表达情况
3 讨论
COPD是目前世界范围内一个主要的公共卫生问题[1],发病率和病死率日益增长。学者预测,到2020年,因COPD导致的病死率将会升至全球第三位[8]。尽管COPD近年来受到医学界的极大关注,但它的确切发病机制仍然尚未完全揭晓[8]。COPD被认为是长期累积暴露于有毒气体和颗粒等环境因素及包括遗传学、气道高反应性和儿童期肺部生长不良等多种宿主因素的后果[8-9]。
HE4基因又称为WAP-4-二硫化物核心结构域2,定位在染色体20 q12-q13.1,由WAP类型的二硫键核心构成,编码124个氨基酸的HE4蛋白前体,全长11.78 kb[10]。HE4分布于人体一些组织和器官,如:气管、呼吸道上皮细胞、唾液腺、肠道黏膜、远端肾小管、前列腺、附睾等;HE4 亦存在于一些恶性肿瘤组织中,如:妇科系统的子宫内膜癌、卵巢浆液性癌以及肺癌等[10]。
Bingle等[11]通过免疫组织化学的方法阐明了HE4在呼吸道、唾液腺、外周肺组织的表达部位,并发现其在囊性纤维化(cystic fibrosis,CF)患者的支气管上皮细胞中表达升高。Nagy等[12]学者发现,在囊性纤维化患者中,血清HE4水平与其整体病情严重性及肺功能下降速度呈明显正相关,推测HE4可作为CF 的新炎症因子并可用作评估CF治疗疗效。LeBleu 等[13]发现,HE4 基因作为假定的丝氨酸蛋白酶抑制剂在人和小鼠肾纤维化模型中表达均上调,并且在肾纤维化患者血清中的浓度升高,对基质金属蛋白酶2、基质金属蛋白酶9、丝氨酸蛋白酶、胰蛋白酶均有抑制作用,与其自身的类丝氨酸蛋白酶抑制剂活性密切相关。在COPD领域,目前尚无与HE4 相关的研究发表。COPD患者存在迁延不愈的持久的气道慢性炎症,即使彻底戒烟后,这种气道炎症仍然持续存在,相关具体机制尚不明确,导致气管、支气管以及黏膜下腺体中的巨噬细胞、中性粒细胞等炎症细胞分泌增多,并且募集、活化,造成气道内的基质金属蛋白酶、中性粒细胞弹力酶等蛋白酶成分的释放显著增多,蛋白酶占据绝对优势,从而出现弹性蛋白降解,肺间质消融,肺泡壁结构破坏,肺泡腔扩大和/或融合,小气道在呼气末失去了周围肺组织的支持而塌陷,导致COPD发生、发展[4]。另外,COPD患者气道上皮发生杯状细胞的增生、促炎症介质的释放等一系列病理生理学改变,通过上皮间充质转化(epithelial-mesenchymal transition,EMT),引起间质标记物如成纤维细胞蛋白、基质金属蛋白酶9等表达增高,从而产生气道重塑[14]。因此,我们推测,HE4可能与COPD的气道炎症和/或气道重塑存在一定的相关性。本项研究显示,在COPD组患者肺组织中,HE4主要在支气管上皮细胞中表达,同时在肺泡巨噬细胞中亦有极少量表达;COPD组小鼠BALF中HE4水平降低,推测HE4所具有的抗蛋白酶活性,可与基质金属蛋白酶、中性粒细胞弹力酶等蛋白酶相结合,抑制弹性蛋白降解,减轻肺组织损伤,因此支气管上皮细胞内游离的HE4消耗相应增多从而导致含量减少,该机制可能是HE4下降的主要机制之一。
烟雾暴露是COPD的重要的危险因素,16HBE受CSE刺激后,HE4表达水平下降,表明支气管上皮细胞中HE4水平的降低可能与CSE 等有毒有害气体对气道屏障的损害作用有关,但具体的信号通路尚待研究。Small 等[15]发现,作为WAP抑制剂家族成员中研究最多的蛋白质,SLPI是气道中重要的保护基质,SLPI进入巨噬细胞、单核细胞的细胞核,通过调节核因子κB 通路发挥生物学效应,其与P65竞争性结合核因子κB 的连接位点,从而抑制炎症因子的转录,如:肿瘤坏死因子α和IL-8,从而减轻炎症反应。既往研究发现,转化生长因子β1(transforming growth factor-β1,TGF-β1)被 认 定是COPD发病进程中发挥关键作用的致病因子,牛瑞超等[16]研究表明,COPD大鼠模型肺组织标本中SLPI的表达量呈现显著下降趋势,有可能归结于TGF-β1表达量上升;同时发现,TGF-β1使COPD大鼠模型支气管上皮细胞中SLPI表达下降是通过Smads信号通路介导的。我们猜测,HE4与SLPI同为WAP基因家族成员,可能作用机制相同,均是通过调节核因子κB 和/或TGF-β1/Smads信号通路发挥生物学功能。
目前,在COPD领域尚无与HE4相关的研究发表。鉴于WFDC 家族蛋白质具有丰富的生物学效应,HE4作为功能多样的分泌蛋白,在COPD的病程中可能具备重要的生物学特性。HE4具备蛋白酶抑制剂的功能[13],由此,我们猜测HE4通过调节蛋白酶/抗蛋白酶失衡机制对COPD病程产生影响,COPD支气管上皮细胞HE4表达量降低可能因其消耗过多所导致。反之,通过重组蛋白提高支气管上皮细胞中HE4水平,可能抑制弹性蛋白降解,减慢COPD发生、发展。本研究目前存在一定的局限性,虽然HE4在COPD支气管上皮细胞中表达水平降低,但具体机制尚未完全阐明,本课题组下一步将会对此进行后续研究。
综上所述,HE4可能是COPD发生、发展过程中的潜在生物标志物,对HE4作用机制的进一步研究将可能对COPD产生影响。
利益冲突所有作者均声明不存在利益冲突
