CD34+CD38-KG1a白血病干细胞对同种异体自然杀伤细胞的抵抗作用及其机制
2019-09-25王国征吴远彬郭坤元代喜平
王国征,吴远彬,郭坤元,代喜平
(广州中医药大学第二附属医院血液科,广东省中医院血液科,广东 广州 510120)
急性白血病是人类最常见的恶性肿瘤,白血病干细胞(leukemia stem cell,LSC)是其复发和难治根源之一[1-2]。LSC在多个基因和信号调节系统上发生异常,失去正常的增殖分化能力,具有很强的无控性自主增殖能力,能够对药物、放射和免疫细胞的杀伤产生强大的抵抗力[3]。研究表明,从急性髓系白血病细胞株KG1a中分选的CD34+CD38-KG1a具有LSC生物学特性,可抵抗化学药物的杀伤作用[4]。本研究拟探讨CD34+CD38-KG1a对自然杀伤(natural killer,NK)细胞的抵抗作用及可能机制。
1 材料与方法
1.1 细胞系、试剂和仪器人急性髓系白血病细胞株K562由本实验室冻存,KG1a细胞株由中国医学科学院血液病研究所惠赠,本实验室传代保存;PRMI-1640培养基、胎牛血清购自美国Gibco公司,淋巴细胞分离液购自天津血液研究所,乳酸脱氢酶(lactate dehydrogenase,LDH)杀伤活性试剂盒购自美国Promega公司,抗主要组织相容性复合体(major histocompatibility complex,MHC)-I类链相关分子A/B(MHC class I chain-related molecules A and B,MICA/B)单抗、抗人巨细胞病毒UL16结合蛋白(human cytomegalovirus glycoprotein UL16 binding proteins,ULBP)1单抗、抗ULBP2单抗、抗ULBP3单抗、抗人类白细胞抗原(human leukocyte antigen,HLA) -Ⅰ类分子抗体、CD38-异硫氰酸荧光素 (fluorescein isothiocyanate,FITC)、抗-FITC免疫磁珠、抗CD16CD56免疫磁珠购自德国MiltenyiBiotec公司,杀伤细胞免疫球蛋白样受体(inhibitory killer cell immunoglobulin- like receptor,KIR)基因检测试剂盒、HLA基因检测试剂盒购自德国Biotest公司;精密加样枪购自美国Apendorff公司,免疫磁珠细胞分选仪(immune magnetic bead separator,MACS)、LD分离柱购自德国Miltenyi Biotec公司,ELX800光吸收酶标仪购自美国Bio-TeK公司,Eppendorf高速低温离心机购自美国Fisher Scientific公司,流式细胞仪购自美国Coulter公司,超净工作台购自苏州净化设备有限公司,Olympus倒置显微镜购自日本Olympus公司,CO2培养箱购自美国Thermo公司,一次性100 cm2培养瓶、试管、96孔培养板购自美国Corning公司,血球计数板购自上海求精生化试剂仪器有限公司。
1.2 细胞培养37 ℃水浴箱中溶解冻存的K562、KG1a细胞,1 000 r·min-1离心5 min,弃上清,重悬浮细胞于4 mL含体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的RPMI-1640培养基,接种于25 cm2培养瓶,置于 37 ℃、含体积分数5%CO2培养箱中进行孵育。
1.3 免疫磁珠法分选CD34+CD38-KG1a细胞取对数生长期KG1a细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,每107个细胞加100 μL PBS和带FITC的CD38抗体10 μL,4 ℃下避光孵育30 min。PBS洗涤1次,弃上清液,重悬浮细胞,每107个细胞加PBS 9 μL和抗FITC的免疫磁珠10 μL,混匀后4 ℃下孵育15 min,PBS再洗涤1次,弃上清液,重悬于5 mL分选液中,将LD柱安装在磁铁中,取2 mL分选液湿润LD分离柱,细胞悬液加入LD柱中,每次加入1 mL缓冲液,冲洗2次,无菌试管收集分离的CD34+CD38-KG1a细胞。每106个细胞加1 μg单抗,4 ℃下孵育30 min,加PBS 2 mL,1 000 r·min-1离心10 min,弃上清液,重新悬浮细胞,流式细胞仪检测分离细胞的纯度。
1.4 同种异体NK细胞分离采用梯度密度沉淀法分离4例健康个体外周血单个核细胞,PBS洗涤后,每107个细胞加缓冲液80 μL和抗NK细胞免疫磁珠20 μL,4 ℃下孵育15 min,每107个细胞加缓冲液1 mL,离心,弃上清。每108个细胞加缓冲液500 μL重新悬浮细胞,置于Mini-MACS磁场中进行分离,一次性试管收集CD3阴性细胞,再次用 500 μL 缓冲液冲洗分选的CD56阳性细胞,共2次,卸下分选柱,加RPMI-1640培养液 1 mL,推注器推出阳性细胞,分选的CD3-CD16+CD56+细胞即为NK细胞。PBS洗涤2次,每106个细胞加CD3FITC/CD16CD56PE单抗1 μg,4 ℃孵育 30 min,加入PBS 2 mL,1 000 r·min-1离心10 min,弃上清后重悬细胞,以同型的IgG为对照,采用流式细胞术检测NK细胞数。
1.5 NK细胞对K562细胞和CD34+CD38-KG1a细胞的杀伤作用以NK细胞为效应细胞,以对数生长期K562细胞为靶细胞对照,分离的CD34+CD38-KG1a细胞为靶细胞,RPMI-1640培养基调整细胞密度为2×108L-1,加入96孔板中,每孔 50 μL。将细胞分为效靶组、效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组和空白对照组。效靶组按不同效靶比(5:1、10:1、20:1)分别加入不同浓度的NK细胞各50 μL;效应细胞自发释放组加入NK细胞50 μL、RPMI-1640培养基50 μL;靶细胞自发释放组加入靶细胞50 μL、RPMI-1640培养基50 μL;靶细胞最大释放组加入裂解液10 μL、靶细胞50 μL、RPMI-1640培养基50 μL;空白对照组加入100 μL RPMI-1640培养液。各组均设4个复孔,于37 ℃下在含体积分数5% CO2培养箱中培养4 h后,2 000 r·min-1离心5 min,吸取 50 μL 上清,加入96孔平底酶标板中,加LDH底物反应液50 μL,室温下避光放置30 min,每孔加 50 μL 终止液终止反应。酶标仪测波长490 nm 处吸光度值。计算NK细胞杀伤活性。杀伤率=(效靶组平均吸光度值-靶细胞自然释放组平均吸光度值-效应细胞自然释放组平均吸光度值)/(靶细胞最大释放组平均吸光度值-靶细胞自然释放组平均吸光度值)×100%。
1.6 NK细胞KIR和CD34+CD38-KG1a细胞HLA-Ⅰ基因分型采用聚合酶链式反应-序列特异性引物法(polymerase chain reaction with sequence specific primers,PCR-SSP)进行NK细胞KIR和CD34+CD38-KG1a细胞HLA-Ⅰ基因分型,严格按照试剂盒说明书进行操作。
融化试剂盒配备PCR缓冲液,震荡混匀,每管1份(150.0 μL);取出Taq酶置于冰盒上;加60 μL蒸馏水和2.4 μL Taq酶于备用的PCR缓冲液管,震荡混匀。取上述混合液8 μL加至污染监控孔(对照孔)。加25 μL提纯的DNA标本至剩余的混合液中,震荡均匀;除对照孔外,每孔加上述混合液 8 μL,用密封条密封试剂板。放入PCR仪进行扩增,扩增程序:95 ℃预变性1 min,95 ℃变性20 s,63 ℃ 退火20 s,72 ℃延伸90 s,共30个循环。4 ℃终止反应。5×Tris-硼酸缓冲液制备20 g·L-1的琼脂糖凝胶,冷却至60 ℃时,每100 mL TBE加2 μL 10 g·L-1的溴化乙锭,电泳槽中铺好胶后放置梳子,冷却。去掉PCR试剂板上的密封条,加入6 μL PCR产物于电泳胶孔内。以ONELAMBDA gel box 120V恒压电泳25 min,将凝胶取出置紫外灯下拍照观察。
1.7 K562细胞和CD34+CD38-KG1a细胞表面NKG2D配体及HLA-Ⅰ分子的表达取对数生长期K562细胞和分选的CD34+CD38-KG1a细胞,PBS洗涤,计数,分管,直接标记法检测HLA-Ⅰ类分子,每106个细胞加入1 μg W6/32,4 ℃培育 30 min,PBS洗涤3次。间接标记法检测NKG2D配体的表达,每106个细胞加入抗MICA/B单抗,抗ULBP1单抗,抗ULBP2单抗,抗ULBP3单抗,抗HLA-Ⅰ 单抗一抗各1 μg,4 ℃下作用30 min,PBS洗涤后再加入FITC标记的山羊抗鼠IgG(稀释度1:100)二抗,4 ℃培育30 min,PBS洗涤后上机,以同型IgG抗体作为阴性对照。流式细胞仪分析1×104个细胞中阳性细胞数,计算百分率。实验重复3次,取平均值。
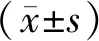
2 结果
2.1 CD34+CD38--KG1a和NK细胞的纯度结果见图1。分选的CD34+CD38--KG1a细胞和NK细胞纯度分别为(94.25±2.16)%、(91.70±2.05)%。
A:NK细胞分选前;B:NK细胞分选后;C:CD34+CD38-KG1a 细胞分选前;D:CD34+CD38-KG1a 细胞分选后。
2.2 NK细胞对K562和CD34+CD38-KG1a细胞的杀伤作用结果见表1。NK细胞在各效靶比下对CD34+CD38-KG1a细胞的杀伤率均低于K562细胞,差异有统计学意义(P<0.05)。
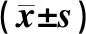
表1 NK细胞对K562和CD34+CD38-KG1a细胞杀伤情况
2.3 NK细胞KIR和CD34+CD38-KG1a细胞的HLA-Ⅰ基因分型结果见图2和图3。4例健康个体NK细胞KIR基因型KIR2DL1、KIR2DL3、KIR3DL1和KIR3DL2;CD34+CD38-KG1a细胞HLA-Ⅰ基因型为A30、30,B51、78,Cw4、16。
图2 NK细胞KIR基因分型

图3 CD34+CD38-KG1a细胞HLA基因分型
2.4 K562和CD34+CD38-KG1a细胞中NKG2D配体及HLA-Ⅰ类分子的表达率结果见表2。K562细胞高表达NKG2D配体,CD34+CD38-KG1a细胞几乎不表达NKG2D配体,K562细胞中NKG2D配体表达率显著高于CD34+CD38-KG1a细胞,差异有统计学意义(P<0.05);K562细胞中几乎不表达HLA-Ⅰ,CD34+CD38-KG1a细胞高表达HLA-Ⅰ,CD34+CD38-KG1a细胞中HLA-Ⅰ的表达率显著高于K562细胞,差异有统计学意义(P<0.05)。
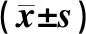
表2 K562和CD34+CD38-KG1a细胞表面NKG2D配体和HLA-Ⅰ分子的表达率
3 讨论
LSC不仅凋亡相关基因发生改变,其免疫原性也发生了改变(尤其在和免疫系统进行对抗作用后),如MHC抗原表达缺失或降低、黏附分子和共刺激分子表达下降、抗原加工提呈障碍、低表达NKG2D配体等,这些免疫原性改变使LSC能够逃逸免疫细胞识别和杀伤,最终发展为白血病[5]。NK细胞是机体的细胞毒性淋巴细胞,在杀伤肿瘤细胞的过程中,无需特异性抗原提呈,可直接发挥杀伤作用,比其他免疫细胞更直接、更迅速,在抗肿瘤免疫中起重要作用,是近年来过继性免疫治疗的新星[6]。
NK细胞的杀伤活性由其表面的活化性受体、抑制性受体传递的信号共同决定。NKG2D是NK细胞表面的主要活化性受体,其配体为ULBP,目前发现的成员有 ULBP1、ULBP2、ULBP3和MICA/B[7]。KIR是NK细胞表面主要抑制性受体,和肿瘤细胞表面的HLA- I类分子结合后传递抑制性信号[8]。KIR分子不同,识别并结合的HLA-I分子也不同[9],KIR2DL1识别HLA-Cw2、Cw4、Cw5和Cw6;KIR2DL2/2DL3识别HLA-Cw1、Cw3、Cw7和Cw8;KIR3DL1识别HLA-Bw4;KIR3DL2识别HLA-A3和A11;其余的KIR配体目前尚未完全明确[10]。NK细胞通过其表面2种受体与靶细胞表面配体相结合,传递不同信号,调节NK细胞的功能发挥。
本研究结果显示,CD34+CD38-KG1a细胞明显抵抗NK细胞的杀伤作用,即使在效靶比为20:1时,杀伤率仍小于15%,而K562细胞对NK细胞的杀伤作用高度敏感,在同一效靶比时NK细胞对K562细胞杀伤率显著高于CD34+CD38-KG1a细胞。进一步研究发现,K562细胞几乎不表达HLA-I分子,因此不能与NK细胞表面KIR受体结合传递抑制性信号,而活化性配体NKG2D高表达,导致杀伤信号明显增强,故K562细胞对NK细胞杀伤作用高度敏感。而CD34+CD38-KG1a细胞高表达HLA-I类分子,能与NK细胞表面KIR受体结合,传递抑制性信号;其基因型为A30、30,B51、78,Cw4、16。HLA-Cw4能与NK细胞表面的KIR2DL1分子识别;因此,CD34+CD38-KG1a细胞能通过Cw4-KIR2DL1途径向NK细胞传递抑制性信号。HLA-A30不能识别KIR3DL2和HLA-B51、78不能识别KIR3DL1、3DL2 配体,存在错配,传递活化信号;但是其活化性配体NKG2D几乎不表达,导致活化性信号较弱。2种信号作用NK细胞后抑制性信号占优势,导致CD34+CD38-KG1a细胞抵抗NK细胞的杀伤作用。
研究表明,NKG2D配体在白血病细胞中相对广泛的表达使其在诱导NK细胞毒性反应中起着重要作用,NKG2D配体下调或丢失可导致LSC抵抗免疫细胞杀伤作用[11]。LSC逃逸免疫细胞杀伤作用的能力,一部分是其固有的,一部分是在与免疫细胞相互作用中获得的[12]。因此,研究如何恢复或增强白血病细胞表面NKG2D配体的表达,或者干扰LSC的HLA基因或分子使之与KIR发生错配,将会为提高白血病免疫治疗效果提供一种新的思路。
