嗅觉障碍小鼠嗅上皮组织中Nogo受体及其配体Nogo-A的表达及意义
2019-09-25王慧敏闫义涛卢振民
周 航,王慧敏,闫义涛,卢振民,李 靖
(1.新乡医学院第一附属医院耳鼻咽喉科,河南 卫辉 453100;2.新乡医学院第一附属医院眼科,河南 卫辉 453100)
嗅觉功能障碍是神经退行性病变的主要表现[1]。嗅觉是人体的重要生理功能之一,正常人群中嗅觉功能障碍的发病率约为1.2%。嗅觉神经细胞是具有再生能力的神经元[2],Nogo受体(Nogo receptor,NgR)是位于神经元表面的糖基磷脂酰肌醇锚定蛋白,广泛存在于中枢神经系统中,NgR与其配体Nogo-A结合后发挥多种作用,对细胞的增殖、转移及神经的诱导、再生起重要作用[3]。而在嗅觉功能障碍发生及恢复过程中,NgR及其配体所起的作用尚不清楚,本研究采用TritonX-100建立嗅觉功能障碍小鼠模型,探讨NgR及其配体在嗅觉功能障碍发生及恢复过程中的作用。
1 材料与方法
1.1 实验动物8~10周无特定病原体BALB/C小鼠100只,雌雄不拘,体质量25~30 g,由上海西普尔-必凯实验动物有限公司提供。
1.2 主要试剂与仪器TRIzol试剂盒、聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自日本TaKaRa公司,兔抗鼠Nogo-A单克隆抗体、兔抗鼠NgR单克隆抗体购自英国Abcam公司,辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗兔二抗购自上海碧云天生物有限公司,Nogo-A-1酶联免疫吸附试验测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国Sigma公司;BD光学显微镜购自深圳博士达光学仪器有限公司,HH-ZKS4电热恒温水浴箱购自上海科升仪器有限公司,反转录-PCR(reverse transcription- PCR,RT-PCR)仪购自美国ABI公司。
1.3 实验方法
1.3.1 嗅觉功能障碍模型制备及组织标本采集将小鼠随机分为对照组(n=20)和模型组(n=80)。将Triton X-100用生理盐水稀释为体积分数0.7%的实验试剂,用钝头微量注射器将100 μL体积分数 0.7% Triton X-100溶液注入模型组小鼠双侧鼻腔,注射速度为100 μL·min-1。对照组小鼠同样的方法注射100 μL生理盐水[4]。参照文献[5]的方法,2组小鼠分别于造模后3、7、21、49 d给予埋藏食物颗粒实验,记录觅食时间;小鼠在300 s(5次测试的均值)内未找到食物颗粒即判定嗅觉功能障碍模型建立成功。对照组及模型组小鼠于造模后3、7、21、49 d断头处死,收集小鼠嗅上皮组织,一部分于液氮冻存,用于检测Nogo-A、NgR mRNA和NgR、Nogo-A蛋白的表达,一部分经体积分数10%甲醛溶液固定、常规石蜡包埋,用于免疫组织化学检测。
1.3.2 免疫组织化学法检测小鼠嗅上皮组织中NgR蛋白表达取组织切片,室温复温 20 min,体积分数0.3%H2O2常温孵育30 min;磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,每次5 min;滴加用PBS稀释的兔抗鼠NgR一抗(1:100),阴性对照以PBS代替一抗,4 ℃孵育箱中过夜;PBS洗3次,每次5 min;滴加HRP标记的山羊抗兔二抗(1:1 000),室温孵育30 min;PBS洗3次,每次5 min;滴加过氧化物酶标记的链霉亲和素复合物(1:100),室温孵育20 min;PBS 洗3次,每次5 min;用新鲜配制的 3,3′二氨基联苯胺溶液显色,蒸馏水终止显色;滴加苏木精复染1 min;漂洗干净,返蓝 5 min;梯度乙醇脱水,二甲苯透明;中性树胶封片。选取5个视野,每个视野200个细胞,观察小鼠嗅上皮组织中NgR表达情况,细胞膜褐色部分即为NgR表达,阳性细胞所占比例即为NgR阳性表达率。
1.3.3 RT-PCR检测嗅上皮组织中Nogo-A及NgR mRNA表达取液氮冻存组织,复温后采用RT-PCR法检测Nogo-A、NgR mRNA的表达,操作严格按照试剂盒说明书进行。采用TRIzol提取总RNA,反转录cDNA后备用。根据试剂盒检测说明用PCR检测嗅上皮组织中Nogo-A与NgR的表达水平。Nogo-A上游引物序列为5′-CGCTGGT-GCTTCTGTAGTGC-3′,下游引物序列为5′-CTTTGT-GCTGGGCTACTG-3′;NgR上游引物序列为5′-TTCTGACATTAAGGGCCGTG-3′,下游引物序列为5′-CCAGCCCACACTTCTCTCTC-3′;β-actin上游引物序列为5′-CTTCCTGGGCATGGAGTCCTG-3′,下游引物序列为5′-GGAGCAATGATCTTGATCTTC-3′。PCR反应体系:上、下游引物各0.4 μ L,Taq聚合酶 10 μL,模板2 μL,双蒸水7.6 μL。PCR反应条件:42 ℃ 60 min,95 ℃ 5 min,30个循环。扩增目的基因的同时扩增β-actin基因。采用2-△△Ct法计算目的基因的相对表达量。
1.3.4 Western blot法检测嗅上皮组织中NgR蛋白表达取液氮冻存组织,复温后进行研磨,根据试剂盒说明书提取蛋白,按照 50 μg 蛋白的溶液体积为上样量,向其中加入5×十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)上样缓冲液,调为l×SDS,沸水中变性10 min;将预先制备好的聚丙烯酰胺凝胶(polyacrylamide gel,AGE)安装于电泳槽中,加电泳液,用微量进样器紧贴离心壁加入样品。样品经质量分数10%SDS-AGE胶120 V电泳至分离后换 80 V 电泳 60 min,300 mA恒流转膜45 min;将膜用洗膜缓冲液(tris-buffered saline Tween,TBST)从下至上浸湿后,质量分数5%脱脂牛奶封闭2 h;TBST洗膜10 min。加入兔抗鼠的抗NgR一抗(1:100稀释),4 ℃孵育箱中孵育过夜;洗膜3次,加入相应的山羊抗兔的HRP标记的二抗,室温孵育2 h,暗室压片,曝光,显影,定影。以兔抗鼠单克隆抗体 β-actin(1:1 000)为内参照,应用Image J 1.49软件分析Western blot内参条带与目的条带的灰度比值。
1.3.5 ELISA测定嗅上皮组织中Nogo-A蛋白表达将嗅上皮组织研碎,按照 10 mg 组织对应100 μL PBS的比例进行匀浆,1 500 r·min-1离心5 min,吸取上清液,-80 ℃冰箱保存待测。采用ELISA法测定上清液中Nogo-A蛋白表达水平,操作严格按照试剂盒说明书进行。
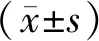
2 结果
2.1 2组小鼠嗅觉功能比较对照组小鼠觅食时间为(70.1±15.2)s;模型组小鼠造模后3、7、21、49 d 觅食时间分别为(469.2±20.4)、(495.1±31.1)、(290.3±23.3)、(130.6±28.2)s。模型组小鼠造模后3、7、21 d觅食时间长于对照组及造模后 49 d,差异有统计学意义(P<0.05)。模型组小鼠造模后49 d觅食时间与对照组比较差异无统计学意义(P>0.05)。
2.2 2组小鼠嗅上皮组织中NgR阳性表达率比较结果见图1。模型组小鼠嗅上皮组织中NgR阳性表达较对照组显著增强。对照组小鼠嗅上皮组织中NgR阳性表达率为18.19%(30/160),模型组小鼠造模后3、7、21、49 d嗅上皮组织中NgR阳性表达率分别为61.21%(101/165)、84.85%(140/165)、69.10(114/165)、48.48%(80/165),模型组小鼠造模后3、7、21、49 d 嗅上皮组织中NgR阳性表达率显著高于对照组,差异有统计学意义(χ2=36.235、35.483、41.876、40.908,P<0.05)。
A:对照组;B:模型组造模后3 d;C:模型组造模后7 d;D:模型组造模后21 d;E:模型组造模后49 d。
2.3 2组小鼠嗅上皮组织中NgR、Nogo-A mRNA相对表达量比较结果见表1。模型组小鼠造模后3、7、21、49 d嗅上皮组织中NgR、Nogo-A mRNA相对表达量均高于对照组,差异有统计学意义(P<0.05)。
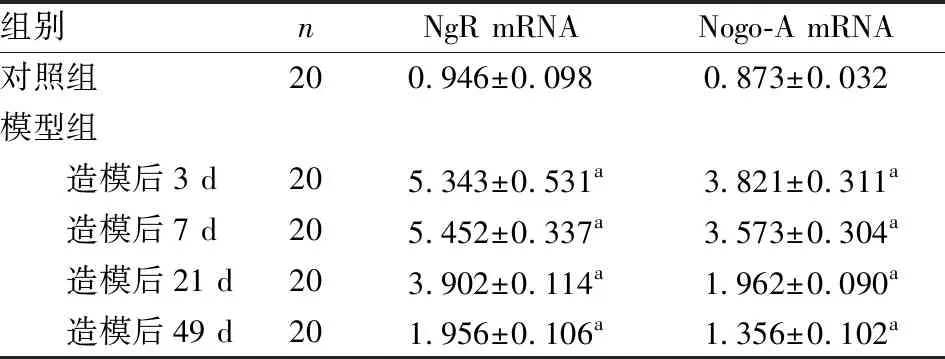
表1 2组小鼠嗅上皮组织中NgR、Nogo-A mRNA相对表达量比较
注:与对照组比较aP<0.05。
2.4 2组小鼠嗅上皮组织中NgR蛋白相对表达量比较结果见图2。对照组嗅上皮组织中小鼠NgR蛋白相对表达量为0.22±0.04;模型组造模后3、7、21、49 d小鼠嗅上皮组织中NgR蛋白相对表达量分别为 0.85±0.03、0.87±0.02、0.86±0.02、0.39±0.01。模型组小鼠造模后第3、7、21、49 d嗅上皮组织中NgR蛋白相对表达量均高于对照组,差异有统计学意义(P<0.05)。
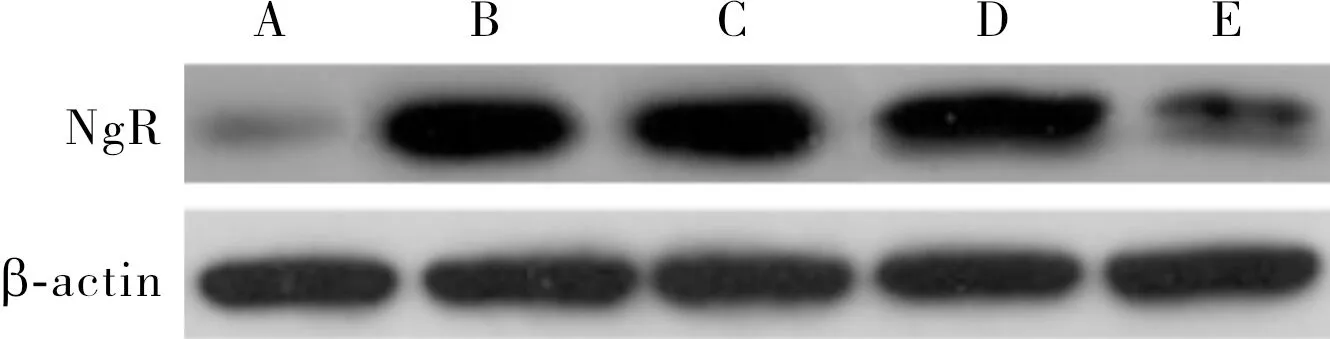
A:对照组;B:模型组造模后3 d;C:模型组造模后7 d;D:模型组造模后21 d;E:模型组造模后49 d。
2.5 2组小鼠嗅上皮组织中Nogo-A蛋白表达比较对照组小鼠嗅上皮组织中Nogo-A蛋白表达量为(30.1±4.5)μg·L-1;模型组小鼠造模后第3、7、21、49 d嗅上皮组织中Nogo-A蛋白表达量分别为(485.2±6.3)、(490.3±5.1)、(243.2±10.1)、(123.6±4.5)μg·L-1。模型组小鼠造模后第3、7、21、49 d嗅上皮与嗅球组织中Nogo-A蛋白表达量高于对照组,差异有统计学意义(P<0.05)。
3 讨论
嗅觉功能障碍与多种疾病密切相关,且嗅觉功能障碍也是退行性疾病的早期信号,严重影响患者的生活质量[6]。嗅觉受体神经细胞是具有再生能力的神经元,虽然嗅觉功能障碍的治疗取得了一定效果,但是仍有部分患者的嗅觉功能难以得到改善。嗅觉功能障碍的机制仍不十分清楚。Nogo蛋白是髓磷脂相关生长抑制蛋白的一种,在中枢神经系统轴突再生中发挥重要作用[7]。Nogo-A是含有1 163个氨基酸的大蛋白分子[8],是Nogo的重要组成部分[9]。Nogo-A通过与NgR在神经纤维上结合而抑制其再生。本研究采用体积分数0.7%的Triton X-100建立小鼠嗅觉障碍模型,该模型未毁坏嗅上皮的基底膜,所以嗅觉可恢复,可以动态观察嗅觉功能障碍小鼠的嗅觉变化过程。本研究结果显示,造模后3 d,模型组小鼠的觅食时间明显延长,且大于300 s,说明造模成功。造模后21 d,模型组小鼠的觅食时间开始较之前缩短,小鼠的功能障碍开始恢复;造模后49 d,模型组小鼠觅食时间与对照组比较差异无统计学意义,与王渊等[10]报道结果一致。
NgR是一种磷脂酰肌醇锚定蛋白,位于神经元的表面,是神经系统可塑性的重要抑制因子[11],与其受体结合后可以抑制轴突的生长、延长。本研究通过免疫组织化学法对NgR进行定性定量分析发现,模型组小鼠嗅上皮组织中NgR蛋白表达增加,在嗅觉恢复过程中NgR蛋白表达有所减少。通过RT-PCR分析发现,模型组小鼠造模后3、7 d嗅上皮组织中Nogo-A mRNA的表达明显升高,造模后21、49 d虽有所下降,但仍明显高于对照组。ELISA检测Nogo-A的表达得出相似的结果,提示NgR参与神经损伤及修复过程,从而参与嗅觉障碍过程。在既往的研究中,炎症及脑损伤后NgR及其配体可影响星形胶质细胞的形态,从而影响脑损伤的恢复过程[12],调节NgR信号通路可使脑损伤后躯体协调能力、认知功能等得到恢复,提示NgR参与了脑损伤的恢复过程。这与本研究结果相一致。而Nogo-A在炎症反应中可促进经背根神经节传导的热痛觉过敏[13],也可以与NgR作用后通过调节PC12 细胞中的WNK1信号通路来抑制神经元轴突的延长,从而影响神经损伤的恢复过程[14]。另一方面,Nogo-A在缺血性中枢系统疾病中抑制了血管的再生,抗Nogo-A 抗体可以保护神经元免遭缺血损伤,加快血管修复,提高血流灌注,从而为神经系统的修复提供营养[15]。本研究发现,Nogo-A表达水平在小鼠嗅觉障碍模型中升高,随着嗅觉障碍功能的恢复Nogo-A表达水平下降。另有研究表明,在大鼠模型中,电针刺激大脑缺血灶可通过下调 Nogo-A/NgR信号通路的作用为轴突再生提供低水平的抑制环境[16],促进神经修复;阻断Nogo-A与NgR的作用后可以促进神经元功能恢复[17]从而促进神经生长及延长;说明NgR及其配体Nogo-A参与了神经修复的过程,下调NgR及其配体Nogo-A的表达及阻断其相互作用可能促进小鼠嗅神经元恢复及嗅觉障碍改善。
综上所述,在小鼠嗅觉障碍模型中,小鼠嗅上皮组织中NgR与Nogo-A表达增加,Nogo-A与NgR结合后可能参与嗅觉障碍的发生、发展。下调NgR及其配体Nogo-A的表达并阻断其相互作用,有望为嗅觉障碍的治疗提供一个新思路。
