一种改良的Sprague Dawley新生大鼠视网膜Müller细胞培养方法
2019-09-25袁容娣
杨 梅,范 围,黄 瑶,袁容娣
(中国人民解放军陆军军医大学第二附属医院眼科,重庆 400037)
Müller细胞是视网膜特有的神经胶质细胞,也是视网膜内最重要的神经胶质细胞,在视网膜的病理、生理过程中扮演着重要角色[1]。数量上,它是视网膜内数量最多的胶质细胞;结构上,Müller细胞从光感受器开始至内界膜结束,横跨分布于整个视网膜,可维持视网膜的正常结构;功能上,其同时具备星形胶质细胞和少突胶质细胞的功能,可维持细胞微环境的平衡,还能分泌大量的神经营养因子,对视网膜神经元起到支持、滋养的作用。Müller细胞的体外培养技术可为视网膜病变的细胞生物学、发育学和电生理学等研究提供一个重要平台。因此,在体外建立稳定的Müller细胞培养体系对于研究Müller细胞在视网膜中的生理、病理作用具有重要意义。Müller细胞培养技术的关键是细胞纯化,细胞纯化方法主要有机械吹打法、恒温摇床法、胰蛋白酶消化法等[2-4],这些方法均利用了Müller细胞较视网膜组织中其他细胞贴壁紧的原理。机械吹打法吹打力度和次数不易掌控,影响细胞的活性;恒温摇床法需要在摇床震荡4~6 h,在外界暴露时间过长,操作繁琐,还有加重污染的风险;而胰蛋白酶消化法虽较前2种方法简单,但在试验中发现,单纯用胰蛋白酶消化存在细胞纯度不高的问题,而过度消化又会损伤细胞。为了找到一种操作简单、细胞纯度更高的培养方法,作者结合本实验室条件,改良出一种Sprague Dawley(SD)新生大鼠视网膜Müller细胞培养方法,此方法操作简单,获得的细胞纯度高,现报道如下。
1 材料与方法
1.1 实验动物新生1~2 d的SD大鼠,雌雄不限,由陆军军医大学野战外科研究所实验动物中心提供,本研究经陆军军医大学第二附属医院伦理委员会批准。
1.2 主要试剂与仪器高糖达尔伯克改良伊戈尔培养基(Dulbecco′s modified Eagle medium,DMEM) 购自美国Hyclone公司,胎牛血清、2.5 g·L-1胰蛋白酶购自美国Gibco公司,小鼠抗Vimentin单克隆抗体购自英国Abcom公司,荧光二抗(488)标记羊抗小鼠IgG购自英国Thermo公司,小鼠抗NeuN单克隆抗体购自美国Millpore公司;离心机、细胞培养箱、倒置荧光显微镜购自美国Thermo公司。
1.3 方法
1.3.1 Müller细胞原代培养将新生SD大鼠浸泡于体积分数75%乙醇中2 min,断头处死,摘除眼球,将眼球直接浸泡在含体积分数1%双抗(100 U·mL-1青霉素及100 g·L-1链霉素)的高糖DMEM培养基中,置于37 ℃、含体积分数5%CO2的培养箱中过夜。去除浸泡眼球的培养基,加入 2.5 g·L-1胰蛋白酶溶液,置于37 ℃、含体积分数5%CO2的培养箱中消化1 h,加入含体积分数10%胎牛血清的DMEM终止消化;将眼球移入另一个无菌培养皿中,在高倍显微镜下分离视网膜,收集于无菌离心管中,加入含体积分数10%胎牛血清的DMEM,反复吹打,制成细胞悬液,用70 μm的滤网过滤细胞悬液,调整细胞密度,按3×105L-1接种于培养瓶中,置于 37 ℃、含体积分数5%CO2的培养箱过夜;第2天观察细胞贴壁情况,更换培养液,继续培养6~8 d,细胞密度达到80%予以传代。
1.3.2 Müller细胞传代与纯化去除培养瓶中的培养基,加入2.5 g·L-1胰蛋白酶液1 mL,轻晃培养瓶,1 min后吸除胰蛋白酶溶液,重复操作2次,以去除贴附能力较差的杂细胞,纯化Müller细胞。再加入2.5 g·L-1胰蛋白酶溶液2 mL,反复吹打瓶底,镜下观察见细胞绝大部分变圆、悬浮,立即加入含体积分数10%胎牛血清的DMEM 2 mL终止消化;将培养瓶中的细胞悬液全部转移至无菌离心管中,1 000 r·min-1离心5 min,去上清液,加入含体积分数10%胎牛血清的DMEM,调整细胞密度,按3×105L-1接种于培养瓶中,置于37 ℃、含体积分数5% CO2的培养箱中培养4~6 d,细胞密度达到80%时进行传代。
1.3.3 视网膜神经元纯度鉴定收集第3代Müller细胞,以1.5×105L-1接种于放有载玻片的24孔板中,于37 ℃、含体积分数5%CO2的培养箱中培养48 h,去除培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,每次3 min,40 g·L-1多聚甲醛室温下固定15 min,PBS洗3次,每次 3 min;体积分数0.1% Triton X-100 室温透膜 15 min,PBS洗3次,每次3 min;体积分数10%山羊血清封闭1 h,弃血清;加入一抗小鼠抗NeuN单克隆抗体(1:500);另取一孔用PBS代替一抗做阴性对照,4 ℃ 孵育过夜。PBS洗3次,每次3 min,加入荧光二抗(488)标记羊抗小鼠IgG(1:300),室温避光孵育1 h,PBS洗3次,每次3 min,1:2 000的Hoechst33342染核2 min,PBS洗3次,每次3 min。取出孔底载玻片,防荧光淬灭封片剂封片。分别在载玻片上、下、左、右、正中5个方向随机取5个视野拍照,计数NeuN荧光(绿色)染色阳性细胞数目,神经元纯度=NeuN 阳性表达细胞数/Hoechst 33342核染阳性细胞总数×100%。。
1.3.4 Müller细胞纯度鉴定取“1.3.3”项下体积分数10%山羊血清封闭1 h的细胞,弃血清,加入一抗小鼠抗Vimentin单克隆抗体(1:100),PBS代替一抗做阴性对照,4 ℃孵育过夜。去一抗,PBS洗3次,每次3 min,加入荧光二抗(488)标记羊抗小鼠IgG(1:300),室温避光孵育1 h,去二抗,PBS洗3次,每次3 min,1:2 000的Hoechst33342染核 2 min,PBS洗3次,每次3 min。取出孔底载玻片,防荧光淬灭封片剂封片。分别在载玻片上、下、左、右、正中5个方向随机取5个视野拍照,计数Vimentin荧光染色阳性细胞数目,Müller细胞纯度=Vimentin阳性表达细胞数/Hoechst 33342核染阳性细胞总数×100%。
2 结果
2.1 原代及传代培养细胞生长情况培养24 h后,部分细胞已贴壁生长,散在分布;培养3 d后,细胞胞体狭长,密度约40%;培养6~8 d后,细胞已形成融合状态,细胞体变大,细胞质丰富,细胞核呈圆形或椭圆形,密度约80%;传至第4代的细胞形态不一,有突起,细胞体宽大,细胞质丰富,细胞核呈圆形或椭圆形,见图1。
2.2 神经元纯度鉴定将传至第4代的原代细胞行NeuN和Hoechst33342免疫荧光染色,各视野均无阳性表达细胞,提示无神经元共生长。
2.3 Müller细胞纯度鉴定传至第4代的细胞行Vimentin和Hoechst33342免疫荧光双染,镜下可见大量Vimentin阳性细胞,Müller细胞纯度>95%;见图2。

图1 传代培养至第4代的Müller细胞形态(倒置显微镜,×100)
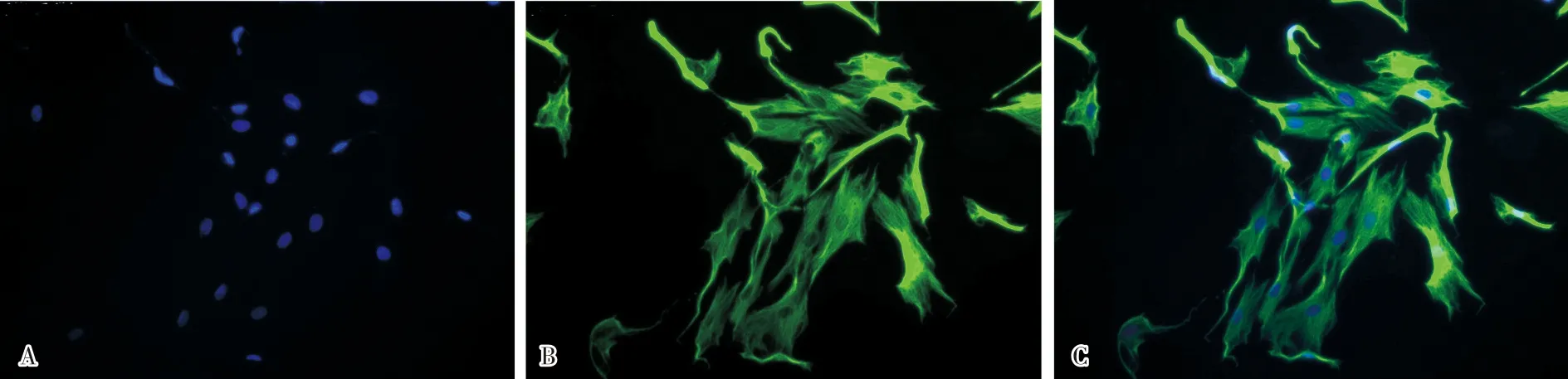
A:Hoechst33342免疫荧光核染;B:Vimentin免疫荧光细胞质染色;C:A、B图的融合。
3 讨论
Müller细胞是视网膜特有的一种神经胶质细胞,在视网膜中发挥着重要的病理、生理作用,体外培养Müller细胞是研究其病理、生理作用的重要手段[5-6]。然而,SD大鼠视网膜中细胞成分复杂,除了Müller细胞外,还含有星形胶质细胞、血管内皮细胞、神经元、少突胶质细胞等,将其中的Müller细胞分离、纯化培养是该细胞培养方法的核心步骤。目前,根据Müller细胞比重、贴壁时间、黏着力、细胞寿命等方面的特性,培养和纯化Müller细胞的方法较多,但各有优劣。酶消化法[7-8]和恒温振荡法[9]是最常用的Müller细胞纯化方法,其原理均是利用Müller细胞较其他细胞容易贴壁的特点,对Müller细胞进行较好的分离和纯化,但也存在着早期神经元共生长、分离视网膜操作较困难、暴露于外界时间长、易污染等不足之处。
本研究对体外培养Müller细胞的方法进行了3个方面的改良。首先,取出眼球后将其浸泡于含体积分数1%双抗的无血清DMEM培养基中,在 37 ℃、含体积分数5%CO2的培养箱中孵育过夜。在这个孵育过程中,眼球组织处于一种缺氧的状态,神经元和星形胶质细胞因耐受缺氧能力差而受损,而Müller细胞的耐受缺氧能力较强,在孵育过程中更利于其分裂[10]。而后,将眼球消化1 h,再分离视网膜,这与其他文献[11]报道的先分离视网膜,再对视网膜消化的方法也有所不同。本研究中,眼球被整个消化,更有利于分离视网膜。由于选取的动物较小,分离视网膜时较难操作,而眼球消化1 h后,体积有所增大,组织变软、变松,在去除眼前节时眼球不易滚动,更易操作,而视网膜也更易剥脱。在细胞传代时,由于Müller细胞的贴附性最强,用胰蛋白酶反复消化2次,留取最终仍然贴壁的细胞传代,以达到纯化Müller细胞的目的,较恒温震荡法节省时间,减少了细胞污染的机会,并且比其他酶消化法多使用一次胰蛋白酶消化,对Müller细胞的筛选更严格。
视网膜中存在3种胶质细胞,即Müller细胞、星形胶质细胞和小胶质细胞。Vimentin是视网膜中Müller细胞的特异性表达蛋白[12],因此,本研究采用Vimentin鉴定Müller细胞,Vimentin荧光染色阳性的细胞为Müller细胞。本研究荧光染色鉴定结果显示,视野下无NeuN阳性核染细胞,说明无神经元共生长情况,而Vimentin阳性表达细胞占比>95%,均为Müller细胞。
综上所述。本研究改良的SD新生大鼠视网膜Müller细胞培养方法操作简单,纯度高,是一种切实可行的实验方法。
