慢性乙型病毒性肝炎合并侵袭性肺真菌感染的临床及影像学特点
2019-09-25唐吉仙张春意沈巨信蒲桂梅
唐吉仙 张春意 沈巨信 蒲桂梅
在中国,慢性乙型病毒性肝炎(简称慢性乙肝)是导致肝硬化、肝衰竭等的主要病因,慢性乙肝及其主要并发症(肝硬化和肝衰竭)都可导致肝脏解毒能力下降、机体免疫功能低下、微生态环境失衡及机会性真菌感染日益增多。慢性乙肝患者由于低蛋白血症、单核巨噬细胞系统功能严重受损、白细胞黏附趋化及吞噬功能降低等成为真菌感染的易感人群,引起临床的高度关注。本研究对40例慢性乙肝合并侵袭性肺部真菌感染(invasive pulmonary fungal infection,IPFI)患者的临床资料进行回顾性分析,以期提高对慢性乙肝合并IPFI的认识。
1 对象和方法
1.1 对象 选取2013年6月至2018年6月在本院住院并确诊的慢性乙肝合并IPFI的患者40例为研究对象,其中男 29 例,女 11 例,年龄 20~76(53.0±13.4)岁。纳入标准:18~80岁的慢性乙肝合并IPFI的患者;排除标准:排除慢性乙肝合并器官移植、恶性肿瘤、HIV等疾病的患者。
1.2 诊断标准 乙型病毒性肝炎以2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修正的《病毒性肝炎防治方案》为诊断标准[1]。IPFI确诊的诊断标准参照2006年中华内科杂志编委会拟订的《IPFI的诊断标准与治疗原则》[2]。
1.3 肺部CT图像分析 由2位影像医师分析CT征象,并判断是否存在磨玻璃影(GGO)、实变、网格或线样影、结节、胸腔积液。GGO定义为肺密度增高,但不遮盖血管影;实变定义为遮盖血管影的肺密度增高;网格或线样影表现为无数交错的线样影组成网格状或狭长细线样,呈软组织密度[3]。
1.4 统计学处理 采用SPSS 19.0统计软件。计量资料以表示;计数资料用率表示,组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 慢性乙肝合并IPFI患者的病原菌构成及标本来源 40例患者中肺隐球菌19例(47.5%),肺曲霉菌18例(45.0%),肺孢子菌3例(7.5%)。标本来源包括痰培养13例(32.5%),均为肺曲霉菌;经支气管镜肺泡灌洗液培养3例(7.5%),其中肺曲霉菌1例(2.5%),肺孢子菌2例(5.0%);经支气管镜肺活检4例(10.0%),其中肺曲霉菌2例(5.0%),肺隐球菌1例(2.5%),肺孢子菌1例(2.5%);经皮肺穿刺活检20例(50.0%),其中肺曲霉菌2例(5.0%),肺隐球菌18例(45.0%)。
2.2 慢性乙肝合并IPFI患者的临床特点 本文40例慢性乙肝合并IPFI患者在临床表现上无特异性,表现为发热 14例(35.0%)、咳嗽、咳痰 12例(30.0%)、咯血 10例(25.0%)、胸痛2例(5.0%)以及胸闷、气促2例(5.0%)等;其中肺曲霉菌感染患者老年(>65岁)、入院时高谷丙转氨酶水平(>400U/L)、低白蛋白水平(<30g/L)、慢加急性肝衰竭、合并肝硬化或肺结构病比例均高于隐球菌感染患者,差异均有统计学意义(均P<0.05),见表1。
2.3 慢性乙肝合并IPFI患者的CT征象 本文40例慢性乙肝合并患者CT征象中出现最多的为结节,达30例(75.0%),其他依次为合并空洞11例(27.5%)、实变5例(12.5%)、磨玻璃影5例(12.5%)。在病灶分布方面,肺曲霉菌感染的支气管走向分布比例高于肺隐球菌感染,而胸膜分布比例低于肺隐球菌感染,差异均有统计学意义(均P<0.01);在病灶的表现形式方面:结节、实变、磨玻璃影、合并空洞,肺隐球菌感染与肺曲霉菌感染差异均无统计学意义(均P>0.05),见表2。3例肺孢子菌患者CT均表现为弥漫性磨玻璃影。3种真菌感染患者的典型CT征象见图1。
2.4 治疗转归 40例慢性乙肝合并IPFI患者中,死亡3例(7.5%),均为曲霉菌感染且合并慢加急性肝衰竭,血谷丙转氨酶均>400U/L。
3 讨论
以往人们对侵袭性真菌感染(invasive fungal infection,IFI)的研究大多集中在HIV、器官移植、肿瘤、糖尿病等一些免疫缺陷或慢性消耗性疾病上,很少关注乙型肝炎患者中IFI的发病情况。有研究报道,只有部分免疫机制不完善的患者(主要为婴幼儿及青少年)在感染乙型肝炎病毒(HBV)后才会进展为慢性乙肝,在慢性乙肝进展过程中,HBV DNA持续复制起关键作用,而天然免疫和获得性免疫均可受到HBV DNA的抑制[4]。Visvanathan等[5]发现,慢性乙肝患者存在人Toll样受体2、库夫氏细胞、树突状细胞、自然杀伤细胞数量下调的特征。在获得性免疫中,HBV DNA可引起HBV特异性CD4+、CD8+的下调,HbsAg 可减少 IL-12、IL-18 及 IFN的数量[6]。因此,持续HBV DNA的复制使不完善的免疫系统进一步受到损伤,为IFI的发病提供了条件。
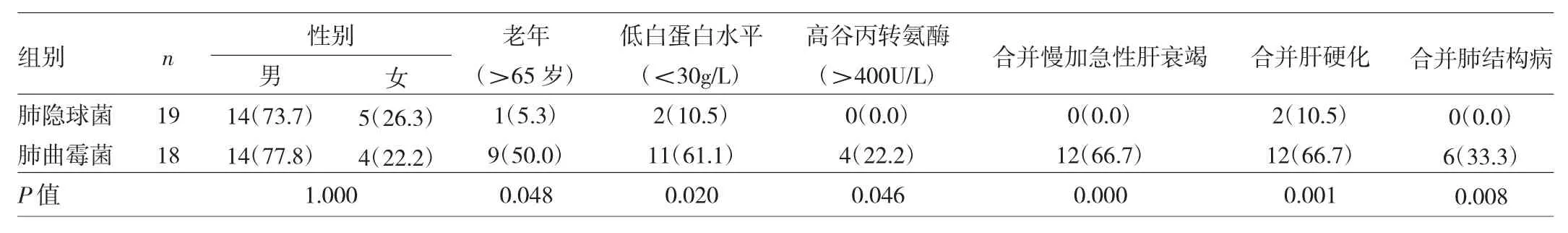
表1 肺隐球菌与肺曲霉菌患者的临床特点比较[例(%)]

表2 肺隐球菌与肺曲霉菌患者的CT征象比较[例(%)]
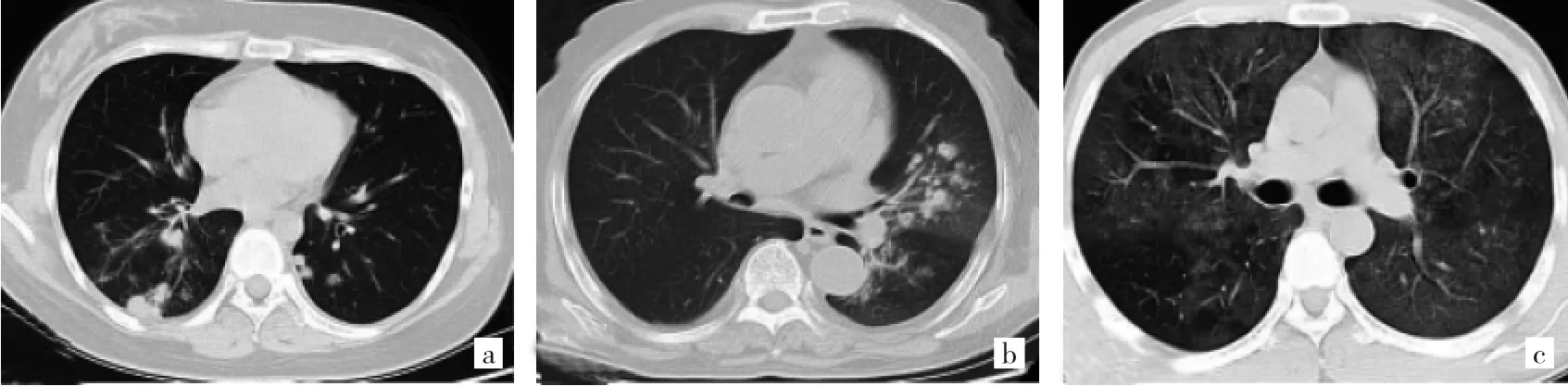
图1 3种肺真菌感染的CT表现(a:肺隐球菌病,胸部CT表现为两肺下叶靠近胸膜多发结节、团块影;b:肺曲霉菌病,胸部CT表现为左侧沿支气管走行的多发斑片状、结节状高密度影,边界欠清,部分内见小空洞;c:肺孢子菌病,胸部CT表现为两侧肺内见弥漫多发大片状淡模糊高密度影,边缘不清,内密度不均匀)
本研究发现在40例慢性乙肝合并IPFI患者中,以隐球菌和曲霉菌感染为主,孢子菌少见。临床症状多表现为发热、咳痰、咯血等,无特异性表现及分布。本研究数据显示男女性别对IPFI的影响差异无统计学意义。老年(>65岁)、高谷丙转氨酶(>400U/L)、低蛋白血症(<30g/L)的慢性乙肝患者合并肺曲霉菌病的比例高于肺隐球菌病;在慢加急性肝衰竭、肝硬化、肺结构病的基础上,慢性乙肝患者更易感染肺曲霉菌病。因此,老年慢性乙肝患者,存在低蛋白血症、谷丙转氨酶升高、慢加急性肝衰竭、肝硬化,肺结构性病的因素越多,发生侵袭性肺曲霉菌病的可能性越大。故治疗方面,在积极应用抗真菌感染的同时,应密切关注肝功能、白蛋白的动态变化,加强护肝、补充白蛋白等基础治疗[7]。
胸部CT检查有助于慢性乙肝合并IPFI的诊断,但该病CT表现多样,特征性征象较少,常为各种表现混合存在。在本研究病例中,多数患者的CT表现为结节、实变、空洞、磨玻璃样等征象共存,形态分布均无特征性。结节多发,可见空洞,和文献报道一致[8]。在40例慢性乙肝患者中,18例合并肺曲霉菌的患者多数在原有肺疾病基础上临床症状加重和(或)肺部CT出现由轻变重的典型变化,出现多发斑片、实变、合并空洞,部分病灶为支气管走向分布,胸膜下分布少见;19例合并肺隐球菌的患者胸部CT多表现为结节、实变、空洞等征象共存,以胸膜下分布为主,亦有支气管走向分布;3例合并肺孢子菌的患者肺部CT早期表现为小片磨玻璃影,病情进展表现为两肺弥漫性磨玻璃样影。在慢性乙肝患者中,尤其合并慢加急性肝衰竭患者的CT表现缺乏特异性,与一般肺部感染、肺结核及肺癌等在影像学上鉴别诊断困难时,需要结合临床实验室资料、病变分布及病变演变才能作出明确诊断。虽然本研究获得有统计学意义的结论较少,但各种致病菌肺部感染的表现仍存在一定差异。在慢性乙肝患者中,高龄、低蛋白血症、高谷丙转氨酶越明显,合并症越多,若同时出现支气管走向分布的结节、空洞的影像学改变,则合并肺曲霉菌感染的比例高于肺隐球菌;如出现广泛的磨玻璃样改变,应考虑到肺孢子菌感染的可能。如患者长期大量应用广谱抗生素,有免疫抑制剂病史及人工肝治疗病史,常规抗炎治疗无效等均应考虑到真菌感染可能[9-10],多次痰培养、血培养、支气管镜检查及经皮肺穿刺活检有较大的诊断价值。
综上所述,肺部感染是慢性乙肝、尤其是并发肝硬化或慢加急性肝衰竭患者中较常见的一种并发症,严重影响患者肝功能及其预后。因此,早期预防IPFI的发生非常必要,尤其对年龄较大,且并发肝硬化、低白蛋白、肺结构病的患者尤为重要。在临床上,可根据患者自身基础因素、影像学特点来预测IPFI的类型,提早进行早期抗真菌治疗。有效并严密监测患者IPFI的发病情况,可进一步改善预后、降低并发症发病率,有效的改善患者的生存质量。
