Foxp3和CD8+T细胞在乳腺癌组织中的表达及与预后的关系
2019-09-25付媛媛徐锦波张敏陈述政程雪
付媛媛 徐锦波 张敏 陈述政 程雪
乳腺癌是女性最常见的恶性肿瘤之一,并且是女性肿瘤患者死亡的主要原因。随着对乳腺癌发生发展机制的深入研究,肿瘤免疫微环境已成为研究热点问题之一。免疫微环境在肿瘤的发生、发展和患者的预后中都起到决定性的作用。肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TILs)主要反映局部免疫反应,在肿瘤进展过程中起了至关重要的作用[1]。CD8+T细胞介导Ⅰ型免疫反应,可增强CD8+和CD4+T细胞的积聚,促进其抗肿瘤作用[2]。在乳腺癌中,肿瘤浸润性CD8+T细胞与患者生存期[3]和对治疗的反应密切相关[4]。调节性T细胞
(regulatory T cell,Tregs)是T淋巴细胞的亚家族之一,也被称之为抑制性T淋巴细胞。叉头状转录因子p3(forkhead box protein3,Foxp3) 是 CD4+CD25+Tregs的特异性生物标志,其在肿瘤免疫中也发挥了重要作用[5]。本研究采用免疫组化法评估乳腺癌组织中Foxp3阳性Tregs和CD8+T细胞的表达情况,分析其与乳腺癌患者临床病理因素及预后的关系。
1 资料和方法
1.1 一般资料 选取2010年1月至2013年12月在本院乳腺外科住院并行手术治疗的患者78例,均为女性,术后病理检查确诊为浸润性导管癌,年龄28~81(52.2±20.3)岁;排除标准:术前采用过任何形式的化疗患者。收集患者肿瘤大小、淋巴结转移情况、肿瘤分期、分化程度及其他临床病理资料,临床分期采用TNM国际分期标准。根据2013年St.Gallen乳腺癌国际会议上规定的乳腺癌分子分型分类标准[6],将乳腺癌分为5类:Luminal A、Luminal B(HER-2 阴性)、Luminal B(HER-2阳性)、HER-2过表达及Base-like(三阴)型。患者术后均接受以紫杉类(包括紫杉醇、多西他赛)和(或)蒽环类(包括表柔比星、吡柔比星、多柔比星)为基础的化疗,每3周为1个疗程,整个治疗时间有4~8个周期。人类表皮生长因子受体2(HER-2)阳性患者均联合使用曲妥珠单抗靶向治疗。
1.2 主要试剂 一抗选用兔抗人Anti-Foxp3 antibody[SP97](ab99963)、小鼠抗人Anti-CD8 antibody(ab59480)均购自英国ABcam公司;即用型快捷免疫组化试剂盒(Maixin Reagent)购自福州迈新生物技术有限公司;二氨基联苯胺(3,3-diaminobenzidine,DAB)显色剂购自北京中杉金桥生物技术有限公司。
1.3 Foxp3与CD8+表达的检测 采用免疫组化法。10%甲醛溶液固定标本,常规石蜡包埋后连续切取6~8张4μm薄片,分别置于阳离子防脱片后脱蜡、水合,然后用柠檬酸盐缓冲液修复Foxp3和CD8,将玻片完全浸没于3%双氧水中,避光室温孵育10min。血清封闭,分别向玻片滴加稀释后的一抗 Foxp3(1∶100)及CD8(1∶100),放在保湿盒内后置 4℃冰箱孵育,第 2 天取出保湿盒,并在常规冲洗后用二抗37℃孵育30min。DAB染色后,再用苏木素染色胞核1~2min,分化后再次温水返蓝15~30s,最后置于显微镜下观察染色及分化程度。梯度乙醇脱水,并用中性树胶封片后保存。光学显微镜下(×400)观察拍照。Foxp3在细胞核中呈棕色或棕褐色为阳性表达,CD8在细胞膜呈棕色或棕褐色为阳性表达。阳性细胞计数方法如下[7]:在显微镜下随机选取10个高倍视野(×400),采用Image-Pro Plus 6.0软件对免疫组化切片目标区域进行扫描,并行密度分析,得到阳性细胞百分比(目标区域阳性细胞个数/总细胞个数)。
1.4 观察指标及随访 观察并记录患者的年龄(以40岁为分界[8])、肿瘤大小、肿瘤分期、淋巴结转移情况、分化程度、是否存在癌栓、雌激素受体(ER)、孕激素受体(PR)、HER-2、分子分型情况。所有患者手术治疗后均以门诊复诊及电话方式进行随访,随访截至时间为2018年10月,78例患者随访时间为22~106个月,中位随访时间90个月,死亡和失访共21例,复发4例,记录中位无病生存期(DFS)。
1.5 统计学处理 采用SPSS 20.0统计软件。呈正态分布的计量资料以表示,不呈正态分布的计量资料以中位数表示;计数资料用率表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用log-rank检验;采用Image-Pro Plus 6.0软件分析免疫组化切片结果。P<0.05为差异有统计学意义。
2 结果
2.1 Foxp3和CD8+在乳腺癌组织中的表达情况 Foxp3表达阳性细胞百分比为(31.12±6.23)%,以 Foxp3阳性细胞>31%为Foxp3高表达组,≤31%为Foxp3低表达组;CD8表达阳性细胞百分比为(39.24±15.22)%,以 CD8+细胞>39%为CD8+高表达组,≤39%为CD8+低表达组。Foxp3和CD8+高、低表达结果见图1(见插页)。
2.2 乳腺癌组织Foxp3、CD8+表达与临床病理因素的关系 乳腺癌组织中,Foxp3高表达组与Foxp3低表达组比较,两组患者在肿瘤大小、肿瘤分期、淋巴结阳性、分化程度、是否存在癌栓及分子分型方面比较差异均有统计学意义(均P<0.05);CD8+高表达组与CD8+低表达组比较,两组患者在肿瘤大小、肿瘤分期、淋巴结阳性、分化程度及是否存在癌栓方面比较差异均有统计学意义(均P<0.05)。而雌激素受体(ER)、孕激素受体(PR)、HER-2的表达与Foxp3、CD8+的表达均无明显相关性(均P>0.05),见表 1。
2.3 Foxp3、CD8+表达与DFS的关系 Foxp3高表达组患者的中位DFS为85个月,Foxp3低表达组患者的中位DFS为99个月,差异有统计学意义(χ2=5.687,P<0.05);CD8+高表达组患者的中位DFS为99个月,CD8+低表达组患者的中位DFS为80个月,差异无统计学意义(χ2=0.180,P>0.05),见图 2、3。
2.4 不同Foxp3、CD8+表达组合亚组DFS的比较 根据Foxp3和CD8+的表达水平,进一步将患者分为4个亚组:Foxp3高表达CD8+高表达组(16例)、Foxp3高表达CD8+低表达组(28例)、Foxp3低表达CD8+高表达组(9例)、Foxp3低表达 CD8+低表达组(25例),结果显示Foxp3高表达CD8+低表达组患者中位DFS是56.5个月,虽然低于Foxp3高表达CD8+高表达组(99.5个月)、Foxp3低表达CD8+低表达组(99个月)及Foxp3低表达CD8+高表达组(90个月),但差异无统计学意义(χ2=7.708,P>0.05),见图 4。
3 讨论
乳腺癌患者存在免疫缺陷已被多项研究证实,且乳腺癌组织中有大量免疫细胞浸润[9-10]。研究表明,乳腺癌组织中细胞毒性淋巴细胞浸润提示预后良好[11],TILs数量与预后呈正相关[12]。然而,也有一些研究表明,TILs数量与患者总生存期呈负相关[13]。其中,Foxp3在肿瘤发生、发展、侵袭、转移等方面发挥重要作用[14-15],而肿瘤浸润性CD8+T细胞与术后生存时间[15]及对治疗的反应方面有着紧密联系[16]。TILs对预后的影响取决于浸润细胞的类型、功能状态、肿瘤组织中浸润细胞的定位及其与肿瘤细胞的相互作用。

图2 Foxp3高表达与Foxp3低表达组的DFS曲线
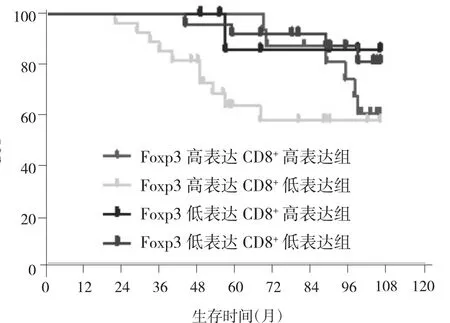
图4 Foxp3高表达CD8+高表达、Foxp3高表达CD8+低表达、Foxp3低表达CD8+高表达、Foxp3低表达CD8+低表达组的DFS曲线
Foxp3是Tregs细胞的相对特异性生物标志。Tregs可以抑制其他免疫细胞的活性,维持免疫系统的稳定性,并可能在抑制肿瘤特异性免疫过程中起重要作用。乳腺癌组织和外周血中均存在大量的Tregs[17],但是Foxp3并不能完全代表Tregs细胞[18]。既往研究发现,Tregs的过表达[19]与乳腺癌的发生及预后[20]相关。通过对乳腺癌肿瘤标本采用免疫组织化学检测发现,原位癌患者中Foxp3阳性细胞数明显增多的患者其复发风险较高。DFS和总生存期在浸润性癌Foxp3阳性细胞显著增加的患者中也相对较短[17]。上述研究表明,乳腺癌患者中,Foxp3高表达意味着较差的预后。然而,一项关于ER阴性乳腺癌的研究表明,Foxp3高表达的基底样乳腺癌患者中有更长的DFS[21]。因此,目前关于Foxp3在乳腺癌中预后的研究结果并不一致。本研究中,Foxp3细胞浸润与肿瘤大小、肿瘤分期、淋巴结转移、分化程度、否存在癌栓以及分子分型等方面相关,提示预后不良。这进一步证实了既往研究结论[17]。进一步生存分析显示,Foxp3低表达组患者的中位DFS明显高于Foxp3高表达组,也进一步证实了Foxp3与患者预后生存时间呈负相关。

图3 CD8+高表达与CD8+低表达组的DFS曲线
肿瘤微环境中的TILs主要是CD8+T细胞,既往研究表明CD8+肿瘤淋巴细胞浸润意味着预后较好[22-24]。然而,也有研究表明CD8+在不同的乳腺癌亚型中有不同的结果和预后。例如,有研究就提出乳腺癌患者的CD8+细胞的数量与存活率无关。然而,在另外一项基底样乳腺癌中,其结果却是CD8+预示有更好的预后[25]。因此,许多以前的大规模研究对CD8+与生存之间的关系有不同的结论。在本研究中,CD8+浸润情况与肿瘤大小、肿瘤分期、分化程度、淋巴结转移及是否存在癌栓等有关,并且与提示预后较差的淋巴结转移、存在癌栓等因素呈负相关。在随后的亚组分析中也显示,Foxp3低表达组的患者中位DFS显著长于Foxp3高表达组。进一步分析发现,Foxp3低表达CD8+高表达亚组有着最佳的预后,明显优于其他3组,但差异无统计学意义。笔者认为,由于本研究中病例数较少,而且在本研究中Foxp3可能来源于不同的T细胞,从而导致其免疫状态不同,因此其对预后的影响尚不明确。
总之,检测乳腺癌患者的免疫状态有助于预测乳腺癌患者的预后。患者的免疫状态、肿瘤的临床特征、病理类型、治疗方法等因素决定了乳腺癌患者的预后。因此,对乳腺癌患者免疫状况进行更深入的研究将有助于临床医生为乳腺癌患者选择更具针对性的个性化治疗方案。本研究与国际先进水平仍存在一定的差距,期待在接下来的研究中能够进一步扩大样本量,研究更多免疫指标对患者预后的影响,从而使更多患者受益。
