鼻咽癌EGFR、HLA-F表达水平及调强放疗预后的影响因素分析
2019-09-25王勇吴波孙华丽胡炜熊华才李传顶刘艳梅陈卫军应申鹏
王勇 吴波 孙华丽 胡炜 熊华才 李传顶 刘艳梅 陈卫军 应申鹏
鼻咽癌是常见的头颈部恶性肿瘤之一,也是免疫相关性肿瘤[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)在肿瘤细胞浸润、转移及血管形成等过程中起重要作用,其过度表达与包括鼻咽癌等多种恶性肿瘤预后相关。近年来,多项基础研究表明EGFR参与肿瘤免疫调节,与人类白细胞抗原(human leucocyte antigen,HLA)存在相关性[2]。EGFR抑制剂可以上调包括HLA在内的主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类和Ⅱ类基因的表达[3]。HLA多态性也可以影响EGFR抑制剂治疗的免疫调节表现:皮疹反应[4]。HLA-F是HLAⅠ类分子之一,HLA-F编码的蛋白主要为人类组织相容性抗原,可以影响T淋巴细胞的分化及免疫因子的释放,从而介导免疫系统反应、免疫应答及免疫损伤。在人类很多肿瘤中可检测到HLA-F过度表达,基础研究表明HLA-F与鼻咽癌相关,但鲜有相关临床研究报道。本研究拟分析EGFR和HLA-F在鼻咽癌组织中的表达水平及预测鼻咽癌调强放射治疗预后的价值,为肿瘤个体化治疗提供依据。
1 资料和方法
1.1 一般资料 我院2007年1月至2017年12月收治鼻咽癌放疗患者120例,其中男85例,女35例,年龄27~88岁,中位年龄55岁。组织学类型:角化性鳞癌16例,非角化性鳞癌104例。根据UICC第7版分期标准,Ⅰ期18例,Ⅱ期22例,Ⅲ期55例,Ⅳa期25例。单纯放疗37例,放疗加化疗83例。
1.2 HLA-F和EGFR的免疫组织化学检测方法 鼻咽癌组织标本为患者治疗前在鼻咽镜活检时获得。HLA-F和EGFR免疫组织化学检测试剂分别为兔抗人HLA-F 单克隆抗体(mAb EPR6803,1∶300,英国 Abcam公司产品)和鼠抗人EGFR蛋白单克隆抗体(18986-1-AP,中国武汉三鹰生物技术有限公司产品),均按照试剂盒操作说明进行操作。以IgG1封闭HLA-F抗原后作为阴性对照,皮肤癌组织用于阳性对照EGFR;阴性对照使用PBS代替一抗。EGFR和HLA-F蛋白阳性染色均呈棕黄或棕褐色,且定位于细胞质和(或)细胞膜。
1.3 结果判断 结果判别由病理科医师采用独立双盲半定量评估,每张切片随机取5个400倍视野,以染色强度结合阳性细胞数百分比综合计分[5],0分为阴性(-),1~4 分为弱阳性(+),5~8 分为中度阳性(++),9~12分为强阳性(+++)。0~4分定义为低表达,5~12分定义为高表达。
1.4 治疗方法和随访 所有入组病例均经病理确诊后,接受根治性调强适形放射治疗,参考RTOG 0615剂量标准[6],设计并优化调强计划。所有患者肿瘤剂量为70Gy,2.12Gy/F,颈部淋巴结转移灶照射剂量66Gy,2Gy/F,预防区照射剂量50Gy,2Gy/F。临床分期为Ⅱ~Ⅳ期病例采取同步放化疗,酌情诱导化疗或放疗后辅助化疗,诱导化疗或辅助化疗为以铂类为基础的双药或三药联合方案,同步化疗方案为每周顺铂30~40mg/m2,其中19例患者因基础疾病和其它特殊原因未接收化疗。入组患者放疗结束后开始随访,前2年每3个月及第3年开始每半年进行一次随访,不能来院复诊患者电话随访。来院随访内容包括全面的体检及辅助检查,每半年复查一次鼻咽部MRI。随访时间以诊断日期开始计算至死亡或末次随访日期。中位随访时间为43.4个月(10.6~100个月)。无进展生存期(progression-free survival,PFS)定义为:从确诊开始至肿瘤(任何方面)进展或(因任何原因)死亡之间的时间。总生存期(overall survival,OS)定义为:从确诊开始至(因任何原因)死亡的时间。
1.5 统计学处理 采用SPSS19.0统计软件。计量资料以 表示,组间比较采用独立样本t检验,计数资料组间比较采用χ2检验。Kaplan-Meier生存曲线分析PFS和OS,生存率的比较采用log-rank检验。采用单因素、多因素Cox比例风险模型评估EGFR和HLA-F两因素预测预后的相对风险。蛋白表达水平的关系分析采用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 生存和死亡患者临床特征比较 根据随访结果将患者分为生存组和死亡组,两组患者临床特征比较见表1。
由表1可见,生存和死亡患者的性别和病理类型的差异均无统计学意义(均P>0.05),而年龄、T分期、N分期和临床分期比较差异均有统计学意义(均P<0.05)。
2.2 120例鼻咽癌患者EGFR和HLA-F表达水平与临床特征关系 见表2。
由表2可见,EGFR≥(++)表达率为70.8%(85/120),HLA-F≥(++) 表达率为 66.7%(80/120)。EGFR、HLA-F表达水平与患者的性别、年龄、组织病理学分型间均无相关性(均P>0.05),而与患者T分期、N分期、临床分期间有相关性(均P<0.05)。

表1 生存和死亡患者临床特征比较(例)

表2 120例鼻咽癌患者EGFR、HLA-F表达水平与临床特征的关系(例)
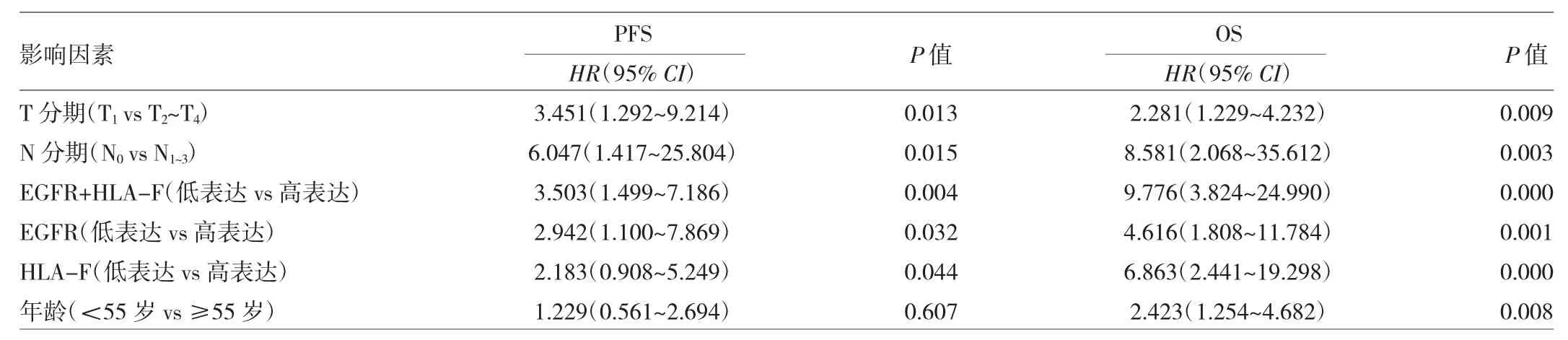
表3 120例鼻咽癌患者EGFR、HLA-F表达水平预测PFS、OS的单因素分析
2.3 HLA-F和EGFR表达水平预测鼻咽癌调强放疗预后的单因素分析 见表3。
由表3可见,单因素分析显示T分期、N分期、EGFR表达水平、HLA-F表达水平、EGFR+HLA-F表达水平是预测鼻咽癌患者PFS、OS的影响因素,年龄是OS的影响因素。
2.4 HLA-F和EGFR表达水平预测鼻咽癌调强放疗预后的多因素分析 见表4。
由表4可见,多因素分析显示,T分期是预测PFS的独立影响因素,EGFR+HLA-F表达水平是预测OS的独立影响因素。
2.5 HLA-F和EGFR与鼻咽癌调强放疗预后的关系Kaplan-Meier生存曲线分析显示,高EGFR、高HLA-F患者的PFS和OS均差于低表达组(图1、2,见插页)。根据EGFR、HLA-F表达水平分组,分为高EGFR+高HLA-F、高 EGFR+低 HLA-F、低 EGFR+高 HLA-F 和低EGFR+低HLA-F 4组,采用Kaplan-Meier生存曲线分析,高EGFR+高HLA-F患者的PFS和OS均差于其它组(图3,见插页)。进一步分析显示,死亡组EGFR高表达34例(85.0%),HLA-F高表达为 35例(87.5%),EGFR+HLA-F高表达34例(85.0%);生存组EGFR高表达50例(62.5%),HLA-F高表达45例(56.3%),EGFR+HLAF高表达33例(41.3%)。

表4 120例鼻咽癌患者EGFR、HLA-F表达水平预测PFS、OS的多因素分析
2.6 HLA-F和EGFR蛋白表达相关性 HLA-F和EGFR表达水平在鼻咽癌组织中呈正相关(r=0.28,P=0.002)。
3 讨论
放射抗拒是导致鼻咽癌预后不良的重要原因,研究表明,EGFR高表达与鼻咽癌放射抗拒相关,EGFR抑制剂可以提高鼻咽癌的放射敏感性,进而提高生存获益[7-8]。当前肿瘤治疗进入免疫时代,研究表明在鼻咽癌免疫调节方面,EGFR和HLA存在相关性,且共同参与肿瘤的免疫调节[2]。
EGFR突变或过表达可以诱导肿瘤放疗抵抗,导致预后不良[9]。本研究利用免疫组化方法检测EGFR在鼻咽癌组织中的表达情况,结果显示EGFR总阳性表达率为88.3%,高表达率为70.8%。阳性表达率与文献报道的68%~89%相似[10]。本研究显示EGFR表达水平和T、N分期有关,Zhang等[11]进行的一项回顾性研究表明,EGFR表达于89.5%的鼻咽癌患者,且于与鼻咽癌的T和有无颈部淋巴转移(N分期)有关,其EGFR阳性表达患者3年生存率更低(75.8%vs 91.2%),且为独立的不良预后因子(β=3.93;χ2=11.95;P=0.001)。Cao 等[12]的研究显示EGFR与鼻咽癌的T分期有关,与N分期无关。本研究中EGFR高表达组5年PFS和OS时间均差于低表达组,死亡组中高EGFR表达高于低表达的5倍。单因素分析显示EGFR表达是PFS和OS影响因子(P=0.017、0.003),但多因素分析EGFR不是独立影响因子。虽与上述这些研究的结果并不完全一致。但可以肯定的是EGFR过表达是鼻咽癌患者的不良预后因素,支持许多观察性研究提示EGFR是判断预后较为理想的生物学标志物的结论[13]。
HLA-F属于非经典型HLAⅠ类抗原,主要功能是参与免疫调节,维持免疫耐受免疫系统失调影响鼻咽癌的发生与发展[1]。多项基础研究表明HLA-F与鼻咽癌易感性存在密切联系[14-15]。Li等[16]通过构建CNE-2-Rs和6-10B-Rs两个鼻咽癌细胞株,分析了miRNA和对应的mRNA,结果发现HLA-F mRNA高表达,表明HLA-F与鼻咽癌相关。一项针对2 340例中国南方NPC患者和1 166例健康志愿者的研究筛选出包括HLA-F在内的7个HLA差异性单核苷酸多态性(SNP),依据Hardy-Weinberg equilibrium(HWE)假设进一步分析发现,HLA-F影响鼻咽癌的发生发展[15]。从基因学水平肯定了HLA抗原,尤其是HLA-F,在鼻咽癌发生、发展中的作用。既往研究发现HLA-F分子存在异常表达水平,并明显影响患者预后,且不同类型间的肿瘤表现出不同的临床相关性,包括如非小细胞肺、乳腺癌、前列腺癌和结直肠癌等许多癌症类型中都被过度表达[17-18]。Ishigami等[19]对日本胃癌患者的研究发现HLA-F与胃癌患者预后呈相关性,并且发现HLA-F表达和肿瘤浸润程度、淋巴结转移、血管和淋巴管侵犯等相关。徐永富等[21]研究显示HLA-F在肝细胞癌中的表达是独立预后影响因子。本研究显示HLA-F阳性总表达率为85.3%,高表达率为66.7%。HLA-F高表达组患者PFS、OS明显差于低表达组。死亡组中HLA-F高表达是低表达的7倍。HLA-F表达水平与性别、年龄、病理分型无关,而与T、N分期相关,表明HLA-F表达水平与鼻咽癌存在临床相关性。单因素分析显示,HLA-F高低表达水平是患者PFS、OS的影响因素(P=0.044、0.000),但多因素分析显示HLA-F不是其独立影响因素。
本研究表明EGFR和HLA-F表达水平有显著的相关性。单因素分析显示T分期、N分期、EGFR素表达水平、HLA-F表达水平是PFS、OS的影响因素,但多因素分析提示患者T分期(P=0.001)是PFS的独立影响因素,EGFR+HLA-F表达水平是患者OS的独立预后影响因素(P=0.025)。高EGFR+高HLA-F表达患者5年PFS、OS分别为54%、29%均较其它组合低。死亡组中高EGFR+高HLA-F的高占比,提示EGFR、HLA-F高表达能提高鼻咽癌的放射抗拒性,这可能与EGFR与HLA协同参与相关肿瘤免疫反应有关。Srivastava等[21]报道在头颈部肿瘤中,EGFR通过抑制SHP-2/STAT1诱导HLA下调,HLAⅠ类分子上调与EGFR抑制剂疗效显著相关,即EGFR抑制剂可以阻断EGFR诱导的免疫逃逸机制并通过重建STAT1信号以逆转HLA下调,从而达到适应性细胞免疫。
综上所述,本研究首次为HLA-F表达水平影响鼻咽癌患者调强放疗预后提供了证据,HLA-F的表达水平在鼻咽癌中具有临床意义。联合检测EGFR和HLAF表达水平有助于鼻咽癌调强放疗预后的分析。HLA-F和EGFR的相关性即信号通路交互影响机制有待进一步研究。本文一部分患者的随访时间还不够长,可能对结果存在影响。
