双歧杆菌抗氧化肽的分离鉴定
2019-09-25王世博张金兰李平兰
王世博,张金兰,李平兰*
(中国农业大学食品科学与营养工程学院,北京 100083)
活性氧(reactive oxygen species,ROS)是生物体有氧呼吸的副产物[1],包括含氧自由基、氧离子和过氧化物[2]。在生物体内,最主要的ROS来源是线粒体呼吸链产生的超氧阴离子[3-4]。ROS具有较强的化学活性[5],在生物体内积累的ROS能够造成DNA、蛋白质和脂质的氧化损伤,导致细胞和组织受损[6],造成氧化压力,促进慢性疾病的发展,如动脉粥样硬化、糖尿病、心脏病等[7-10]。
抗氧化肽正在逐渐作为食品成分被接受。在功能性食品和营养品中补充抗氧化肽,可以缓解人体内的氧化应激,降低氧化压力[11]。目前,研究人员在乳制品和发酵乳中均发现了具有抗氧化能力的生物活性肽:刘志东等[12]在牛乳中发现抗氧化活性肽HIR;Mao Xueying等[13]发现,通过蛋白酶将牦牛乳酪蛋白降解为肽,可以表现出较强的自由基清除活性;Li等[14]在山羊乳酪蛋白酶解物中分离出5 种具有抗氧化活性的寡肽(VYPF、FGGMAH、FPYCAP、YVPEPF、YPPYETY);Piovesana等[15]在驴乳中筛选出抗氧化肽TKTEEGEFISEGGGVR;Chang等[16]在发酵乳制品中分离出2 种抗氧化肽(VLSLSQSKVLPVPQK和VLSLSQSKVLPVPQKAVPYPQRDMPIQA)。这些乳制品中的抗氧化肽一些来自于乳中酪蛋白的水解,一些由发酵过程中的微生物产生。
已有研究表明,动物双歧杆菌可以表现出较强的抗氧化能力[17-18]。动物双歧杆菌乳亚种B013(Bifidobacterium animalissubsp. lactisB013)由本实验室分离自广西巴马长寿老人肠道,前期工作表明,该菌株有较强的抗氧化活性,同时菌株培养物上清液表现出较强的自由基清除能力[19]。本研究的目的是从菌株的培养物上清液中分离纯化抗氧化活性物质,并对活性物质进行鉴定。
1 材料与方法
1.1 材料与试剂
菌株:动物双歧杆菌乳亚种B013(Bifidobacterium animalissubsp. lactisB013)由中国农业大学应用微生物研究室保藏。
MRS肉汤培养基(生化试剂) 北京奥博星生物技术有限责任公司;抗氧化剂检测试剂盒、β-葡萄糖苷酶、纤维素酶 美国Sigma公司;DMEM高糖培养基 美国Corning公司;磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.2~7.4) 北京酷来搏科技有限公司;氯化钠、葡萄糖(均为分析纯)国药集团化学试剂(北京)有限公司;乙腈(色谱纯) 美国Thermo Fisher公司;三氟乙酸(分析纯) 上海麦克林生化科技有限公司;蛋白酶K 天根生化科技(北京)有限公司。
1.2 仪器与设备
YXQ-LS-SⅡ全自动立式电热压力蒸汽灭菌器上海博迅医疗生物仪器股份有限公司;SCL-1300垂直流洁净工作台 北京赛伯乐实验仪器有限公司;GB303电子天平 梅特勒-托利多仪器(上海)有限公司;Legend Micro 17台式高速离心机、Q Exactive串联质谱仪美国Thermo Scientific公司;MQD-S3R恒温培养箱上海晏泉仪器有限公司;Synergy HT多功能酶标仪 美国BioTek公司;TM-100恒温混匀仪 合肥艾本森科学仪器有限公司;LNG-T98冷冻离心浓缩干燥器 太仓市华美生化仪器厂。
1.3 方法
1.3.1 抗氧化能力测定
参照Rizzello[20]、Gökbulut[21]等的方法,使用抗氧化剂检测试剂盒进行测定。反应体系中加入10 μL样品和20 μL肌红蛋白工作液,再加入150 μL 2,2’-联氮双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid)ammonium salt,ABTS)工作液,反应5 min,加入100 μL停止液(1 g/100 mL十二烷基硫酸钠水溶液),测定405 nm波长处的吸光度(A405nm)。分别采用浓度为0、0.015、0.045、0.105、0.210、0.420 mmol/L的Trolox(水溶性VE,6-羟基-2,5,7,8-四甲基色烷-2-羧酸,C14H18O4)溶液作为样品绘制标准曲线,通过将样品的A405nm带入回归方程将样品的抗氧化能力换算成Trolox当量抗氧化能力(mmol Trolox/L)。
1.3.2 抗氧化活性培养物上清液培养体系的选择
分别取培养24 h的动物双歧杆菌乳亚种B013菌液1 mL,10 000 r/min离心2 min;弃去上清,用生理盐水洗涤3 次去除残余的培养基,分别加入1 mL DMEM培养液、1 mL含1 g/100 mL葡萄糖(pH 7.2~7.4)的0.01 mol/L PBS、1 mL含1 g/100 mL葡萄糖的生理盐水和1 mL 1 g/100 mL的葡萄糖水溶液,反复振荡,制成600 nm波长处光密度(optical density,OD600nm)为0.5的菌悬液;置于厌氧培养盒中,加入厌氧产气袋,37 ℃培养24 h,培养结束后10 000 r/min离心2 min,弃去沉淀保留上清,保存于-20 ℃冰箱备用。
1.3.3 抗氧化活性培养物上清液培养体系响应面优化试验
参照孙鹏等[22]的方法,进行Box-Behnken试验设计[23]。选取的因素和水平分别为:菌量(以OD600nm表示):0.25、0.50、0.75;培养时间:24、18、12 h;葡萄糖添加量:1%、3%、5%。以上清液的总抗氧化能力作为响应值。达到培养时间后,10 000 r/min离心2 min,弃去沉淀保留上清,保存于-20 ℃冰箱备用。
1.3.4 抗氧化活性成分分析
按照响应面优化得到的培养体系制备活菌培养物上清液,进行如下处理[24-25]:取1 mL培养物上清液,不进行其他处理,作为对照组备用;取1 mL培养物上清液,100 ℃水浴5 min,冷却至室温备用;取1 mL培养物上清液,加入10 μL蛋白酶K溶液,37 ℃处理30 min;取1 mL培养物上清液,加入10 μLβ-葡萄糖苷酶和10 μL纤维素酶,50 ℃处理4 h;最后分别测定每个处理组的总抗氧化活性。
1.3.5 培养物上清液中肽粗品的制备
按照响应面优化得到的培养体系制备培养物上清液100 mL,10 000 r/min离心2 min,弃去沉淀保留上清,-20 ℃冷冻24 h,真空冻干48 h,加入10 mL去离子水,反复振荡使冻干样品溶解,将样品放入透析袋中,4 ℃透析6 h,保存于-20 ℃冰箱备用。
1.3.6 固相萃取
使用C18固相萃取小柱(容量6 mL,柱床容量500 mg),首先向小柱中加入纯乙腈活化柱床;待乙腈流尽后加入含0.1%三氟乙酸(tri fluoroacetic acid,TFA)的超纯水平衡柱床;取5 mL肽粗品加入5 μL TFA混匀,加入小柱;待样品流尽后加入含0.1% TFA的超纯水洗涤柱床,并重复2 次;依次用0%、20%、40%、60%、80%乙腈水溶液冲洗柱床,收集流出液,并分别测定抗氧化活性。
1.3.7 超滤
取固相萃取后抗氧化活性最高的组分进行超滤。超滤管规格为3 kDa、15 mL,每次超滤10 000 r/min离心15 min。取第1次滤下的组分收集,作为样品中分子质量<3 kDa的组分,未滤下的组分加入超纯水补至原体积,再次进行超滤并重复2 次,收集未滤下的部分,补超纯水至原体积并收集,作为样品中分子质量>3 kDa的组分。分别测定2 个组分的总抗氧化活性。
1.3.8 液相色谱-串联质谱分析
使用液相色谱-串联质谱进行分析[26],色谱分离时间90 min,流动相A为2%乙腈(加入0.1% TFA),流动相B为80%乙腈(加入0.1% TFA),流动相梯度洗脱程序如表1所示。

表 1 流动相梯度洗脱程序Table 1 Mobile phase gradient elution procedure
质谱扫描范围(m/z)为350~1 300,采集模式为数据依赖采集(data-dependent acquisition,DDA)模式;选择母离子中信号最强的20 个进行二级碎裂;一级质谱分辨率为70 000,碎裂方式为高能诱导裂解(higherenergy collisional dissociation,HCD);二级分辨率为17 500,动态排除时间为18 s。对于质谱得到的数据使用软件PEAKS Studio 8.5进行查库,查库时将raw文件提交至PEAKS Studio 8.5服务器,选择已经建立好的数据库,进行数据库搜索。
1.3.9 抗氧化活性肽的预测与验证
通过生物活性肽数据库BIOPEP检索抗氧化肽的数据,使用基本局部相似性比对搜索工具(basic local alignment search tool,BLAST),与液相色谱-串联质谱分析得到的动物双歧杆菌乳亚种B013培养物上清液中的肽序列进行序列比对,筛选可能的抗氧化肽。对于筛选出的肽,使用在线折叠软件PEP-FOLD 3.5[27]和BIOVIA Discovery Studio 2.5软件进行分子动力学模拟,得到肽分子的计算机模拟构象。按照肽序列人工合成实验推测的抗氧化肽,验证其抗氧化活性。
1.4 数据处理
采用Microsoft Excel 2016、R3.5.2、IBM SPSS Statistics 21、Origin 9.0、Design-Expert 8软件进行数据处理与绘图。
2 结果与分析
2.1 抗氧化活性测定标准曲线
通过抗氧化剂检测试剂盒测得的Trolox浓度与A405nm的线性回归方程为y=-2.667 9x+1.581 3(R2=0.994 9)。
2.2 抗氧化活性培养物上清液培养体系的选择

图 1 不同培养体系得到的培养物上清液的总抗氧化活性Fig. 1 Total antioxidant activity of culture supernatants obtained from different culture systems
由图1可知,培养体系为生理盐水+葡萄糖时,培养物上清液的总抗氧化活性显著高于其他培养体系,因此在后续的实验中对此体系进行优化,进一步提高培养物上清液的抗氧化活性。
2.3 抗氧化活性培养物上清液培养体系响应面优化
由表2~3可知:响应面模型的F值为18.801 3,P值为0.000 4,表明模型显著,只有0.04%的可能性是由于噪声造成了模型F值增大;A、A2、B2、C2是模型的显著项,失拟项F值为3.628 9,P值为0.122 6,大于0.10,表明失拟项不显著,模型选取恰当。
通过模型预测,菌量(OD600nm)为0.66、培养时间为17.84 h、葡萄糖添加量为3.04%时,培养物上清液的总抗氧化活性最强,达到0.342 mmol Trolox/L。对模型预测的培养体系(菌量(OD600nm)0.66、培养时间17.84 h、葡萄糖添加量3.04%)进行验证,培养物上清液的总抗氧化活性为(0.339±0.004) mmol Trolox/L,与模型预测值接近。表明模型建立较好,能够比较准确地预测培养体系与培养物上清液抗氧化活性之间的关系。由图2~4可知:菌量对培养物上清液抗氧化活性的影响不显著,曲面延A轴方向较平缓;培养时间与葡萄糖添加量对培养物上清液抗氧化活性的影响较显著,曲面延B轴和C轴方向较陡峭。
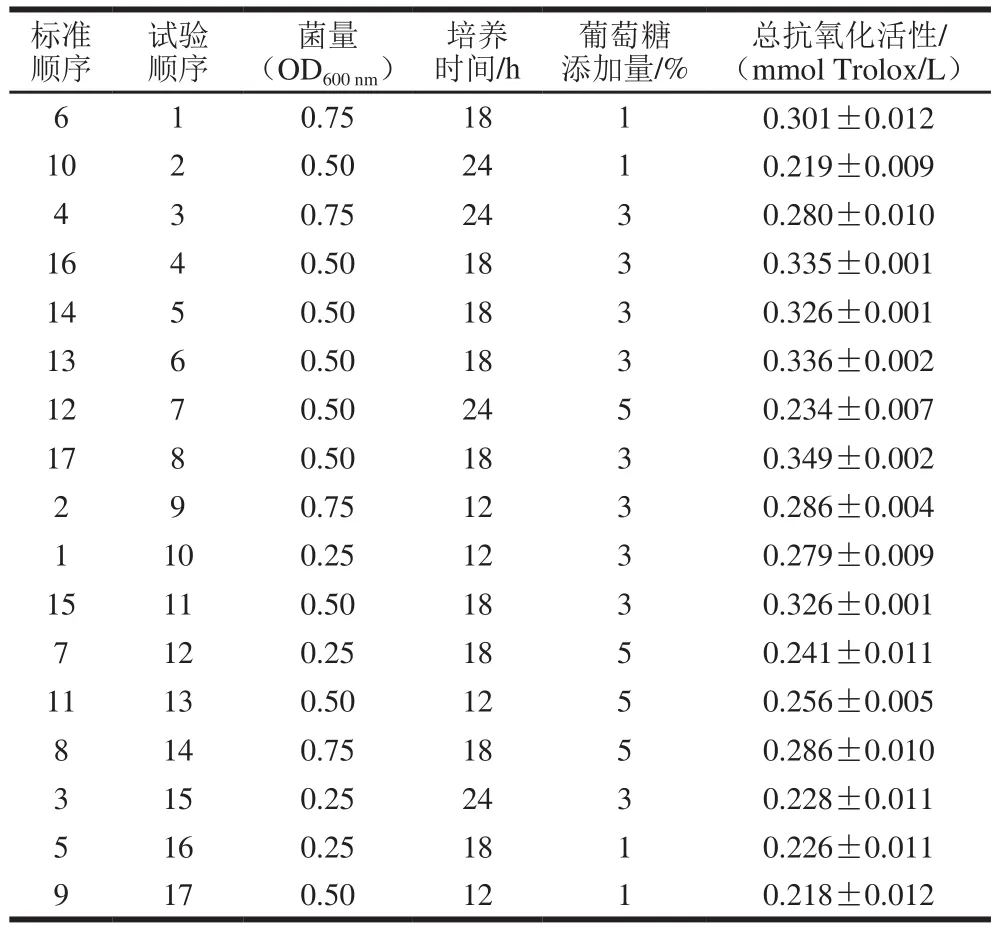
表 2 Box-Behnken试验设计与结果Table 2 Box-Behnken design with experimental results
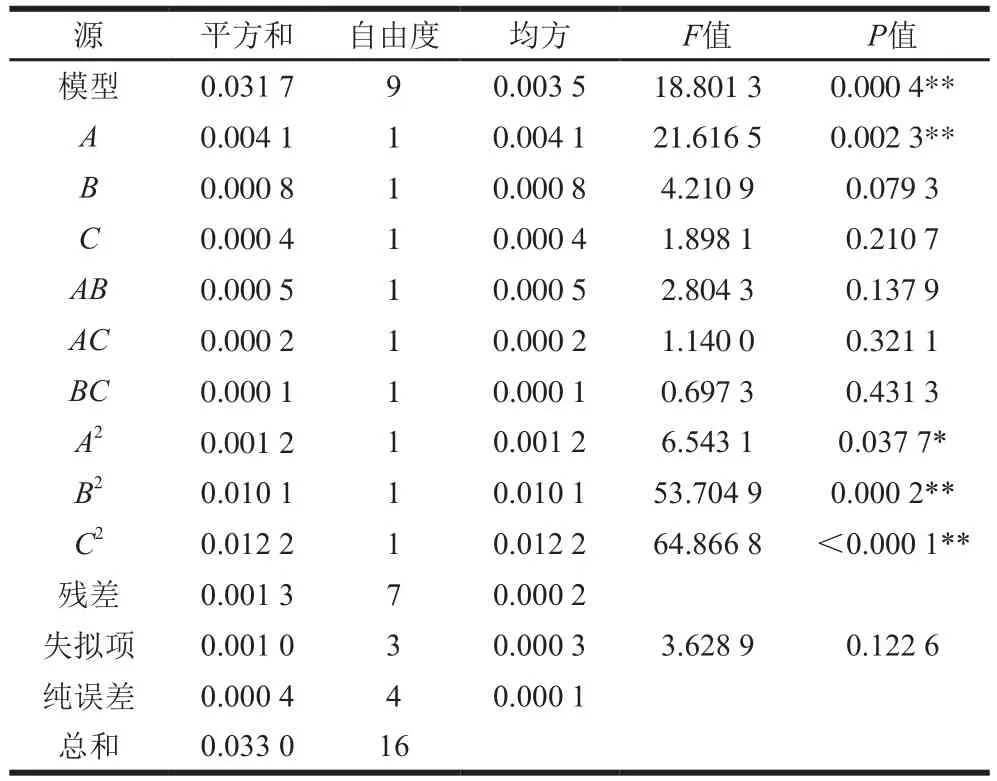
表 3 二次模型响应面方差分析Table 3 Analysis of variance (ANOVA) of response surface quadratic polynomial model


图 2 菌量(OD600 nm)与培养时间交互作用的等高线图与响应面图Fig. 2 Contour and 3D response surface plots showing the interactive effect of inoculum size (OD600 nm) and culture time on antioxidant activity of culture supernatant
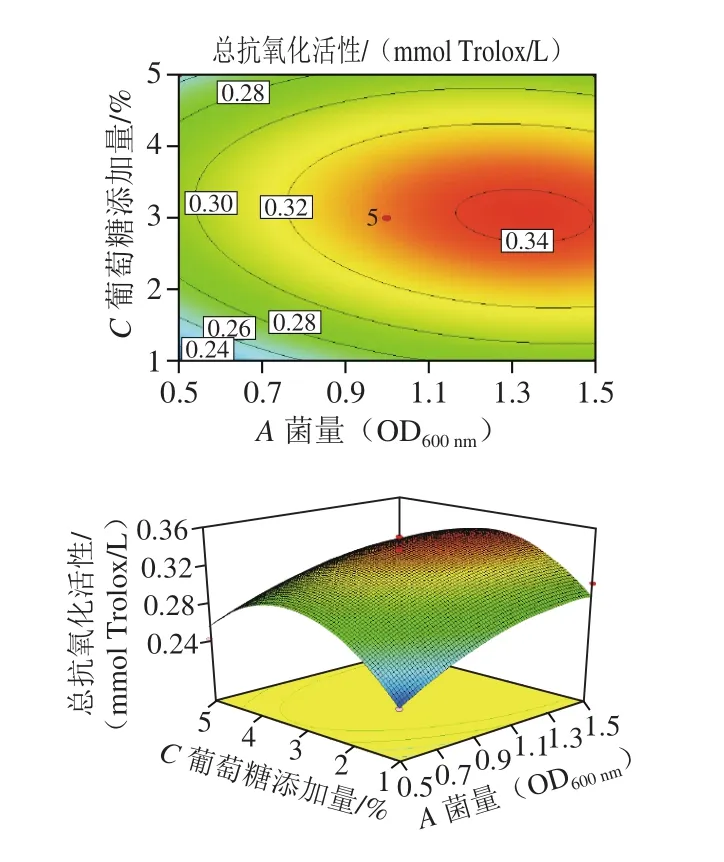
图 3 菌量(OD600 nm)与葡萄糖添加量交互作用的等高线图与响应面图Fig. 3 Contour and 3D response surface plots showing the interactive effect of einoculum size (OD600 nm) and glucose concentration on antioxidant activity of culture supernatant

图 4 培养时间与葡萄糖添加量交互作用的等高线图与响应面图Fig. 4 Contour and 3D response surface plots showing the interactive effect of culture time and glucose concentration on antioxidant activity of the culture supernatant
2.4 培养物上清液的抗氧化活性成分分析

图 5 不同处理后培养物上清液的总抗氧化活性Fig. 5 Total antioxidant activity of culture supernatant after different treatments
由图5可知:100 ℃加热后样品的总抗氧化活性无显著变化,表明活性物质不是蛋白质(蛋白质加热后会变性,丧失活性);蛋白酶K处理后样品的总抗氧化活性显著降低,表明活性物质可能是蛋白质或生物活性肽(蛋白质或生物活性肽含有肽键,会被蛋白酶K降解,因而活性发生改变);β-葡萄糖苷酶和纤维素酶处理后样品的总抗氧化活性没有显著变化,表明活性成分不是多糖(多糖会被β-葡萄糖苷酶和纤维素酶降解)。综合以上分析,能够确定样品中的抗氧化活性物质是生物活性肽。
2.5 固相萃取结果分析
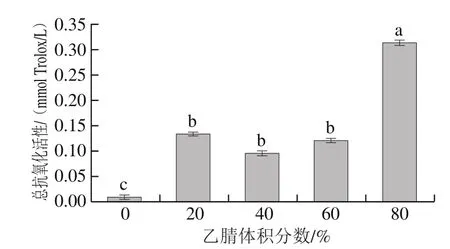
图 6 不同体积分数乙腈洗脱产物的总抗氧化活性Fig. 6 Total antioxidant activity of eluates with different concentrations of acetonitrile
由图6可知,乙腈体积分数为80%时,洗脱产物的总抗氧化活性显著较高,表明抗氧化肽的非极性较强,主要溶解在乙腈体积分数为80%时的洗脱产物组分中。
2.6 超滤结果分析
由图7可知,分子质量<3 kDa的超滤组分抗氧化活性显著高于分子质量>3 kDa的超滤组分,表明活性肽分子质量较小,无需酶切,可以直接进行液相色谱-串联质谱分析。
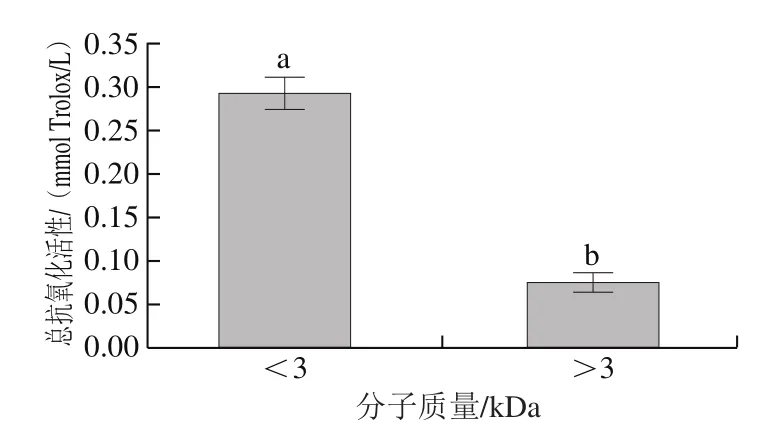
图 7 不同超滤组分的总抗氧化活性Fig. 7 Total antioxidant activity of different ultra fi ltration fractions
2.7 液相色谱-串联质谱分析结果
通过液相色谱-串联质谱分析,检测到样品中共有8 种肽,序列如表4所示。

表 4 液相色谱-串联质谱分析检测结果Table 4 Information about eight peptides identified by LC-MS-MS
2.8 抗氧化活性肽的预测与验证结果
通过BLAST比对,发现样品中有1 个肽的序列与数据库中的肽具有较高的相似度:七肽QYPLGPK和数据库中的七肽HGPLGPL(ID 7889,来源于皮氏叫姑鱼(Johnius belangerii)皮肤[28])序列较为相似。
通过分子模拟,得到肽QYPLGPK的构象如图8所示,含有暴露在外的酪氨酸残基(第2位)和赖氨酸残基(第7位)。在肽中酪氨酸残基的酚羟基可以作为氨基酸供体,赖氨酸残基的氨基可以络合金属离子,有利于发挥抗氧化能力[29]。经过验证,质量浓度10 mg/mL肽QYPLGPK的总抗氧化活性为(0.249±0.011) mmol Trolox/L。

图 8 通过分子模拟得到的肽QYPLGPK构象图Fig. 8 Conformation diagram of peptide QYPLGPK by molecular simulation
3 结 论
通过响应面法优化动物双歧杆菌乳亚种B013培养上清液的抗氧化活性,得到最优的培养体系为菌量(OD600nm)0.66、培养时间17.84 h、葡萄糖添加量3.04%。通过不同的酶和温度处理,确认培养物上清液的抗氧化活性来源于其中的生物活性肽。通过固相萃取和超滤对培养物上清液中的生物活性肽进行分离纯化,产物经过液相色谱-串联质谱分析,确定出其中含有8 种肽。通过生物信息学和计算机模拟,筛选出其中有1 种肽(QYPLGPK)可能具有抗氧化活性。经过验证,质量浓度10 mg/mL的肽QYPLGPK的总抗氧化活性为(0.249±0.011) mmol Trolox/L。对于该抗氧化肽的作用机理有待进一步研究。
在生产实际应用中,一方面可以直接将动物双歧杆菌乳亚种B013开发为益生菌制剂,另一方面可以使用动物双歧杆菌乳亚种B013开发乳品发酵剂,或将来源于动物双歧杆菌乳亚种B013的抗氧化肽作为食品添加剂,开发出具有抗氧化作用的功能食品。
