光谱法研究铜离子荧光探针与人血清白蛋白的相互作用
2019-09-24朱琳马明硕柳彩云
朱琳,马明硕,柳彩云
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.吉林化工学院 分析测试中心,吉林 吉林 132022;3.济南大学 资源与环境学院,山东 济南 250022)
人血清白蛋白(HSA)主要特点是能与许多内源性和外源性化合物相互结合,在人体内主要承担载体的任务[1-3]。通过相互作用的研究,可以为物质代谢、蛋白质的构象研究以及物质与白蛋白结合的本质研究提供重要的数据以及理论指导。本实验设计识别码为Cu2+的罗丹明类化合物探针(DQX-1,图1),通过对探针与人血清白蛋白的相互作用的研究,得到了结合常数、结合位点数、结合距离,以及本探针对人血清白蛋白构象的影响,并从分子水平上解释了两者之间的相互作用。这些内容是研究临床动力学以及临床药理所重点关注的内容,不仅为进一步探讨探针的识别原理提供了科学依据,同时对于新型探针的设计以及应用也有特别的价值。
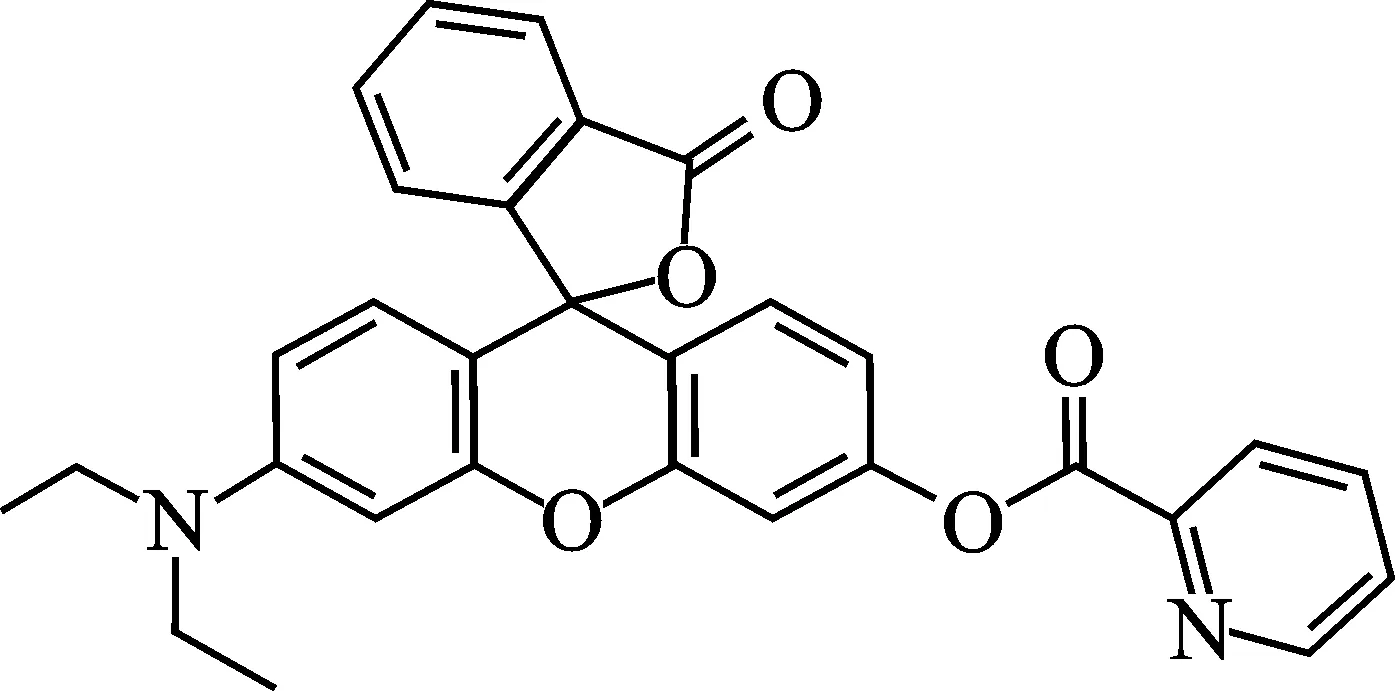
图1 DQX-1结构式Fig.1 The structure of DQX-1
1 实验部分
1.1 试剂与仪器
HSA(Sigma),浓度为10-5mol/L的备用液是用二次蒸馏水配制成;浓度为10-3mol/L的探针DQX-1备用液是用三氯甲烷配成的;Tris(用蒸馏水和三羟甲基氨基甲烷配制成10-2mol/L 500 mL溶液,pH=7.4)缓冲液;三氯甲烷、三羟甲基氨基甲烷均为分析纯;水为二次蒸馏水。
Agilent Cary Eclipse荧光分光光度计;UV2550型紫外可见分光光度计;Jasco-810圆二色谱仪。
1.2 实验方法
1.2.1 荧光光谱测定探针与HAS之间相互作用 用刻度移液管分别移取准确量的HSA溶液和探针溶液到5.0 mL容量瓶中,用二次蒸馏水定容至刻度,使HSA与DQX-1的浓度比为0~10。测试条件:280 nm的激发波长,5 nm的狭缝,在300~450 nm 范围内测定HSA的荧光光谱。
1.2.2 紫外吸收光谱测定探针与HSA相互作用 用刻度移液管分别移取准确量的HSA溶液和探针溶液到5.0 mL容量瓶中,用二次蒸馏水定容至刻度,使HSA与DQX-1的浓度比为0~10。并且以二次蒸馏水作为空白能比,测定体系在200~450 nm范围内的紫外吸收光谱。
2 结果与讨论
2.1 紫外吸收光谱
图2是HSA在不同浓度DXQ-1存在下的紫外-可见吸收光谱图。

图2 不同探针DQX-1浓度条件下的HSA紫外-可见吸收光谱Fig.2 The absorbance spectra of HSA with the different concentration of DQX-1
由图2可知,HSA在大约280 nm处有吸收峰。在280 nm处的吸收峰是由HSA中芳香族氨基酸产生的,随着加入HSA溶液中的探针DQX-1浓度的增加,HSA在280 nm处的特征吸收强度逐渐增大,特征吸收光谱发生蓝移。结果表明,HSA与探针DQX-1结合后,改变了HSA的芳香族氨基酸残基的微环境极性[4]。
2.2 荧光光谱
不同探针浓度条件下HSA的荧光光谱见图3。
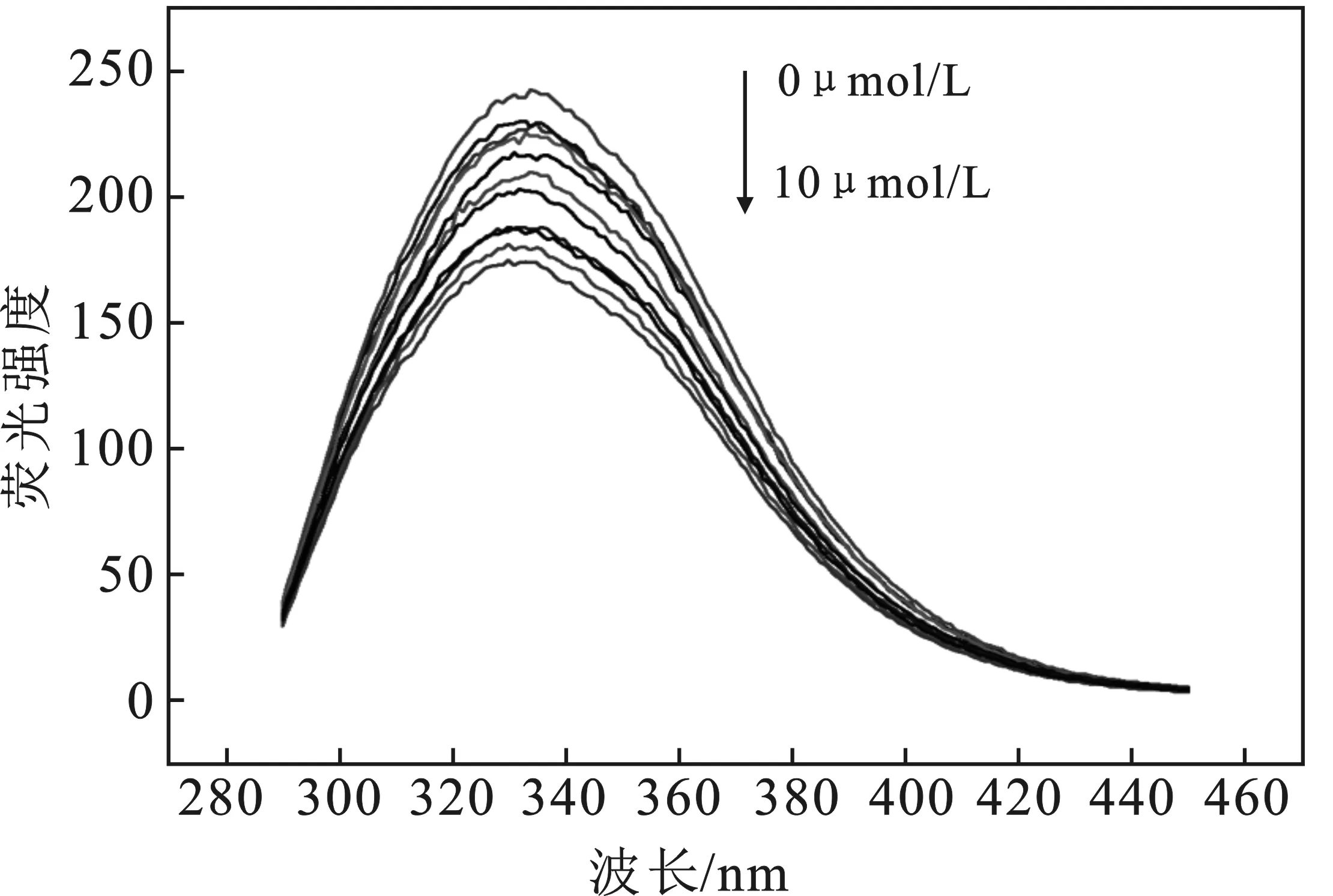
图3 不同探针DQX-1浓度条件下HSA的荧光光谱Fig.3 The fluorescence spectra of HSA with the different concentration of DQX-1
由图3可知,随加入探针DQX-1浓度的逐渐增加,HSA的荧光强度会逐步的降低,并且最大发射波长从334 nm蓝移到330 nm,表明DQX-1的加入不仅使HSA的荧光猝灭,同时也导致荧光生色团色氨酸以及酪氨酸所处的环境疏水性增加[5]。从计算得到的DQX-1与HAS之间的猝灭常数(Kq)均为1012数量级左右,远大于2×1010L/(mol·s)的最大动态荧光猝灭常数,同时结合二者之间的紫外吸收光谱图(图2),进一步表明二者之间的荧光猝灭作用为静态猝灭[6]。
2.3 探针与HSA的结合常数与结合位点数
对于静态猝灭,如果生物分子中有相似且独立的结合位点,则可应用式(1)获得结合常数以及结合位点数[7]。
(1)
其中,n为结合位点数,可由荧光数据根据式(1)作图得到。计算得到的K和n的值见表1。

表1 不同温度下DQX-1与HSA的相互作用参数Table 1 The interaction parameters of DQX-1 with HSA at different temperatures
由表1可知,结合位点数n大约为1,表明每个HSA分子能够结合一个探针DQX-1分子。随着温度的增加,K和n值逐渐下降。
2.4 热力学分析和结合力类型的确定
生物大分子与有机物小分子之间的作用类型可归纳为四种类型,氢键、范德华力、静电引力及疏水作用力。根据反应前后热力学焓变ΔH和熵变ΔS结果,就可得到有机物小分子与蛋白质之间的主要作用力类型。判断根据为:①若ΔS<0、H<0是氢键和范德华力;②若ΔS>0、H>0是疏水作用力; ③若ΔS>0、H<0是静电引力。如果焓变(ΔH)在所研究温度范围内变化很小,该反应的焓变是一个常数。熵变值(ΔS)和焓变值(ΔH)可以通过Van’tHoff等式进行计算:
(2)
ΔG=ΔH-TΔS
(3)
由表1可知,ΔH<0,ΔS<0,所以主要是氢键和范德华力占主导作用[8],由表中的数据可得ΔG<0,说明结合反应可自发进行。
2.5 探针DQX-1与HSA之间的结合距离
探针DQX-1在蛋白质上的结合距离可以根据Förster的非辐射共振能量转移理论计算出,并且也能计算出能量转移效率E,结合距离不仅仅与药物受体和蛋白质供体的距离有关,还与能量转移的临界距离(R0)有关。能量转移效率(E)计算公式如下:
(4)
其中,R0为50%转移效率的临界距离,r为蛋白质和有机小分子间的距离。R0可通过以下关系式计算得:
(5)
其中,K2为偶极子空间定位因子,取值为2/3;n为介质的折射指数,取1.36;ΦD为供体的荧光量子产量,取值为0.15;J为蛋白质发射光谱和有机小分子吸收光谱之间的光谱重叠部分的积分值。如图6所示,可通过下式积分得到:
(6)
其中,F(λ)为在波长λ处蛋白质分子的荧光强度;ε(λ)为波长为λ时有机小分子的摩尔吸收系数。
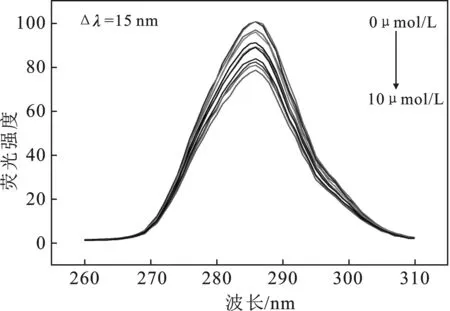
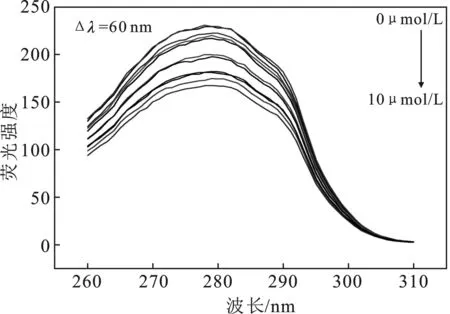
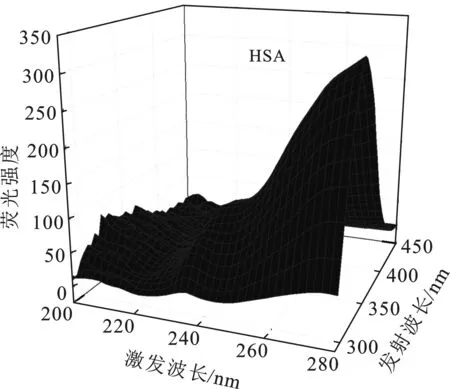
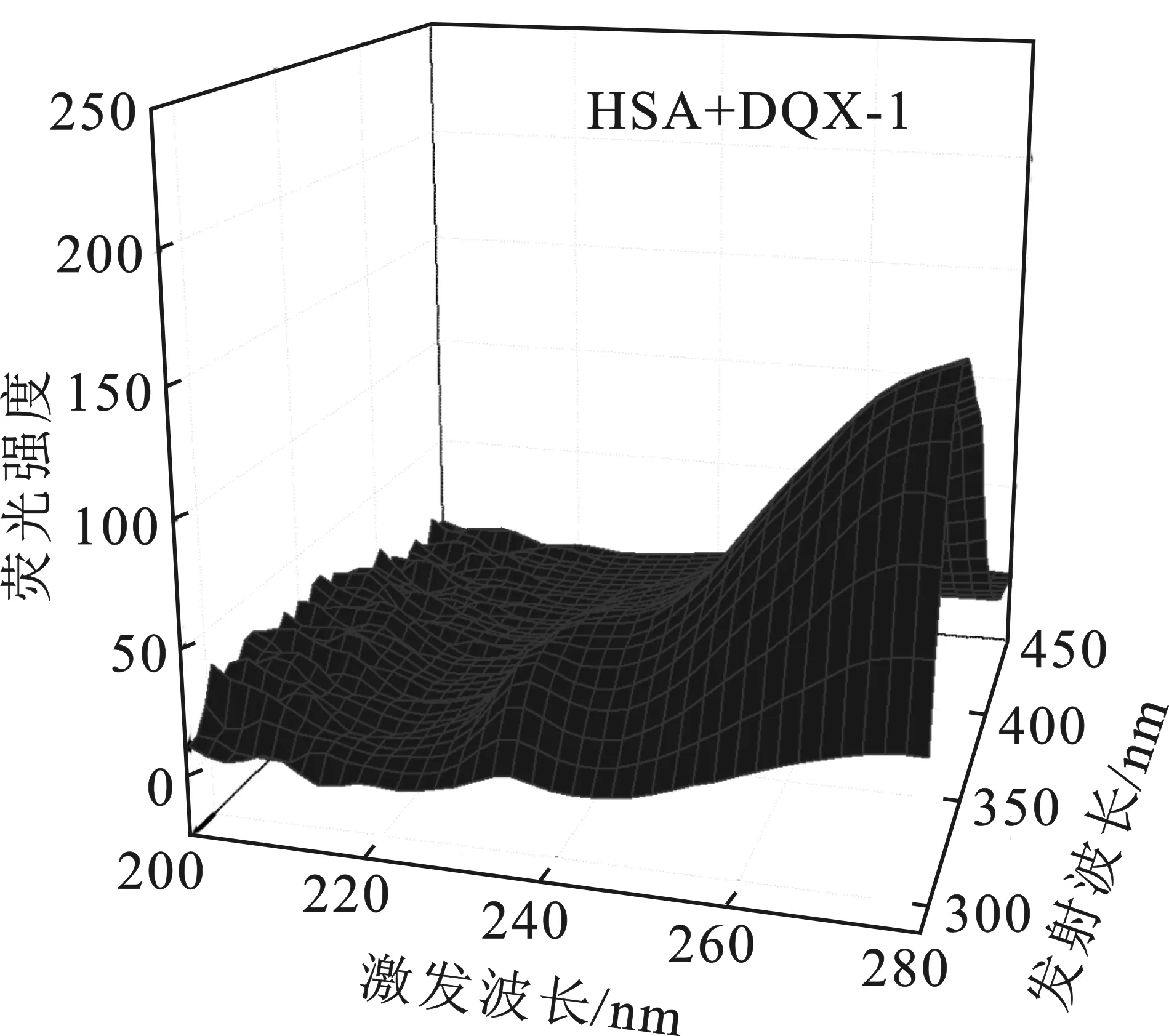
根据图4,由计算求得如下参数:J=6.267 5×10-14cm3·L/mol,R0=3.42 nm和r=5.42 nm。很明显HSA与探针DQX-1-1的距离(r)远<8 nm,并且符合0.5R0 图4 HSA的荧光发射光谱与探针DQX-1的吸收光谱Fig.4 The fluorescence spectra of HSA and absorption spectra of DQX-1 2.6.1 同步荧光光谱研究 图5分别为测得的HSA中酪氨酸基团、色氨酸基团的同步荧光光谱。 图5 不同DQX-1浓度条件下 HSA的同步荧光光谱Fig.5 Synchronous fluorescence spectrum of HSA with different concentration of DQX-1 由图5可知,加入DQX-1后,二者的荧光均下降,但是色氨酸基团的荧光强度下降得比较明显并且发生了轻微的蓝移。实验证明,DQX-1与HSA 作用后,降低了HSA的疏水性、增加了HAS的极性,改变了二级结构[9]。 2.6.2 三维荧光光谱 三维荧光光谱技术近年来已经成为一种常用的荧光分析技术,可以为研究HSA的构象变化提供详细的信息[10]。图6为HSA加入DQX-1前后的三维荧光光谱。 由图6可知,HSA的荧光强度下降,最大发射波长发生蓝移。因此可得,DXQ-1的加入会引起HSA结构的轻微构象变化。 图6 探针DQX-1对HSA三维荧光光谱的影响Fig.6 The effect of DQX-1 on the three-dimensional fluorescence spectrum of HSA 本文研究了铜离子探针DQX-1与HSA之间相互作用的荧光光谱、紫外吸收光谱。并且DQX-1对HSA产生了明显的荧光猝灭效应,由猝灭机理推断为静态猝灭。通过荧光光谱,可以计算得到不同温度下二者的结合常数、热力学常数、作用力类型。由三维荧光光谱以及紫外吸收光谱可以看出,DQX-1的加入可以使HSA的二级结构发生改变。
2.6 探针对HSA构象的影响
3 结论
