卵巢早衰患者血浆中miRNA-503的作用及对内皮祖细胞的影响
2019-09-19仝慧杰刘丽丽范志刚李阳冯晓娟
仝慧杰 刘丽丽 范志刚 李阳 冯晓娟
河北医科大学附属邢台市人民医院(河北邢台054000)
卵巢早衰(premature ovarian failure,POF)指40岁之前的女性由于卵巢功能衰退而引发持续性闭经和性器官萎缩的综合征[1]。卵巢动脉的血流阻力增加,灌注量降低是引起卵巢早衰的病理机制[2-3]。研究[4-6]发现,miRNA-503 具有抗血管生成的作用,参与调节多种血管生成因子,但是miRNA-503 是否参与卵巢早衰的血管抑制过程尚无报道。内皮祖细胞(endothelial progenitor cells,EPCs)是内皮细胞的前体细胞,可迁移至损伤位点,支持或替代损伤的内皮细胞,从而发挥促血管生成的作用[7]。外周血中EPCs 数量降低以及功能减弱常见于各种疾病[8-10],但是卵巢早衰患者外周血EPCs的变化,以及与miRNA-503 是否具有相关性,尚不清楚。综上,本文旨在探讨卵巢早衰患者血浆中miRNA-503水平和内皮祖细胞数量的变化,并且分析其相关性,以及miRNA-503与彩色多普勒血流动力学参数的关系,并且通过体外细胞学实验研究miRNA-503对内皮祖细胞增殖和黏附的影响。
1 资料与方法
1.1 资料选取2016年1月至2018年12月于我院就诊的24 例卵巢早衰患者作为卵巢早衰组,纳入标准:(1)年龄≤40岁的已婚患者,月经初潮及第二性征发育正常;(2)闭经时间≥6 个月;(3)2 次或以上检查发现血清FSH≥40 mIU/mL,两次检查需间隔1 个月以上。排除标准:(1)3 个月内服用过激素类药物或针对卵巢早衰进行过治疗;(2)合并肿瘤、高血压等其他疾病。纳入同期体检、年龄相近(≤2 岁)的24 例健康女性作为对照组。收集两组患者的一般资料进行比较,包括年龄、促卵泡激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌二醇(estradiol,E2)等。所有患者均已签署知情同意书,本研究已获伦理委员会批准。
1.2 血浆miRNA-503 含量的检测实时荧光聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)测定miRNA-503的含量,常规对患者血浆行RNA 提取、逆转录、PCR 扩增等步骤。引物合成于上海生工生物工程有限公司,具体序列为:miRNA-503的上游引物:5′-GTGCAGGGTCCGAGGT-3′,下游引物:5′-GCTAGCAGCGGGAACAG-3′;U6的上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。
1.3 EPCs 数量的检测抽取患者2 mL的抗凝静脉血,淋巴细胞分离液(北京索莱宝科技有限公司)分离淋巴细胞。将细胞分别与APC-CD34 抗体(美国Thermo Fisher Scientific 公司)和FITC-VEGFR2 抗体(英国Abcam 公司)避光孵育10 min,洗涤后使用流式细胞仪检测。
1.4 卵巢动脉血流动力学参数的检测使用彩色多普勒超声诊断仪(荷兰Philips 公司)经阴道观察卵巢基质内动脉血流,测量收缩期峰值流速(peak systolic velocity,PSV)、舒张末期流速(end-diastolic velocity,EDV)、阻力指数(resistive index,RI)、搏动指数(pulsatility index,PI)。
1.5 细胞学实验
1.5.1 EPCs的分离、培养与鉴定参照文献报道[11]进行实验:分离外周血淋巴细胞后,使用EGM-2 完全培养基(瑞士Lonza 公司)以2×106个/L的密度接种于6 孔板中,放于37 ℃、5%CO2培养箱中,后续实验均使用第3 代细胞。4%的多聚甲醛固定EPCs 细胞,加入Dil-LDL 染色液(工作浓度:2.4 mg/L,美国Molecular Probes 公司)与FITC-UEAI 染色液(工作浓度:10 mg/L,美国Sigma 公司)于37 ℃孵育1 h,倒置荧光显微镜观察和拍照。
1.5.2 实验分组与细胞转染细胞学实验分为4组,即正常对照组(A 组)、卵巢早衰组(B 组)、miRNA-503 inhibitor NC 组(C 组)、miRNA-503 inhibitor 组(D组)。A组使用无卵巢早衰女性分离得到的EPCs。其余三组均使用卵巢早衰患者分离得到的EPCs,B 组未进行转染;C 组和D 组分别使用miRNA-503 inhibitor NC 和miRNA-503 inhibitor 转染,按照LipofectamineTM 转染试剂(美国Invitrogen 公司)说明书进行实验。72 h 后使用qRT-PCR 测定四组细胞中miRNA-503的表达水平。miRNA-503 inhibitor和miRNA-503 inhibitor NC 由上海吉玛制药技术有限公司设计和合成。
1.5.3 IGF-1R 表达水平的检测qRT-PCR 测定细胞中IGF-1R mRNA 表达水平,具体序列为:上游引物:5′-TCGACATCCGCAACGACTATC-3′,下游引物:5′-CCAGGGCGTAGTTGTAGAAGAG-3′。蛋白质免疫印迹(Western Blot,WB)测定四组细胞中IGF-1R蛋白质的表达水平,常规进行电泳、转印等步骤,一抗稀释比例为:抗IGF-1R 抗体(1∶1 000,英国Abcam 公司)和抗GAPDH 抗体(1∶2 000,英国Abcam 公司)。
1.5.4 EPCs 增殖能力的检测将等量EPCs 细胞接种于96 孔板中,培养72 h,加入10 μL MTT 溶液(5 mg/mL),继续孵育4 h,吸弃上清后加入二甲基亚砜振荡10 min。酶标仪于490 nm 处测定各孔吸光度值(OD)。
1.5.5 EPCs 黏附能力的检测将等量的EPCs 细胞接种于6 孔板中,放于37 ℃、5%CO2培养箱中30 min,PBS 洗去未贴壁的细胞,显微镜下计数贴壁细胞数。
1.6 统计学方法使用SPSS 20.0 软件进行统计分析。所有计量数据均表示为均数±标准差,两组间计量数据的比较使用t检验,多组间计量数据的比较使用单因素方差分析,组间两两比较使用LSD-t检验。相关分析使用Pearson 法。所有计数数据均表示为患者例数,计数数据的比较使用χ2检验,等级频数资料比较采用Mann-WhitneyU非参数检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 一般资料的比较与对照组比较,卵巢早衰组患者的FSH、LH、妊娠次数和人流次数升高,E2降低,差异具有统计学意义(P<0.05),其他一般资料差异无统计学意义(P>0.05)。见表1。
表1 一般资料的比较Tab.1 Comparison of general data (n=24)±s
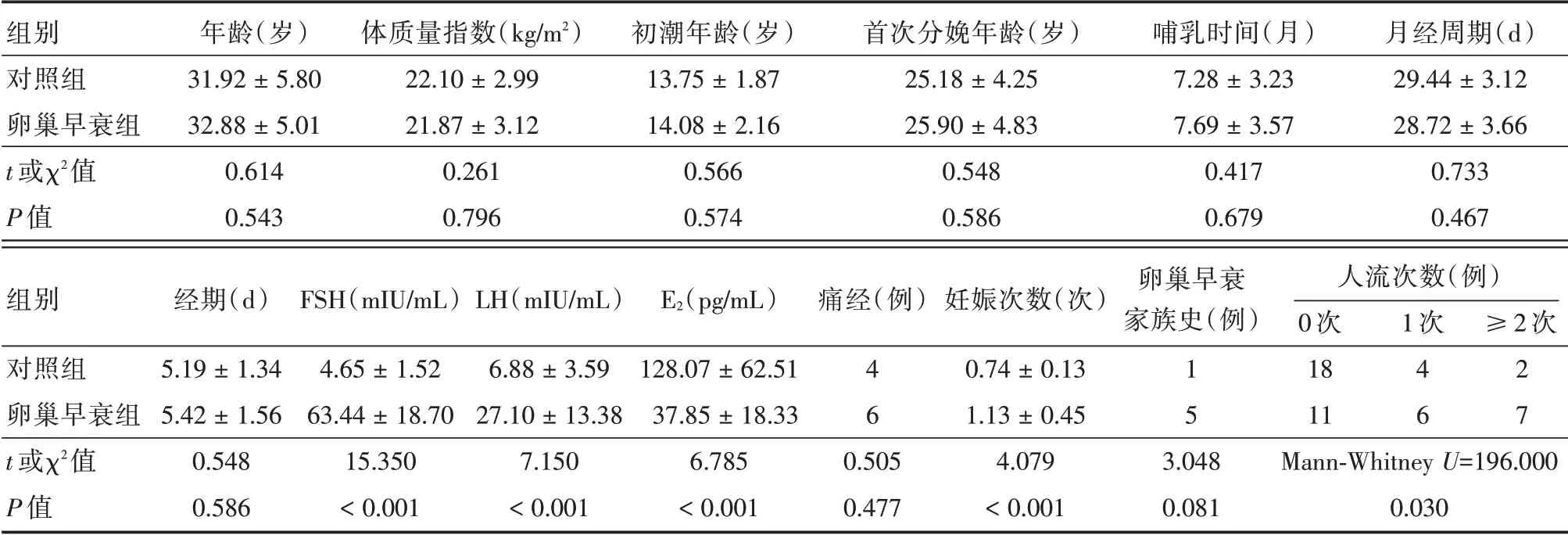
表1 一般资料的比较Tab.1 Comparison of general data (n=24)±s
组别对照组卵巢早衰组t 或χ2值P 值年龄(岁)31.92±5.80 32.88±5.01 0.614 0.543体质量指数(kg/m2)22.10±2.99 21.87±3.12 0.261 0.796初潮年龄(岁)13.75±1.87 14.08±2.16 0.566 0.574首次分娩年龄(岁)25.18±4.25 25.90±4.83 0.548 0.586哺乳时间(月)7.28±3.23 7.69±3.57 0.417 0.679月经周期(d)29.44±3.12 28.72±3.66 0.733 0.467组别对照组卵巢早衰组t 或χ2值P 值经期(d)5.19±1.34 5.42±1.56 0.548 0.586 FSH(mIU/mL)4.65±1.52 63.44±18.70 15.350<0.001 LH(mIU/mL)6.88±3.59 27.10±13.38 7.150<0.001 E2(pg/mL)128.07±62.51 37.85±18.33 6.785<0.001痛经(例)46 0.505 0.477妊娠次数(次)0.74±0.13 1.13±0.45 4.079<0.001卵巢早衰家族史(例)15 3.048 0.081人流次数(例)0 次18 11 Mann-Whitney U=196.000 0.030 1 次46≥2 次27
2.2 miRNA-503 表达水平、EPCs 数量的比较及相关性分析qRT-PCR 结果显示,对照组和卵巢早衰组miRNA-503 表达水平分别为(0.71 ± 0.05)、(1.62 ± 0.12),差异具有统计学意义(t= 6.769,P<0.001);EPCs 数量分别为(35.83±1.96)个/mL、(22.42±2.20)个/mL,差异具有统计学意义(t=4.558,P<0.001)。miRNA-503 表达水平和EPCs 数量呈负相关(r=-0.713,P<0.001)。见图1。
2.3 卵巢早衰患者miRNA-503 与卵巢动脉血流动力学参数的相关性分析miRNA-503 表达水平与PSV 和EDV 呈负相关(r=-0.508,P= 0.011;r=-0.497,P= 0.014),与RI 和PI 呈正相关(r=0.450,P=0.027;r=0.491,P=0.015),差异具有统计学意义。见图2。

图1 miRNA-503 表达水平、EPCs 数量的比较及相关性分析Fig.1 Comparison and correlation analysis of the expression level of microRNA-503 and the number of EPCs
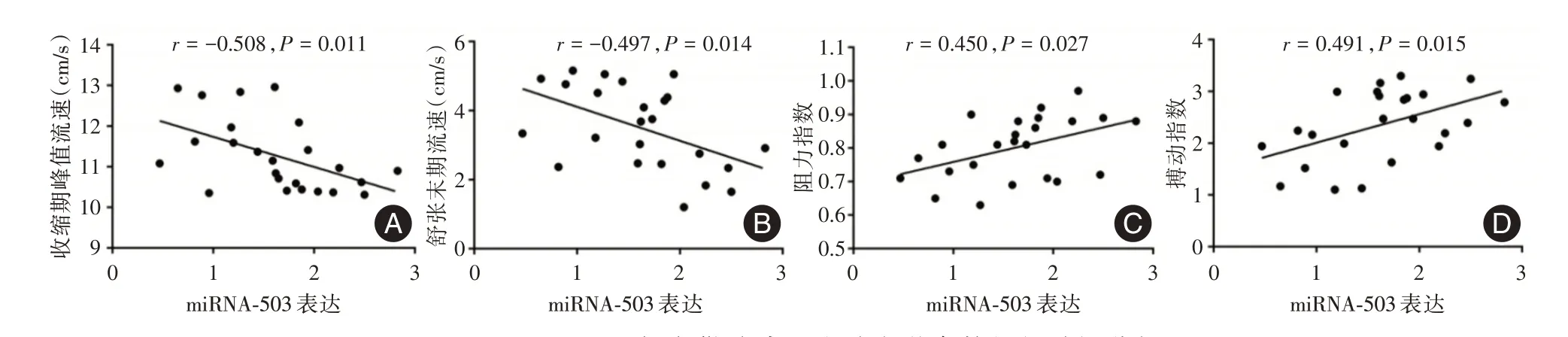
图2 miRNA-503 与卵巢动脉血流动力学参数的相关性分析Fig.2 Correlation analysis of microRNA503 and ovarian artery hemodynamic parameters
2.4 内皮祖细胞的鉴定FITC-UEA-I 染色阳性的细胞呈绿色荧光,Dil-Ac-LDL 染色阳性的细胞呈红色荧光,合并图片后呈橙黄色的细胞为双重阳性染色细胞。见图3。

图3 内皮祖细胞的鉴定Fig.3 Identification of endothelial progenitor cells
2.5 miRNA-503 inhibitor 转染后EPCs 中miRNA-503、IGF-1R的表达qRT-PCR 结果显示,A 组、B组、C 组、D 组miRNA-503 表达水平分别为(1.00 ±0.16)、(2.31±0.37)、(2.24±0.31)、(1.16±0.29),差异具有统计学意义(F=134.800,P<0.001)。miRNA-503 表达水平B 组、C 组高于A 组,且D 组低于B、C组,差异具有统计学意义(P<0.05)。见图4A。
qRT-PCR 和WB 结果显示,A 组、B 组、C 组、D组IGF-1R mRNA 表达水平分别为(1.00 ± 0.14)、(0.35±0.17)、(0.31±0.21)、(0.78±0.18),差异具有统计学意义(F= 86.680,P<0.001);IGF-1R 蛋白质表达水平分别为(1.00±0.15)、(0.48±0.19)、(0.42±0.20)、(0.81±0.19),差异具有统计学意义(F=53.900,P<0.001)。以上指标B 组、C 组、D 组低于A 组,且D 组高于B、C 组,差异具有统计学意义(P<0.05)。见图4B、4C。
2.6 miRNA-503 inhibitor 转染后EPCs的增殖和黏附B、C、D 组的增殖、黏附水平均低于A 组,且D 组高于B、C 组,差异具有统计学意义(P<0.05)。见表2。
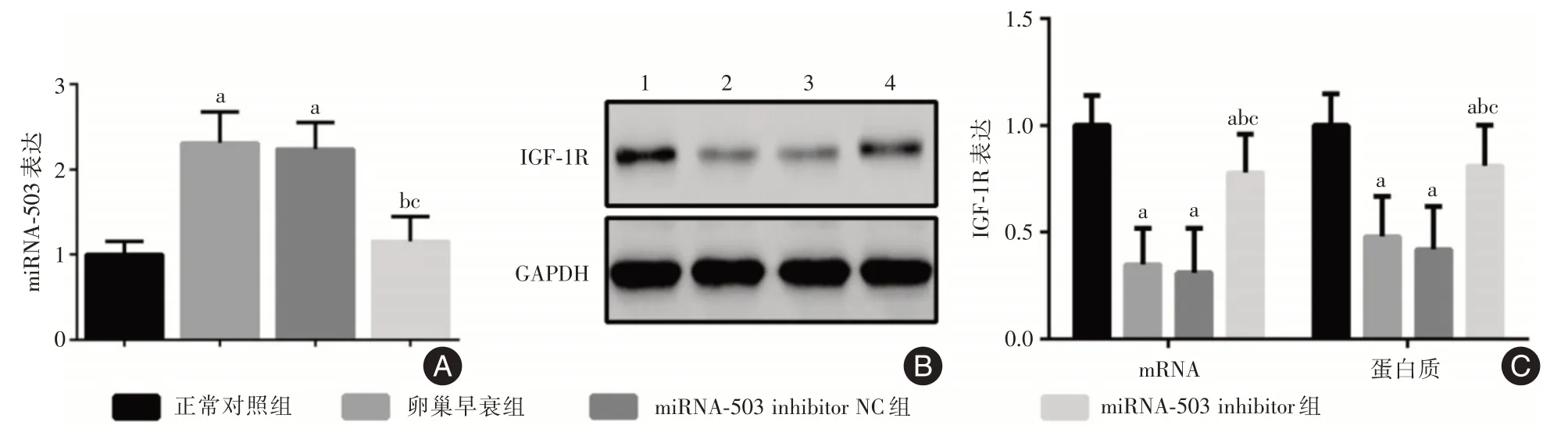
图4 miRNA-503 inhibitor 转染后EPCs 中miRNA-503、IGF-1R的表达Fig.4 Expression of miRNA-503 and IGF-1R in EPCs after transfection with miRNA-503 inhibitor
表2 miRNA-503 inhibitor 转染后EPCs的增殖和黏附Tab.2 Proliferation and adhesion of EPCs after transfection with miRNA-503 inhibitor ±s
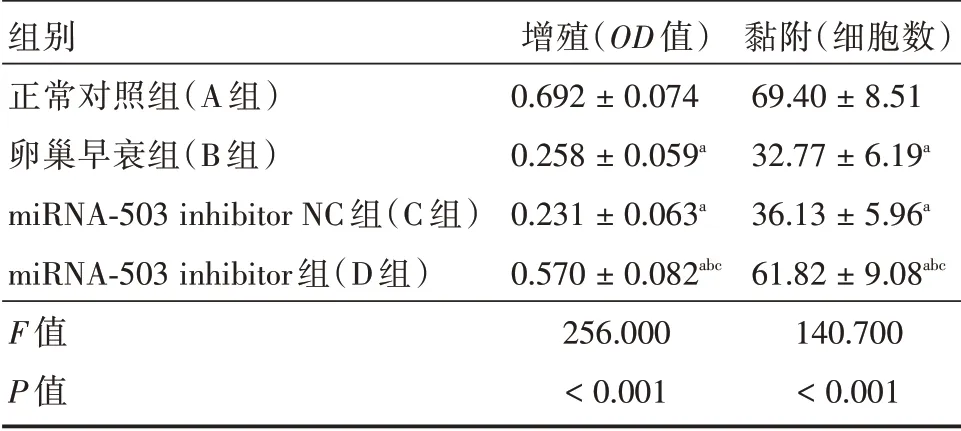
表2 miRNA-503 inhibitor 转染后EPCs的增殖和黏附Tab.2 Proliferation and adhesion of EPCs after transfection with miRNA-503 inhibitor ±s
注:与正常对照组比较,aP <0.05;与卵巢早衰组比较,bP <0.05;与miRNA-503 inhibitor NC 组比较,cP <0.05
组别正常对照组(A 组)卵巢早衰组(B 组)miRNA-503 inhibitor NC 组(C 组)miRNA-503 inhibitor 组(D 组)F 值P 值增殖(OD 值)0.692±0.074 0.258±0.059a 0.231±0.063a 0.570±0.082abc 256.000<0.001黏附(细胞数)69.40±8.51 32.77±6.19a 36.13±5.96a 61.82±9.08abc 140.700<0.001
3 讨论
卵巢早衰是各种原因导致的卵巢功能衰退,典型特征为FSH 和LH 水平升高,而E2水平降低,本研究也分析了纳入患者的激素水平,与上述特征一致。卵巢早衰的发病危险因素包括妊娠、人流、家族史等,本文也发现卵巢早衰组患者的妊娠次数和人流次数高于对照组,与文献[12]报道一致。虽然卵巢早衰组较对照组在家族史比例方面有升高的趋势,但是差异无统计学意义,与文献[12]报道不一致,可能与本文纳入患者的数量较少有关。
卵巢动脉可以为卵泡成熟提供循环支持,影响着卵巢储备功能,血流灌注降低是卵巢早衰的主要病理机制之一。近年研究发现,miRNA-503可以抑制血管生成,其表达水平受到一系列血管生成相关因素的调节,包括缺氧、炎症等[13]。本文结果显示卵巢早衰组miRNA-503 表达水平明显升高,提示miRNA-503 可能在卵巢早衰的发生发展中发挥着重要的病理作用。而且彩色多普勒超声及相关分析结果显示,随着miRNA-503 表达水平升高,卵巢动脉的血液灌注量降低,而血管阻力增加,表明miRNA-503 高表达与卵巢动脉血流动力学减退相关。目前临床上对卵巢早衰患者的病情程度及疗效评价仍然以症状、激素、经阴道超声为主,但是这些指标的量化性能较差,而miRNA-503水平检测可能为定量评价提供一个新的选择[14]。
EPCs 是一类主要参与血管生成的多能干细胞[15-16]。在各种疾病中外周血EPCs 数量会发生改变,如DENG 等[17]发现急性缺血性中风患者的循环EPCs 水平显著低于健康对照组。本文也检测了CD34 和VEGFR2 双阳性的EPCs 数量,发现卵巢早衰组患者较对照组外周血中EPCs 数量显著降低,与上述文献中的结论相近,即血管生成能力不足的疾病常伴随有较低数量的循环EPCs。
miRNA 参与调节EPCs 增殖、黏附等功能[18]。本文对miRNA-503 表达水平和EPCs 数量进行相关性分析,结果显示两者呈负相关,表明miRNA-503致卵巢早衰血流动力学减退的机制可能与EPCs有关。为了进一步探讨miRNA-503 对EPCs的影响,本研究分离和培养了卵巢早衰患者EPCs,使用miRNA-503 inhibitor 转染可使细胞增殖和黏附水平升高,提示miRNA-503 对EPCs 功能具有抑制作用。ZHU 等[19]在研究缺氧诱导心肌细胞凋亡时发现,miRNA-503 可靶向作用于IGF-1R。因此,IGF-1R 可能是miRNA-503 下游靶基因,本文结果也显示miRNA-503 inhibitor 转染可促进IGF-1R的表达,间接证实了这一结论。
综上所述,卵巢早衰患者血浆中miRNA-503高表达,与EPCs 数量减少及卵巢动脉血流动力学减退相关。miRNA-503 在卵巢早衰EPCs 中高表达,miRNA-503 inhibitor 转染后可增强EPCs 增殖和黏附能力,可能与IGR-1R 表达上调有关。
