新辅助化疗后N0的早期乳腺癌患者术后放疗的临床价值
2019-09-19贺春钰糟航木妮热木沙江艾秀清
贺春钰 糟航 木妮热·木沙江 艾秀清
新疆医科大学附属肿瘤医院(乌鲁木齐830011)
新辅助化疗(neoadjuvant chemotherapy,NAC)是指在恶性肿瘤局部实施手术或放射治疗前应用的全身性化疗,其目的是降低肿瘤负荷达到降低期别的效果,消除微小浸润灶利于及早控制远处转移灶,而且可以准确地判断肿瘤对化疗药物的敏感性。乳腺癌新辅助化疗开展于20 世纪70年代,相关临床研究也已开展了约30 余年,术前新辅助化疗的应用范围也逐渐放宽,已经从不可手术的局部晚期乳腺癌扩展至可手术乳腺癌,为患者提供了根治性切除或乳房保留的可能[1]。乳腺癌术后的放射治疗主要依据术后病理,由于NAC可以改变初始的乳腺癌分子分型、病理分期等重要的临床病理特征[2],所以说新辅助化疗在一定程度上降低了术后病理对放射治疗指征的指导价值,使得NAC 后的辅助放疗的决策更为复杂,且目前研究成果有限。2018年的NCCN 指南、中国临床肿瘤学会和中国抗癌协会乳腺癌诊疗指南和规范中已达成共识:临床分期Ⅲ期患者不考虑其对新辅助化疗的反应,均应接受术后放疗(postmastectomy radiotherapy,PMRT)[3-5]。但随着新辅助化疗的广泛的开展及有效率的提高,临床分期为Ⅱ期的cT1-3N1M0的患者也开始实行新辅助化疗,并且部分患者获得了原发灶和腋窝完全病理缓解(complete pathologic response,pCR)或腋窝淋巴结转移转阴(pathologic node negative,pN0),这种治疗顺序的改变使早期乳腺癌患者术后辅助放疗的选择成为了难点,目前还没有循症医学证据来回答这个问题。因此,在提倡精准治疗的时代,很有必要针对这部分患者就术后辅助放疗进行随机分组研究,为临床的个体化治疗提供理论依据。
1 资料与方法
1.1 一般资料搜集本院2008年1月至2016年6月期间住院的临床分期为cT1-3N1M0乳腺癌患者,治疗前均行乳腺和腋窝淋巴结穿刺活检,经病理证实为浸润性癌且腋窝淋巴结阳性。新辅助化疗后病理证实达到pCR 或pN0,临床及病理分期根据AJCC 第七版乳腺癌分期标准。共有54 例女性患者入组,病理类型均为浸润性导管癌,全组患者就诊时均未发现远处转移。本研究经医院伦理委员会审核并批准。
1.2 治疗方法(1)手术:所有患者均行全乳切除+腋窝淋巴结清扫术/前哨淋巴结活检术。(2)化疗:所有患者均行术前新辅助化疗,化疗总数6 个周期,其中TAC 18 例、AC-D 4 例,EC-D 4 例,AC-TH 16 例,TE 6 例,TA 5 例,TCbH1 例(T:紫杉醇,D:多西他赛,E:表柔比星,A:多柔比星,C:环磷酰胺,Cb:卡铂,H:曲妥珠单抗)。(3)放疗:所有患者随机分为放疗组和未放疗组。放疗组患者接受术后调强放疗,放疗部位为患侧胸壁及锁骨上/下区。靶区剂量PTV50 Gy/25 次,2 Gy/次,5 次/周。(4)靶向治疗:20 位Her-2 过度表达的患者仅有14 例接受赫赛汀治疗。余患者因经济因素拒绝使用。(5)内分泌治疗:所有ER 和(或)PR 为阳性者均行内分泌治疗。绝经前均口服三苯氧氨,共18 例,绝经后口服来曲唑6例,口服阿那曲唑1例。
1.3 研究终点局部复发定义为首次出现同侧胸壁、腋窝、锁骨上下或内乳淋巴结复发,远处转移定义为首次出现局部外其他部位的转移。根据以上定义研究终点包括了包括局部复发时间、远处转移时间、无病生存时间和总生存时间。
1.4 统计学方法采用SPSS 17.0 软件对组间数据分布比较行χ2检验,Logrank 法检验单因素预后分析。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料比较54 例女性患者的中位年龄为45 岁,绝经前患者占74.5%。病理类型均为浸润性导管癌。两组临床资料在年龄、组织学分级、病理分期、免疫组化等方面差异无统计学意义(P>0.05),放疗组脉管癌栓比例较未放疗组高,差异有统计学意义(P<0.05)。见表1。

表1 两组患者的临床特征比较Tab.1 Comparison of clinical characteristics between two groups of patients 例
2.2 预后分析两组均随访36 个月以上,3年随访率100%,预后事件发生情况见表2。两组3年生存指标:与放疗组比较,未放疗组3年局部复发率、远处转移率、无瘤生存率、总生存率差异均无统计学意义。见表3。
2.3 影响预后的因素分析3年的预后的单因素分析显示:年龄、组织学分级、免疫组化对各生存指标无影响(P>0.05),但脉管癌栓对总生存率、局控率、无瘤生存率均有影响(P<0.05)。
3 讨论
腋窝淋巴结的状态是指导乳腺癌术后放疗最重要的指标。国内外临床研究均已证实新辅助化疗中pCR 是一个强有力的提示预后良好的指标[6]。NAC 后腋窝淋巴结仍为阳性者,其术后辅助放疗的地位是毋庸置疑的[7-8]。然而对于早、中期的乳腺癌患者来说,NAC 后腋窝淋巴结转阴的病理结果是否能成为指导术后辅助放疗的指标呢?目前仍然是尚未解决的问题。本研究就是特异性选定临床分期为N1的经NAC 后达到病理缓解的乳腺癌患者进行前瞻性研究,该实验的结果将对新辅助化疗后放疗提供一定的理论支持。
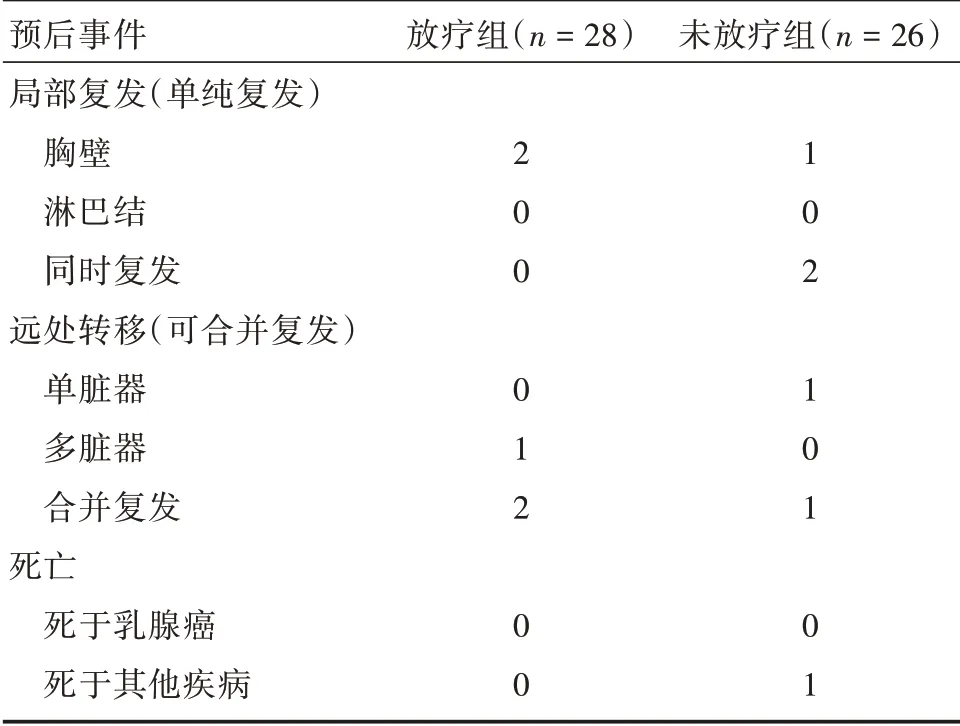
表2 两组预后事件发生情况Tab.2 Occurrence of prognostic events in two groups 例
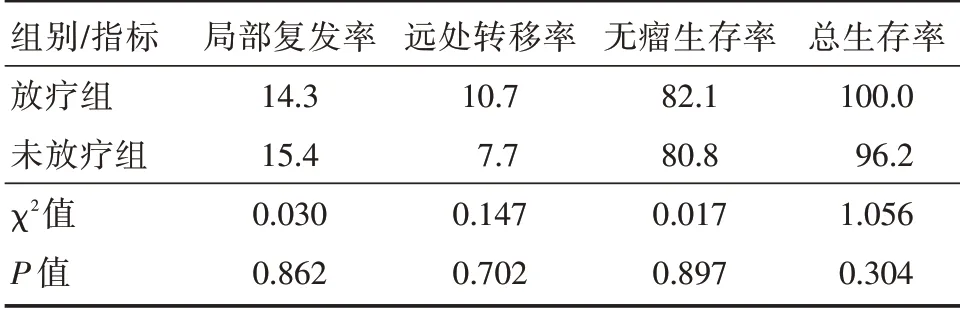
表3 两组的3年预后指标比较Tab.3 Comparison of 3-year prognostic indexes between the two groups%

表4 33 例乳腺癌患者3年预后指标单因素分析Tab.4 Univariate analysis of 3-year prognostic factors in 33 patients with breast cancer
本研究显示,对于T1-3N1的患者,新辅助化疗后达到腋窝淋巴结病理缓解,是否行术后放疗,3年的局部复发、总生存率是没有任何差异。早在2004年HUANG 等[9]研究发现在新辅助化疗后,对于腋窝淋巴结1 ~3 个转移者,放疗对降低局部复发没有任何益处。一些回顾性研究发现在新辅助化疗后腋窝淋巴结阴性患者的5年的局部复发率很低,都小于2%[10-11]。随机临床研究也发现,与辅助化疗的患者相比,新辅助化疗达到病理缓解的患者局部复发率及病死率都明显降低[12],而且新辅化疗后达到病理缓解行乳房切除术的患者,不放疗局部复发率也很低,放疗无明显获益[13]。以上研究均表明,新辅助化疗后腋窝的病理状态与局部复发有密切关系,而且新辅助化疗后腋窝淋巴结阴性的患者预后较好。这对放疗的决策选择有一定参考性,但都是小样本的回顾性研究。本研究虽为前瞻性研究,但病例的特殊性导致入组的整体人数少,因此从循证医学的角度上来看证据价值有限。此外,本研究的随访时间较短,而早期乳腺癌术后放疗的生存获益在5 ~10年中会有更好的体现,因此,本研究后期还将继续选择合适患者入组,增加随访年限,区分亚组,笔者有信心在进一步补充数据后再行系统分析评估疗效,明确原发T1-3N1M0期乳腺癌NAC 后的病理状态对辅助放疗的指导意义。值得期待的NRG 肿瘤学小组的多中心的随机临床研究,它就是围绕cT1-3N1期女性乳腺癌在新辅助化疗后行乳房切除术后是否行放疗的问题开展研究,它将为新辅助化疗后放射治疗提供更为可靠的理论依据。
本研究还发现新辅助化疗后脉管癌栓是影响总生存率、局控率、无瘤生存率的危险因素。国内外研究均证实脉管癌栓阳性是影响早期乳腺癌预后的因素[14-15]但单独存在时对整体预后的影响机制尚不明确[16]。进一步分析本研究发现,75%的脉管癌栓接受了放疗,故推测放疗对降低NAC 后仍存在脉管癌栓患者复发率有一定作用。因此,本研究也提示在临床中仍残存脉管癌栓的这一类患者可能需要加强治疗手段来改善预后。
在这个肿瘤治疗向“个性化医学”转变的时代,不应该毫无区别地或教条地去选择治疗方案,而是应该在进一步揭开各种危险因素的致病机理的基础上综合考虑患者因素、肿瘤特征、分子分型、治疗反应等各种因素来做出抉择。比如年轻、脉管癌栓、淋巴结包膜外侵犯等因素都可能会在相同分期的基础上增加复发风险,在评价放疗必要性的时侯应该综合评定,这也提示在今后的临床研究中应该进一步细分亚组,真正做到个体化的精准治疗。
