硫代嘌呤甲基转移酶基因多样性对急性淋巴细胞白血病患儿使用糖皮质激素耐受性的影响
2019-09-19赵爱玲丁大领李雪琴王江涛
赵爱玲 丁大领 李雪琴 王江涛
郑州大学附属儿童医院/河南省儿童医院/郑州儿童医院小婴儿病区(郑州450018)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种影响儿童和青少年的肿瘤,其特征为骨髓中过量产生的未成熟白细胞。糖皮质激素(glucocorticoids,GCs)在儿科ALL 治疗中发挥重要作用,治疗效果十分显著,但通常伴随严重的短期和长期的副作用,并且有约25%的患者会产生治疗失败的现象,部分原因是因为GCs 使用过程中导致的不良反应造成的[1]。
基因的遗传变异决定个体对药物剂量的耐受性[2],既往药物基因组学研究表明,治疗ALL的药物对儿童的毒性与单核苷酸多态性(single nucleotide polymorphism,SNP)有一定的关系,而硫代嘌呤甲基转移酶(thiopurine methyltransferase,TPMT)基因是其中研究最多的[3-4]。目前指南推荐ALL 患者在使用巯嘌呤前需进行TPMT 基因的检测,以指导ALL 患儿的合理用药[5]。然而,GCs 作为治疗白血病另一种广泛使用的有效的药物,目前还没有关于TPMT 基因多样性对于ALL 患儿中GCs 使用的副作用影响的研究,尤其是亚洲人群。因此,本研究通过在中国人群中评估TPMT 基因的SNPs 对治疗期间发生的GCs 相关毒性的影响,了解个体的基因构成与药物安全性之间的关系,从而优化ALL 患儿的个体化用药指导。
1 资料与方法
1.1 一般资料本研究回顾性纳入2008-2013年间被诊断为ALL的儿童患者245例,其中男151例,女94例;10岁以下患儿178例,10岁以上患儿67例。另外选取210 例对照组患者,按照基线点年龄、性别、白细胞计数、血糖和肝功能情况进行匹配,纳入条件为之前没有发展为ALL 或其他癌症的患者。该研究得到了郑州大学附属儿童医院医学伦理委员会的批准。入组标准:经详细的病史询问和常规的实验室检查后符合ALL的诊断,同时满足以下条件:(1)未满18岁;(2)骨髓原始细胞≥20%;(3)基线时间点无感染症状、血糖和肝功能正常;(4)没有其他活动性恶性肿瘤。
1.2 随访在基线点收集的数据包括完整的血常规信息,常规生化检测信息和骨髓穿刺结果。获得的临床数据在基因型结果未知的情况下,由儿科肿瘤学家进行盲法评估。为了排除其他化疗药物对于临床表型检测的影响,所有的ALL 患儿进行常规治疗后,每7 天复查1 次,并根据NCI2000毒性标准量表,收集患者毒性数据并进行回顾性分级[6],根据NCI-CTC 对患儿进行感染发生率分类,记录第一次发生异常和感染的随访时间,终点为发生相应事件和使用6-MP 化疗。
1.3 血样采集和检测在基线时间点,使用含EDTA 钠采样管中收集患者大约2 mL的外周血,并使用QIAmp DNA blood kit(Qiagen Inc.)试剂盒按照说明书提取DNA。已知TPMT 基因的3 个SNP 位点:G238C、G460A 和A719 G,会导致TPMT缺乏,并根据YATES 等[7]发表文献中的方法来进行鉴定。SNP 阳性病例使用ABI 3130 遗传分析仪(Applied Biosystems)通过Sanger 测序进一步证实并将其分类为杂合子或纯合子。PCR 扩增引物序列如下:G238C(Exon 5)野生型P2W:5′-GTATGATTTTATGCAGGTTTG-3′,P2C:5′-TAAATAGGAACCATCGGACAC-3′;突变型P2M:5′-GTATGATTTTATGCAGGTTTC-3′,P2C 5′-TAAATAGGAACCATCGGACAC-3′;G460A(Exon 7):P460F 5′-ATAACAGAGTGGGGAGGCTGC-3′,P460R 5′-CTAGAACCCAGAAAAAGTATAG-3′;A719 G(Exon 10):P719NF 5′-GTTACTCTTTCTTGTTTCAGG-3′,P719 NR 5′-TCCTCAAAAACATGTCAGTGTG-3′。
1.4 统计学方法所有的计算都在SPSS 23.0 软件(SPSS,Inc.,Chicago,USA)上进行,使用卡方检验或Fisher 精确检验比较两组患儿的基因型分布;使用t检验比较不同SNP 之间临床指标,用M(P25,P75)表示;使用单因素COX regression 回归和χ2检验研究葡萄糖代谢异常、肝毒性和对感染的易感性同TPMT 基因的SNP 之间的关联;非条件Logistic 回归中使用双侧Fisher 精确检验计算优势比(OR)和95%置信区间(CI)。以P<0.05 为差异具有统计学意义。
2 结果
2.1 TPMT基因的等位频率和基因型分布GCS的药物基因组学主要分析TPMT基因的3种SNP分布。对于所有TPMT 基因的SNP 位点,如表1 所示ALL患儿和对照组之间差异没有统计学意义,这与理论上是一致的,因为TPMT 基因与ALL 疾病的发生无显著的相关性。对于G238C 位点,等位基因C(野生型)的频率为92.0%,等位基因G 其为8.0%(突变型);此外,最常见的基因型是CC(84.0%),不是GC 杂合基因型(16.0%),而病例和对照的GG纯合基因型频率都是0。对于G460A 和A719 G 两种SNP 来说,其基本分布与G238C的情况类似,都是野生型居多,且全部为杂合。

表1 TPMT 基因的SNP 在儿童白血病和对照组中的等位频率和基因型分布Tab.1 Allelic frequencies and genotype distribution of TPMT SNPs in childhood ALL participants and control subjects in baseline point
2.2 TPMT 基因的基因型与治疗中糖皮质激素相关副作用的关系在化疗后2 周,复查患者的肝功能、血糖水平和感染情况,与基线水平进行比较,并评估其与TPMT基因型之间的关系。用白细胞计数(WBC)和降钙素原(PCT)代表患者的感染情况,结果显示,携带G238C和G460A变异的患者,其GC相关感染指标与正常人无明显区别,但携带A719G患者的其降钙素原水平显著升高(P=0.025)。对于肝功能情况来说,G460A 变异与丙氨酸氨基转移酶(ALT)和谷门冬氨酸氨基转移酶(AST)的升高都有显著关系(P= 0.009 和0.010),但G238C 和A719G则无明显差别。见表2。
Logistics回归的结果见表3。将WBC >10×109/L或PCT >0.5 ng/mL定义为感染,将空腹尿糖(Glu)>6.1 mmol/L或糖化血红蛋白(HbA1c)>6%定义为血糖代谢异常,将ALT >80 U/L或AST >80 U/L定义为肝功能异常。结果显示,G460A 与肝毒性显著相关(P=0.014),但3种SNP与血糖代谢都无明显关系。对于感染来说,A719G 变异与感染显著相关(P=0.021),但与G238C和G460A变异则无显著相关性。
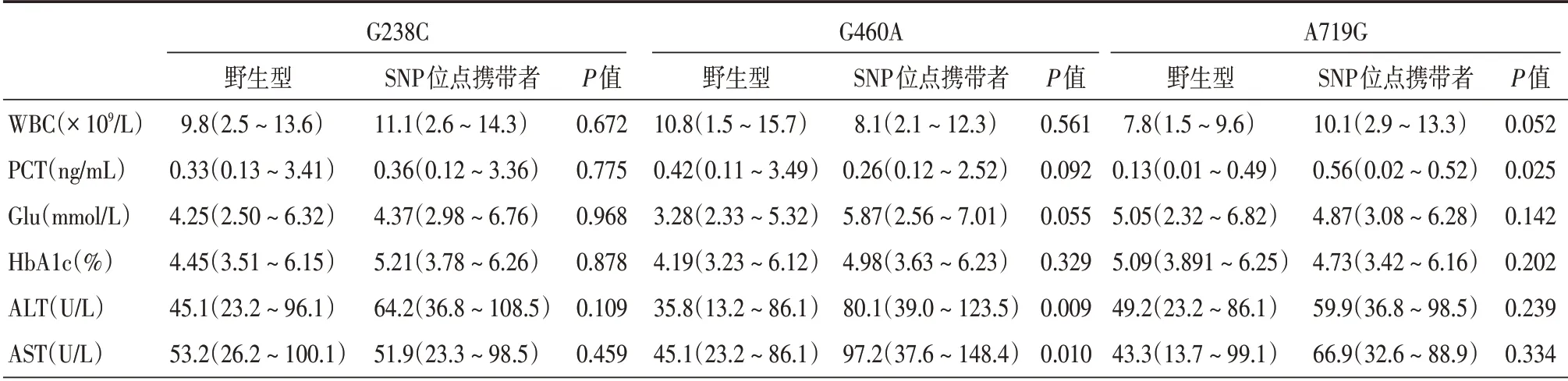
表2 治疗14 d 时白血病患儿不同SNP的临床指标比较Tab.2 Clinical characteristics of ALL children categorized by different SNPs during therapy M(P25,P75)

表3 治疗14 d 时儿童白血病患者基因型和糖皮质激素诱导的肝毒性、血糖代谢异常及感染之间的关系Tab.3 Genotype in ALL children related to glucocorticoid induced liver toxicity,glucose abnormalities and infection during therapy
2.3 随访至诱导期时TPMT 基因型和糖皮质激素相关副作用之间的COX 回归分析在化疗后半年内,定期对患者进行随访,复查患者的肝功能、血糖水平和感染情况,并记录时间。对3 种结果事件进行3 种SNP的多因素分析,见表4。结果显示,A719G 变异是GCs 治疗后感染的独立危险因素(P= 0.044),而G238C 和G460A 变异则不是感染的危险因素。同样的,对于肝毒性和血糖异常来说,本研究的数据未能说明TPMT的3 种SNP是其发生的独立危险因素。
3 讨论
既往研究表明,ALL 治疗中最重要的预后因素是前期治疗阶段患者对于GCs 使用的反应。患者对于GCs的反应差别很大,并伴随着各种副作用和心理变化,最重要的副作用是脂肪分布改变、暂时性糖尿病、肝肿大和免疫抑制导致的感染风险的增加[8],并且儿童患者对GCs 治疗相关的不良事件更敏感,即使基于体重进行剂量调整也是如此。使用GCs的风险广为人知,并发症包括消化性溃疡病、下丘脑-垂体-肾上腺(HPA)轴抑制、脂肪肝、骨质疏松症和感染易感性增加[9]。尽管如此,糖皮质激素仍然是治疗急性淋巴细胞白血病的必需药物。超生理剂量的GCs 可以抑制HPA轴,并且可能导致应激反应受损和宿主对感染的防御不足,最终造成发病和死亡[10]。然而,最近的研究表明低GCs 剂量也与一些不良反应有关,并且这些效应在不同患者中是不同的[11],笔者考虑可能与患者的个体遗传特征的差异性有关。
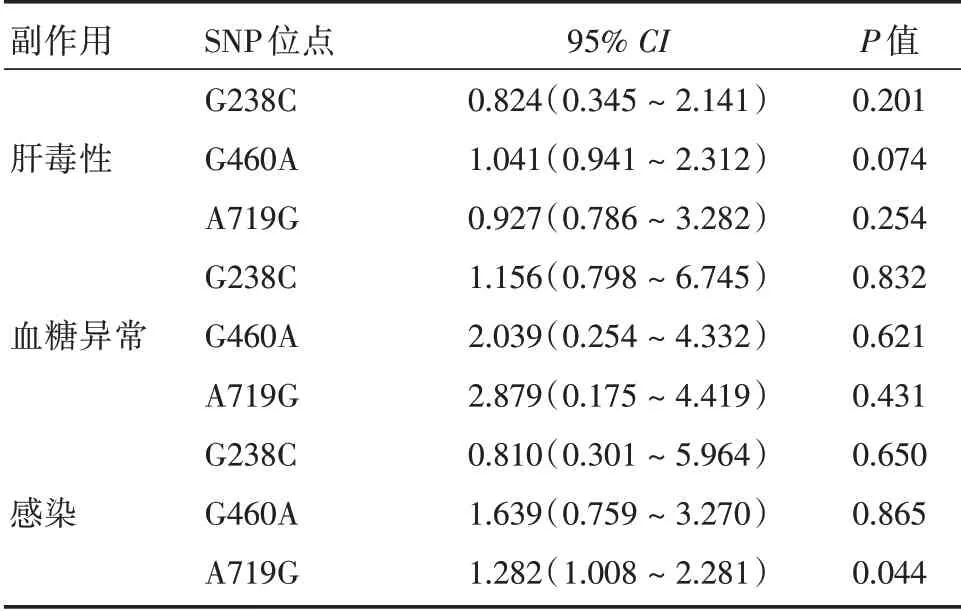
表4 化疗诱导期时基因型和糖皮质激素相关毒性之间的关系Tab.4 Relationship of genotype and glucocorticoid induced toxicity during half-a-year′s follow-up by multivariate cox regression
TPMT 基因的SNPs 与患者对药物使用的反应、抗性、副作用和毒性密切相关,尤其是ALL 常用药物6-MP,在很多前期研究中被证实。然而,目前并没有关于TPMT 与GCs 使用副作用之间关系的研究,考虑到糖皮质激素等类固醇类药物在人体中涉及到诸多代谢途径,因此探究TPMT 基因与GCs 相关副作用的关系是必要的。在ALL的化疗过程中,6-MP 是基本用药,因此本研究在设计时只选取了化疗诱导阶段,此时并没有使用6-MP,因此可以排除是6-MP 药物带来的副反应。检测和调查人群中的SNP 频率是检测疾病治疗结果和药物疗效的个体间差异的基础,基于这点,笔者试图确定中国人群中TPMT 基因中G238C、G460A 和A719G 3 种SNPs的等位基因频率,并确定这些SNP 与GCs 毒性之间的关联。TPMT 基因是常染色体共显性遗传,纯合等位基因突变个体是TPMT 缺陷的,而杂合子个体具有中间酶活性[12]。据统计,TPMT*3A SNP 在高加索人群中的患病率较高[13-14],而亚洲人群的频率低于5%[15-16]。在本研究中,共有455 例中国人群纳入研究中,结果显示纯合CC基因型频率为84%,杂合GC 频率为16%,且未发现突变基因型GG。C的等位基因频率约为9%,较dbSNP 数据库上报道的频率略高[17]。
前期有很多在白血病和正常志愿者患者中关于TPMT 基因型与表型之间的关系的研究,其中G238C、G460A 和A719G 是进行的最多的。本研究发现,TPMT 基因的SNP 多态性确实与GCs 相关的副作用存在一定的关联性,其中A719G 与GCs 有关感染的相关性最大,并在本研究中是诱导阶段使用GCs 后发生感染的独立危险因素。但基因多样性与药物副作用的关系并不是单一的,前期邹泽巧等[18]的研究发现,CYP1A1 A4889G 多态性与ALL 儿童甲氨蝶呤化疗后各毒副反应无关,但与血小板减少发生的可能性相关。除此之外,在本研究中,携带有SNP 突变的患者的肝毒性比例更高,但只有G460A 与肝毒性显著相关,而3 种SNP与血糖代谢都无明显关系。但齐兴菊等[19]研究发现A719G、G460A 基因型与化疗后不良反应并无明显相关性。造成这种差异的可能性是因为该研究没有完全区分不同化疗药物的影响,也没有严格区分检测时间导致的。
本研究首次在中国ALL 患儿中研究TPMT 基因与糖皮质激素化疗后的副反应之间的关联,通过排除相关干扰因素,得出了TPMT A719G 位点与糖皮质激素的使用导致儿科ALL 治疗期间发生感染有关,为临床上ALL 患儿GCs的使用提供一定的用药指导。然而,本研究存在一定的不足之处。虽然纳入的样本量较大,但缺乏多中心、多样化的数据,为结论的进一步推广带来一定的局限性;其次,本研究虽然揭示了TPMT 基因SNP 位点与不良反应之间的关系,但其背后的机制未进行深入的探讨。下一步需要进一步的多中心、多人种的样本来验证其中的关联性,并且需要进一步探究临床联系背后的具体机制。
终上所述,在治疗开始前充分预测抗白血病药物反应是必要的。TPMT 基因的多态性,不仅与6-MP 药物的副作用密切相关,而且与可能也与GCs 使用的副作用有密切关系。通过这些调查,临床医生可以根据特定基因中遗传易感性调整个体化GCs 剂量,减少严重毒性的风险,提高治疗效果。
