ε-聚-L-赖氨酸及其抑菌机理研究进展
2019-09-19李晓玥
李晓玥,刘 潭,杨 博
(湖南农业大学生物科学技术学院,长沙410128)
随着人们对食品安全性的认识和要求日益提高,开发抗菌性强、水溶性好、安全无毒的天然食品防腐剂已成为全世界食品领域研究热点。ε-聚-L-赖氨酸(ε-Poly-L-lysine,ε-PL)是一种天然生物防腐剂,具有抑菌谱广、水溶性好、安全性高、热稳定性好等特点,其优良的防腐性能符合人们对于新型食品防腐剂的要求[1]。ε-PL在日本、韩国等国家已作为食品防腐剂广泛使用[2]。2004年,其被美国食品和药品管理局(FDA)批准为安全食品保鲜剂(GRAS)[3]。我国也在2014年正式批准其作为食品添加剂新品种[4]。近年来,ε-PL在食品等领域的应用与发展,激发了研究者对其抑菌作用机理的探寻。本文在介绍ε-PL特性、菌种选育、发酵生产和应用的基础上,对其抑菌作用机理进行了综述。
1 ε-PL的特性
ε-PL通常由25~35个L-赖氨酸通过ε-氨基和α-羧基脱水缩合形成酰胺键聚合而成,是一种同型单体多肽聚合物。ε-PL的结构如图1。ε-PL的水溶性和热稳定性良好,其水溶液在120℃高压灭菌处理20 min不会发生分解作用[5]。ε-PL分子量一般为2.5~4.5 kDa,为白色或淡黄色粉末,吸湿性较强,略带苦味,微溶于乙醇,不溶于乙酸乙酯、乙醚等有机溶剂[6~8]。由于ε-PL是混合物,所以没有固定的熔点,250℃开始软化分解[9]。红外光谱分析表明,ε-PL在1680~1640 cm-1和1580~1520 cm-1有强吸收峰[10]。

图1 ε-PL的结构
2 ε-PL产生菌的选育
ε-PL的等电点约为9.0,当环境溶液pH<9.0时,其呈酸性带正电荷,这为ε-PL菌株的筛选提供了便利[11]。在筛菌时,菌株分泌的带正电荷的ε-PL可与带相同电荷的琼脂或碱性染料分子(如亚甲基蓝等)产生静电斥力,从而在菌株周围形成肉眼可见的透明圈。同时,属于生物碱的ε-PL还可与Dragendorff或Wagner试剂发生显色反应,因此可简便快速地从环境中筛选出ε-PL产生菌[12]。近年来,国内外学者进行了大量的工作以获取菌种种质资源,分离得到10余种ε-PL产生菌,经形态学、理化性质、16SrDNA测序并进行系统进化树分析等鉴定工作,确定这些来源菌株属于链霉菌属、北里孢菌属、麦角菌属等几类微生物[13]。现今ε-PL的发酵生产通常采用链霉菌属中的白色链霉菌(Streptomyces albulus)。
由于从自然界中筛选的ε-PL产生菌的生长速率和ε-PL产量较低,难以满足生产的需求,故研究者们对ε-PL产生菌进行了大量的育种工作,以提高野生菌的ε-PL产量。鉴于ε-PL产生菌的遗传背景较复杂且尚未揭示清楚,目前关于ε-PL产生菌的育种工作多采用诱变育种的方式进行。Hiraki等[14]利用亚硝基胍(NTG)诱变,并在培养基中加入S-(2-氨基乙基)-L-半胱氨酸(AEC)和甘氨酸进行胁迫,在经过长达20次的诱变后,获得了一株ε-PL产量达2.11 g/L的突变株。陈玮玮等[15]使用硫酸二乙酯(DES)对北里孢菌PL6-3进行化学诱变,并在培养基中加入AEC,获得了一株突变株MY5-36,经摇瓶发酵后其ε-PL产量达到1.17 g/L,是出发菌株的3倍,且经5 L发酵罐分批发酵后的ε-PL产量高达7.72 g/L,较出发菌株提高了7倍以上。李南臻等[16]利用60Co和常压室温等离子体(ARTP)诱变法对白色链霉菌H菌株进行复合诱变,最终选育出一株高产突变株H1-2,经10 L发酵罐发酵后的ε-PL产量高达24.50 g/L,较出发菌株提高了88.5%。此外,核糖体工程、基因工程等新兴技术的发展,加快了育种周期。吴光耀等[17]利用核糖体工程育种方法,成功地将ε-PL的产量提高至3.70 g/L。Li等[18]发现,通过基因组重排技术可以提高菌体对葡萄糖的利用率,最终使ε-PL的产量提高了1.88倍。
3 ε-PL的发酵生产
目前,日本等国家通过微生物发酵法已经实现ε-PL的工业化生产,而我国对ε-PL的研究基本还处于实验阶段,仅有浙江新银象等少数几家公司进行了商业化应用。关于ε-PL的发酵生产,可通过优化菌种培养基和培养条件的方式提高ε-PL的产量。Shima等[19]利用野生菌S.albulus,探究了不同碳氮源对其代谢产ε-PL的影响,发现葡萄糖或甘油可以作为碳源被利用,而氮源可以是硫酸铵或者是酵母膏。Shih等[20]使用响应面法对S.albulus菌种的培养基成分进行了优化,结果表明对该菌株产ε-PL影响最大的3个因素分别为酵母膏、硫酸铵以及葡萄糖,经优化后,ε-PL产量从0.75 g/L增长到了8.13 g/L,产量提高了将近10.84倍。另外,培养过程中的pH对ε-PL产量也有一定影响。当菌体的生物量积累到一定程度时,培养基的pH值降低到4.2左右对于ε-PL的积累是至关重要的。Kahar等[21]利用S.albulus410菌株建立了pH两阶段调控的发酵工艺,先将pH值控制在5.0以上以积累菌体量,再将pH值控制在有利于菌体代谢产生ε-PL的4.0环境,这使得ε-PL产量大大提高,从原始的5.72 g/L提高到了48.35 g/L。
4 ε-PL的应用
ε-PL作为一种性能优良的天然防腐剂,目前主要作为食品添加剂广泛应用于米饭、面食、鱼类制品等传统食品的防腐保鲜[22]。在日本,利用ε-PL作为食品防腐剂的商业化应用发展迅速,市场规模早已超过数十亿日元。ε-PL作为新型食品防腐剂,不仅可以单独使用,还可与其他食品添加剂混合使用以提高防腐能力。徐红华等[23]研究发现,ε-PL和甘氨酸复配能够延长牛奶的货架期,保存11 d后仍无变质迹象。ε-PL还可作为药物及DNA的载体,广泛应用于医学和制药领域。氨甲蝶呤是目前治疗白血病和恶性肿瘤最为常用的药物,它与作为载体的ε-PL相结合,能使靶细胞对它吸收率大大提高[24]。另外,ε-PL为多阳离子聚合物,还能与带电质粒经静电相互作用形成一种内含可避免核酸酶降解的基因复合物,从而提升基因DNA药物的转移效率[25]。除此之外,ε-PL还可作为吸水材料,与丙烯乙二醇酯结合形成具有高吸水性的水凝胶,该水凝胶对吸水量的反应灵敏度较高,且具有一定的抑菌活性,可广泛应用于卫生巾及婴儿纸尿裤等系列产品中[26]。
ε-PL广泛应用的同时,其安全性也受到考量。Neda等[27]通过小鼠慢性和亚急性灌胃实验及对ε-PL的毒理学进行监测,发现ε-PL在各种实验条件下均无任何毒性,且对神经、免疫、生殖系统以及胚胎发育都不会产生毒害。Hiraki等[28]通过放射法研究发现,ε-PL在胃肠道内几乎不被吸收,7日内检测到放射性标记的ε-PL经排泄途径缓慢排出,在机体内不存在累积作用。因此ε-PL作为一种新型的生物防腐剂是安全可靠的。
5 ε-PL的抑菌机理
5.1 ε-PL的抑菌作用
ε-PL具有广谱抗菌性,且经加热后也能发挥较好的抑菌效果,并在与其他防腐剂或试剂(如乳酸链球菌素、醋酸等)复合使用时可在一定程度上提高抑菌活性。Shima[29]于1984年首次提出了ε-PL的抑菌性,发现ε-PL对革兰氏阳性细菌、革兰氏阴性细菌和真菌的生长繁殖均有着显著的抑制作用。研究表明,ε-PL对能够引起食物腐败的多数菌种均有一定的抑制作用,如酵母菌属中的尖锐假丝酵母、红发夫酵母,革兰氏阳性菌中的凝结芽孢杆菌、枯草芽孢杆菌,革兰氏阴性菌中的产气节杆菌、大肠杆菌等,故ε-PL的抑菌范围较广[30]。ε-PL经80、100、121℃处理一定时间后,其抑菌效果仍基本不变,具有较好的热稳定性[31]。另外,ε-PL还可与其他添加剂复合使用以增强抑菌效果。据报道,ε-PL与0.1%强醋酸的复合使用后的抑菌效果较单独使用时明显增强,其与0.1%甘氨酸的复合抑菌效果次之[31]。
5.2 ε-PL的抑菌机理
目前关于ε-PL抑菌作用机制的研究主要集中在酿酒酵母、大肠杆菌、枯草芽孢杆菌及李斯特菌等菌种,这些菌种分别代表真菌、革兰氏阴性菌和革兰氏阳性菌。根据菌种特性的不同,ε-PL的抑菌作用效果及机制有着较明显的差异。
5.2.1 ε-PL对酿酒酵母的作用机制
ε-PL对真菌的抑菌机理研究,主要以酿酒酵母(Saccharomyces cerevisiae)作为对象进行探究。薄涛等[32]研究发现,ε-PL对酿酒酵母的抑菌作用强弱依赖于ε-PL所添加的浓度。添加低于200μg/mL的ε-PL对酿酒酵母生长有一定的抑制作用,添加200~500μg/mL的ε-PL对酿酒酵母生长有明显抑制作用,而添加500μg/mL以上的ε-PL则对酿酒酵母生长致死率高达100%。这种与作用浓度相关的现象,可能是ε-PL存在一定的作用阈值浓度。此外,研究发现ε-PL可提高酵母细胞膜的通透性和疏水性。同时,二价阳离子可对ε-PL的抑菌活性产生一定影响。当二价阳离子(如Mg2+、Ca2+等)浓度达到一定值时,可对ε-PL抑菌活性产生削弱作用。利用扫描电子显微镜(SEM)对不同浓度ε-PL处理后的细胞表面进行观察后发现,当用500μg/mL的ε-PL处理酿酒酵母后,其细胞表面会出现孔洞、微胶粒或发生磷脂双分子层的弯曲等现象。
另外,ε-PL对酿酒酵母的抑制作用还可能与细胞内活性氧(ROS)水平上调引起的细胞凋亡相关。Tan等[33]使用二氢睾酮罗丹明123(DHR 123)测定了经ε-PL处理后的酿酒酵母细胞内的ROS水平,并利用4,6-联脒-2-苯基吲哚(DAPI)对细胞核DNA分子进行染色,以考察核DNA的变化。结果表明,ε-PL处理细胞12 h后,细胞内的ROS水平显著上调,同时观察到DNA的片段化,细胞发生死亡。推测该现象与细胞凋亡现象类似,但仍有待进一步验证。Liu等[34]对ε-PL和乳酸链球菌素(Nisin)组合使用后的抑菌效果及协同抗菌机制进行了探究,发现Nisin能迅速破坏细胞壁和细胞膜,有利于ε-PL随即进入细胞,与核DNA相互作用以阻止DNA复制。这项研究为ε-PL抑菌机制中有关ε-PL引起ROS水平上调、作用于核DNA进而诱导细胞凋亡的阐明奠定了基础。Ye等[45]研究也发现,ε-PL作为一种多肽类抑菌剂,会在大肠杆菌中引起ROS胁迫,并且DNA损伤应答(SOS应答)调节基因的表达会受到ε-PL的影响。
近年来,代谢组学技术的蓬勃发展也推动了ε-PL抑菌机制的阐明。代谢组学旨在系统地分析生物中整个小分子代谢物的组成和动态响应,进而揭示生命的表型变化。Bo等[35]通过GC-MS等技术分析检测了经ε-PL处理后的酿酒酵母细胞内代谢物的变化情况。结果表明,ε-PL处理酿酒酵母后,能引起细胞内多种代谢物(主要包括碳水化合物、醇类、脂类和氨基酸)的代谢水平发生变化。ε-PL会引起细胞内葡萄糖的积累,这表明其可能抑制了糖酵解过程。同时,它会引起糖酵解途径的中间代谢物(如3-P-甘油酸、丙酮酸等)的浓度降低,这意味着ε-PL可能会对糖酵解途径产生抑制。另外,它还能使三羧酸循环中间体(如谷氨酸、尿素、鸟氨酸等)浓度增加,从而使琥珀酸盐浓度降低,这表明α-酮戊二酸主要转化为谷氨酸,进而可能导致ε-PL对三羧酸循环的抑制。以上研究表明,ε-PL可能通过破坏膜功能,间接地抑制中心碳代谢,从而使菌种对数期延长,抑制菌种的生长,或作用于与代谢密切相关的细胞膜,使磷脂层瓦解,从而使菌种死亡。
5.2.2 ε-PL对大肠杆菌的作用机制
ε-PL对革兰氏阴性细菌的抑菌机理研究,主要以大肠杆菌(Escherichia coli)作为对象进行探究。ε-PL对大肠杆菌的抑菌作用强弱同样依赖于ε-PL所添加的浓度。付萍[36]的研究表明,50μg/mL以下的ε-PL处理大肠杆菌后可使其对数期延长,50~150μg/mL的ε-PL处理大肠杆菌后可使其生长受到明显抑制,而150μg/mL以上的ε-PL处理大肠杆菌后可使其菌液近乎澄清。这同样表明ε-PL发挥抑菌作用需要一定的阈值浓度。由于大肠杆菌作为一种革兰氏阴性菌,具有内外膜结构,所以,研究者考察了不同浓度的ε-PL对大肠杆菌内外膜的作用[36~38]。结果发现,高浓度ε-PL对细胞外膜的破坏作用较强,作用40 min后,由疏水探针NPN(NPhenyl-1-naphthylamine)标记的细胞外膜的荧光强度变化趋于平缓。推测带正电荷的ε-PL可能与大肠杆菌表面呈负电荷的脂多糖通过静电作用结合,从而使大肠杆菌外膜通透性增加。同时,ε-PL处理菌体后经不同时间段检测,发现细胞内膜的β-半乳糖苷酶含量均无明显变化,而用不同浓度的ε-PL处理大肠杆菌后,其内膜的β-半乳糖苷酶含量会发生明显变化。这表明ε-PL对大肠杆菌的作用是瞬时的,并会造成菌体内膜的通透性发生改变。利用扫描电子显微镜(SEM)对ε-PL处理后的大肠杆菌表面的形态变化进行观察,发现经不同浓度的ε-PL处理后,菌体细胞表面会呈现出明显的褶皱、凸起和凹陷,同时菌体间会发生聚集粘连。这一现象与抗菌肽抑菌机理中的毡毯模型极为相似。
Hyldgaard等也对ε-PL作用于大肠杆菌的抑菌机制进行了研究[38]。他们测定了大肠杆菌细胞膜表面的Zeta电位,并同样研究了二价阳离子对抗菌活性的影响,同时通过原子力显微镜(AFM)观测了ε-PL对细胞形态的影响。发现在对细胞膜进行荧光标记后,有荧光小囊泡的形成,这进一步验证了ε-PL的抑菌机理可能与抗菌肽抑菌机理中的毡毯模型类似。同时,Shima[39]和Vaara[40]发现,阳离子多肽ε-PL通过离子吸附与带负电的细胞表面相互作用,可干扰并破坏LPS层,导致外膜透化。Hyldgaard等[38]进一步考察了ε-PL对更高耐受性的大肠杆菌ΔrscC突变体的影响,发现荚膜外多糖荚膜异多糖酸的过量表达,有助于调节菌体生物膜的三维结构,并起到一定的屏障作用。去除脂多糖后,发现ε-PL作用于膜磷脂。
5.2.3 ε-PL对枯草芽孢杆菌及李斯特菌的作用机制
ε-PL对革兰氏阳性细菌的抑菌机理研究,主要以枯草芽孢杆菌(Bacillus subtilis)及李斯特菌(Listeria monocytogenes)作为对象进行探究。Liu等[34]考察了ε-PL和Nisin对枯草芽孢杆菌细胞壁的影响,发现ε-PL单独作用时仅使细胞轻微受损,Nisin单独处理枯草芽孢杆菌后,细胞表面粗糙,细胞壁明显受损。而当两种物质复合作用时,可使细胞表层结构明显受损。同时细菌近似空心状态,细胞内含物逸出。由于Nisin主要被认为作用于细胞表面,故推测ε-PL可能作用于微生物内部结构[41]。
Hyldgaard等[38]初步探究了ε-PL对李斯特菌的抑菌机理。发现ε-PL对菌体形态的影响较小,推测可能是肽聚糖对细胞结构的维持作用所引起。李斯特菌的细胞膜含有赖氨酸衍生的磷脂酰甘油和赖氨酰心磷脂[42~44]。赖氨酸心磷脂是两性离子[43],没有净负电荷,而磷脂酰甘油能进一步减少细胞膜的负电荷,从而减少细胞膜对阳离子肽即ε-PL的亲和力[42]。因此ε-PL对李斯特菌具有较高的MIC,进而经ε-PL处理后,菌体细胞膜的通透性较低。综上所述,关于ε-PL对革兰氏阳性细菌的抑菌机理研究报道较少,其作用机制有待进一步揭示。
5.2.4 ε-PL对不同菌种的抑菌作用机制比较
从上述ε-PL对不同菌种的作用机制来看,ε-PL对菌种产生抑制作用需要一定的阈值浓度,并可能因细胞壁的结构不同而存在差异。在真菌酿酒酵母的研究中,500μg/mL的ε-PL可使菌种致死。而在革兰氏阴性细菌大肠杆菌的研究中,150μg/mL的ε-PL即能使菌体聚合沉降,菌液变澄清。有研究推测这可能是由于革兰氏阴性菌外膜主要由脂多糖和磷脂构成,其肽聚糖层相对较薄且稀疏,故其机械强度偏低。酵母菌其细胞壁最外层为甘露聚糖蛋白,内层葡聚糖起主要细胞机械强度的作用,因其交联程度低,故机械强度相对较低,但高于革兰氏阴性菌。而革兰氏阳性菌细胞壁富含交联的肽聚糖层,具有较高的机械强度。所以,在前述的革兰氏阳性菌经ε-PL处理后,其细胞表面变化可能相对稳定[36]。
另外,从前述研究中还发现,ε-PL可能影响菌体细胞膜的通透性和疏水性。在酿酒酵母的研究中,经碘化丙啶染色和荧光强度检测,发现500μg/mL的ε-PL对菌体细胞膜产生了损伤,增加了细胞膜的通透性。而在大肠杆菌的研究中,ε-PL影响了细胞内外膜的通透性。有研究推测,酵母菌作为一种真菌,其细胞壁最外层为甘露聚糖蛋白,带有负电荷。同样,革兰氏阴性细菌的细胞壁富含脂多糖,会使菌体细胞表面带有大量的负电荷。因此,带较多负电荷的酵母菌和革兰氏阴性菌的细胞表面与带正电荷的ε-PL作用面积会较大。而革兰氏阳性细菌细胞壁结构主要由肽聚糖组成,细胞表面所带的负电荷通常较为稀疏,因此ε-PL可能只会对革兰氏阳性细菌的细胞壁造成局部破坏[36]。
5.2.5 ε-PL可能的抑菌机制模型
(1)ε-PL抑菌机制与毡毯模型。Hyldgaard等[38]研究了ε-PL的抑菌机制,从多方面验证并提出了ε-PL可能作用于膜磷脂进而产生抑制作用的机制,并认为ε-PL与大肠杆菌相互作用的模型很可能为毡毯模型(图2)。毡毯模型是抗菌肽抑菌机制中的主要模型之一。在毡毯模型中,抗菌肽通过静电吸附作用,与细胞膜上富含阴离子的磷脂分子头部相结合,类似地毯状地覆盖于细胞膜磷脂双分子层的表面。当抗菌肽的浓度达到阈值后,会在细胞膜上形成瞬时孔洞,使更多未结合的抗菌肽进入细胞内部。此时,磷脂双分子层会发生弯曲及损伤,随之细胞膜逐渐裂解并与抗菌肽结合形成微胶粒。而在前述的ε-PL对酿酒酵母的抑菌机制研究中,500 μg/mL的ε-PL作用于酿酒酵母时对其是完全抑制的,显微观察发现酿酒酵母经一定浓度的ε-PL处理后表面有明显的凹陷,并会形成微胶粒(图2)。这些现象均从一定程度上印证了ε-PL抑菌机制与毡毯模型的相似性。

图2 毡毯模型
(2)ε-PL抑菌机制与ROS诱导细胞凋亡模型。据报道,ε-PL抑菌机制可能与ROS诱导的细胞凋亡有关。Ye等[45]研究发现,ε-PL会在大肠杆菌中引起ROS胁迫,且DNA损伤应答(SOS应答)调节基因的表达会受到ε-PL的影响。近年来,有较多研究报道了抗菌肽通过ROS诱导细胞凋亡的模型,如有关PAF26、coprisin、melittin等的研究[46~48]。在前述的Tan等[33]报道的关于ε-PL对酿酒酵母细胞内ROS积累和DNA片段化的研究中,也进一步阐述了该机制的可能性(图3)。当ε-PL处理细胞12 h后,细胞内的ROS水平显著上调,同时观察到DNA的片段化,从而引起细胞死亡。同时,在与其他抑菌剂组合使用后的抑菌研究中,还发现ε-PL可与核DNA相互作用的现象。因此,ε-PL可能也会通过调控ROS水平间接影响DNA,从而使细胞凋亡。
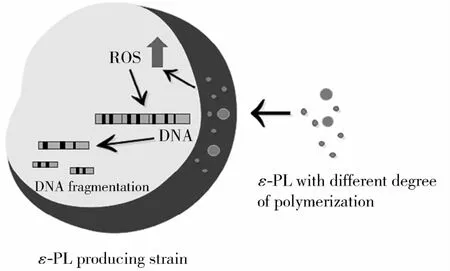
图3 ROS诱导细胞凋亡模型
6 ε-PL研究展望
ε-PL作为一种抗菌谱广、安全无毒的天然食品防腐剂,具有广阔的商业化前景。但目前ε-PL的生物合成机理和抑菌机制尚未揭示清楚,阻碍了其商业化应用。因此,研究ε-PL的微观合成机理及抑菌机理具有重要的科学意义。今后在探究上述机制的基础上,可从菌种种质资源改良、多组学分析、代谢调控及发酵优化等方面对ε-PL产生菌进行研究,以有效提高ε-PL的产量,并加强ε-PL的应用研究,最终实现ε-PL的产业化应用。
