银耳多糖乙酰化修饰及其抗氧化活性
2019-09-18徐兵陆灏钰徐倩陈义勇
徐兵,陆灏钰,徐倩,陈义勇
(常熟理工学院生物与食品工程学院,江苏常熟215500)
银耳(Tremella fuciformis)又名白木耳,含有酚类、黄酮类及膳食纤维等[1]物质,银耳多糖(polysaccharides from Tremella fuciformis,TFP)是银耳的主要活性成分[2],近年来,国内外研究发现,银耳多糖具有免疫调节[3]、抗肿瘤[4]、抗氧化[5]、降血糖[6]等功能,分子修饰对多糖活性有很大的影响[7]。至今已发现多糖的活性与其结构有着密切的关系,经过乙酰化修饰的多糖水溶性增加,生物活性得到明显的增强[8]。然而目前,银耳多糖的修饰主要集中在磷酸化[9]、硫酸化[10]等方面,对银耳多糖乙酰化修饰工艺的研究尚未见报道。为了进一步研究银耳多糖乙酰化修饰及其抗氧化活性,本文研究了乙酸酐用量、反应时间和反应温度对TFP 乙酰化反应的影响,并利用响应面法对TEP 乙酰化化修饰工艺条件进行优化,同时探讨采用IC50法(自由基清除率)测定乙酰化银耳多糖(acetylated polysaccharides from Tremella fuciformis,Ac-TFP)的抗氧化活性。旨在为乙酰化银耳多糖的工业化制备奠定基础。
1 材料和方法
1.1 材料与试剂
银耳:市售;1,1-二苯基-2-苦苯肼(DPPH):上海楷阳生物技术有限公司;三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris):上海楷阳生物技术有限公司;无水乙醇、氢氧化钠、乙酸酐、盐酸、过氧化氢、硫酸亚铁、水杨酸、酚酞、邻苯三酚等试剂均为分析纯。
1.2 仪器与设备
DJ-04 粉碎机:上海淀久中药机械制造有限公司;HH-2 智能数显恒温水浴锅:金坛市杰瑞尔电器有限公司;CR22GⅡ高速冷冻离心机:日本HITACHI 公司;RE-52A 型旋转蒸发仪:上海亚荣生化仪器有限公司;Alpha 1-2 LD 冷冻干燥机:德国 CHRIST 公司;ME104E 型分析天平、FE20 型 pH 计:瑞士 METTLER TOLEDO 公司。
1.3 方法
1.3.1 银耳多糖的制备
银耳经过干燥,然后机械粉碎,并过60 目筛,获得银耳粉。将银耳粉末与蒸馏水按照料液比1∶50(g/mL),90 ℃条件下水浴浸提6 h,浸提液离心(4 500 r/min)10 min,合并上清液。将上清液减压浓缩至一定体积,加入浓缩后体积的1/4 的Sevage 试剂(正丁醇∶三氯甲烷=1∶4,体积比),搅拌 0.5 h,将其混匀,然后离心(4 500 r/min)10 min,得到上清液,加入4 倍体积的95%的乙醇,在4 ℃条件下醇沉24 h,离心,沉淀冷冻干燥后得到TFP 备用。
1.3.2 乙酰化银耳多糖(Ac-TFP)的制备
参考宋逍等[11]的方法并适当调整。精确称取100 mg TFP 样品,溶解在10 mL 的蒸馏水中,用氢氧化钠溶液(0.5 mol/L)调节pH 值至9。在30 ℃条件下,向多糖溶液滴加一定量的乙酸酐,滴加完毕后,恒温反应2 h,待反应结束,用1 mol/mL 的HCl 将反应液的pH 值调至7.0,将反应液装入截留分子量为15 000 kD 的透析袋中,用蒸馏水透析48 h,透析液经减压浓缩后,用4 倍体积分数为95%的乙醇醇沉24 h,沉淀冷冻干燥即为乙酰化银耳多糖(Ac-TFP)。
1.3.3 乙酰化取代度(degree of substitution,DS)的测定
称取TFP10 mg,溶解在10 mL 的0.01 mol/L 的NaOH 溶液中,以酚酞作为指示剂(1 ~2),并用0.01 mol/L 的HCl 溶液滴定至红色退去。记录滴定时的HCl 用量,并按下列公式计算出取代度[12]:

式中:A 为乙酰基含量,%;V0为加入 NaOH 溶液的体积,mL;C0为加入 NaOH 溶液的浓度,mol/L;V1为消耗 HCl 溶液的体积,mL;C1为 HCl 溶液的浓度,mol/L;m为样品质量,g。
1.3.4 单因素试验
1.3.4.1 乙酸酐用量对TFP 乙酰化反应的影响
精确称取100 mg 的TFP,在反应时间3 h,反应温度 60 ℃的条件下,探讨乙酸酐用量(2.0、2.5、3.0、3.5、4.0 mL)对TFP 乙酰化反应的影响,确定最佳乙酸酐用量。
1.3.4.2 反应时间对TFP 乙酰化反应的影响
精确称取100 mg 的TFP,在乙酸酐用量3.0 mL,反应温度 60 ℃的条件下,探讨反应时间(1、2、3、4、5 h)对TFP 乙酰化反应的影响,确定最佳反应时间。
1.3.4.3 反应温度对TFP 乙酰化反应的影响
精确称取100 mg 的TFP,在乙酸酐用量3.0 mL,反应时间 3 h 的条件下,探讨反应温度(20、30、40、50、60、70 ℃)对TFP 乙酰化反应的影响,确定最佳反应温度。
1.3.5 响应面试验设计
根据单因素试验的结果,通过响应面试验设计,以取代度值为指标,以反应时间、反应温度和乙酸酐用量为3 个因素,设计三因素三水平的响应面试验,优化TFP 乙酰化修饰工艺条件。
1.3.6 Ac-TFP 的结构表征
分别以干燥的 TFP 和 Ac-TFP 粉末与KBr 为1∶1 000 的质量比例进行研磨,充分混匀后压片,在波长为4 000 cm-1~400 cm-1的范围下进行红外光谱扫描,比较TFP 和Ac-TFP 的红外光谱图。
1.3.7 抗氧化活性测定
1.3.7.1 ·OH 清除能力测定
分别向试管中加入1 mL 9.0 mmol/L 的FeSO4、1 mL 9.0 mmol/L 的水杨酸乙醇溶液,摇匀,然后分别加入1 mL 的不同浓度的修饰后的 Ac-TFP 溶液(0.2、0.4、0.6、0.8、1.0 g/L) 和 1 mL 不同浓度的修饰前的 TFP 溶液(0.2、0.4、0.6、0.8、1.0 g/L),充分混匀后,加入 1 mL 8.8 mmol/L 的 H2O2,混匀,置于 37 ℃水浴锅中水浴30 min 进行反应,以蒸馏水作为参比,在波长为510 nm处测定各反应溶液的吸光度值Ai。空白对照组以相同体积蒸馏水替代多糖样品测吸光度值。并按照下列公式进行计算·OH 的清除率[13]。
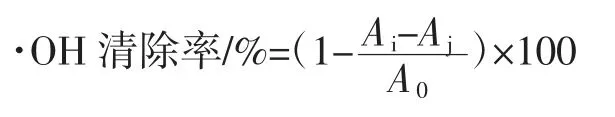
式中:Ai为不同浓度TFP 和Ac-TFP 的吸光度值;Aj为水杨酸以蒸馏水为替代物的吸光度值;A0为不同浓度TFP 和Ac-TFP 以蒸馏水为替代物的吸光度值。
1.3.7.2 DPPH 自由基清除能力测定
分别将2 mL 的不同浓度的TFP 和Ac-TFP 溶液(0.2、0.4、0.6、0.8、1.0 g/L) 和 2 mL 浓度为 0.1 mmol/L的DPPH 溶液振荡摇匀,摇匀后于25 ℃左右下避光反应30 min,在波长为517 nm 处测定吸光度值,并按照下列公式进行计算DPPH 自由基的清除率[14]。
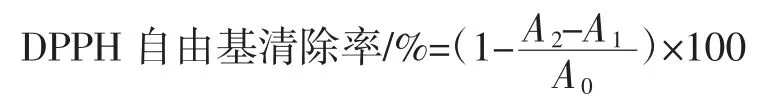
式中:A2为不同浓度TFP 和Ac-TFP 的吸光度值;A1为不同浓度TFP 和Ac-TFP 以蒸馏水为替代物的吸光度值;A0为DPPH 以蒸馏水为替代物的吸光度值。
1.3.7.3 O2-·清除能力测定
在试管中加入 4.5 mL 的 Tris-HCl 缓冲液(50 mmol/L,pH8.2)、1 mL 不同浓度的 TFP 和 Ac-TFP溶液(0.2、0.4、0.6、0.8、1.0 g/L)及 3.2 mL 蒸馏水,摇匀后在25 ℃的水浴锅中水浴20 min,再加入0.3 mL 的7 mmol/L 的邻苯三酚溶液,置于25 ℃的水浴锅中反应3 min,随即用10 mol/L 的HCl 溶液终止反应,并在波长为325 nm 处测定吸光度值为A。空白对照组以蒸馏水代替多糖样品,测得的吸光度值为A0。并按照下列公式计算O2-·的清除率[15]。

式中:A 为不同浓度TFP 和Ac-TFP 的吸光度值;A0为不同浓度TFP 和Ac-TFP 以蒸馏水为替代物的吸光度值。
2 结果与讨论
2.1 单因素试验
2.1.1 乙酸酐用量对TFP 乙酰化反应的影响
乙酸酐的用量对TFP 乙酰化反应的影响见图1。
从图1 中可知,TFP 乙酰基的取代度先是呈上升趋势,在乙酸酐用量为3 mL 时,达到最大值,继续增加乙酸酐的用量,TFP 乙酰基的取代度开始下降。这可能是因为随着乙酸酐用量的增多,增加了TFP 乙酰化反应的几率,乙酰基取代度随之增大,但是当乙酸酐的用量过多时,增大了乙酸酐水解的副反应程度,反应体系的pH 值逐渐下降,从而导致TFP 乙酰基的取代度逐渐下降。
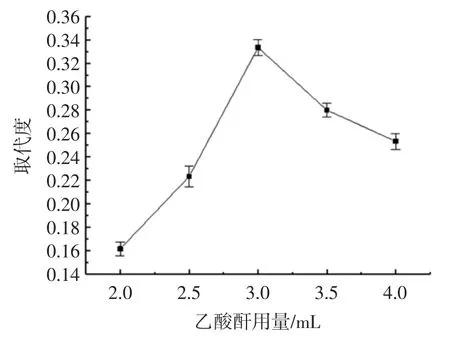
图1 乙酸酐用量对TFP 乙酰基取代度的影响Fig.1 Effect of acetic anhydride amount on substitution degree of Ac-TFP
2.1.2 反应时间对TFP 乙酰化反应的影响
反应时间对TFP 乙酰化反应的影响见图2。
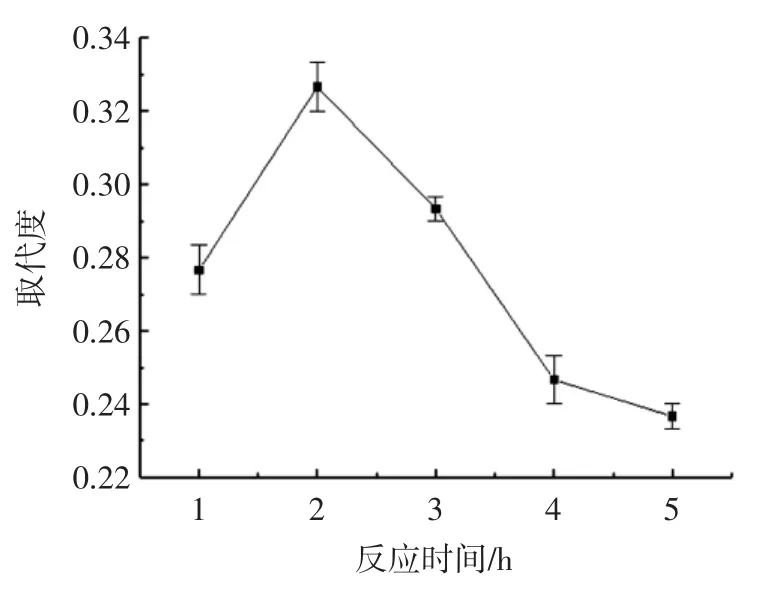
图2 反应时间对TFP 乙酰基取代度的影响Fig.2 Effect of reaction time on substitution degree of Ac-TFP
从图2 中可知,TFP 乙酰基的取代度随着反应时间的增加而增大,但是在反应时间超过2 h 之后,继续延长反应时间,TFP 乙酰基取代度迅速降低,这可能是因为Ac-TFP 产物在体系中并不稳定,随着反应时间的延长,增加了反应物之间的碰撞几率,部分产物发生了分解,引起乙酰化程度降低。
2.1.3 反应温度对TFP 乙酰化反应的影响
反应温度对TFP 乙酰化反应的影响见图3。
由图3 可知,在 30 ℃~60 ℃的温度范围内,TFP 乙酰基取代度逐渐增大,在反应温度超过60 ℃,TFP 乙酰基的取代度开始变小。可能是因为在一定的温度范围内,反应温度越高,反应物的活性就会越强,TFP 乙酰基的取代度就随之增大,但当温度超过60 ℃时,由于乙酸酐的水解速度过快,进而导致TFP 乙酰基的取代度相应减小。
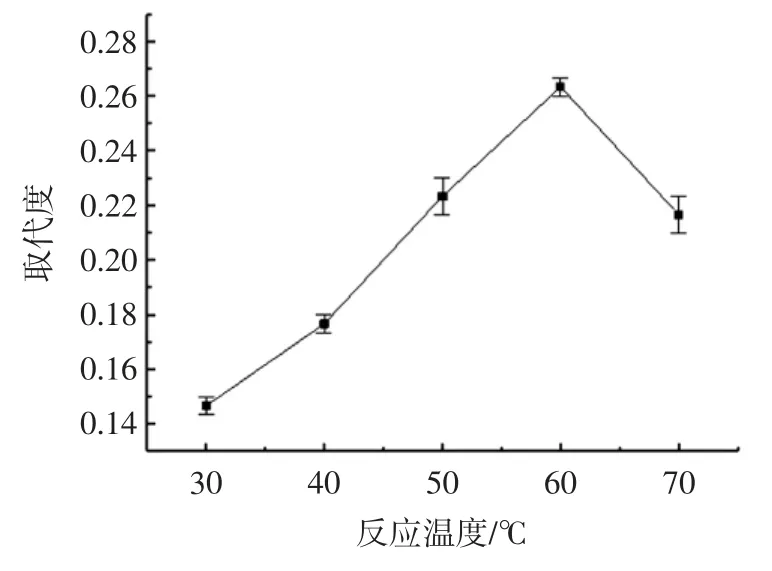
图3 反应温度对TFP 乙酰基取代度的影响Fig.3 Effect of reaction temperature on substitution degree of Ac-TFP
2.2 TFP乙酰化工艺条件优化
2.2.1 响应模型的建立
在单因素试验结果的基础上,以乙酰基取代度为指标,设计以反应时间(A)、反应温度(B)和乙酸酐用量(C)三因素的回归方程来拟合因素与响应值之间的函数关系,试验因素和水平设计见表1,响应面试验设计方案及结果见表2,响应面分析得出的回归模型参数方差分析见表3。
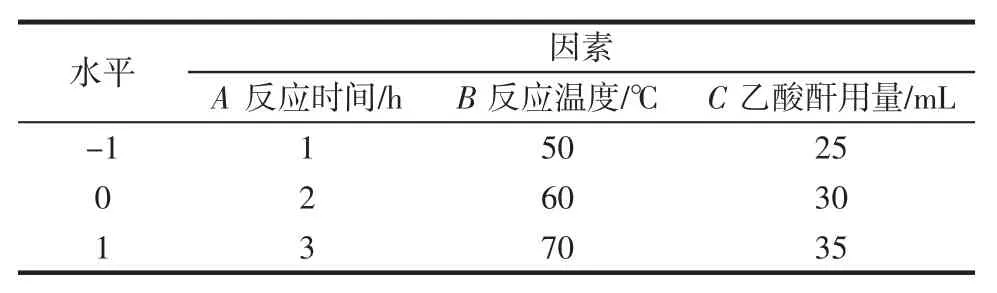
表1 响应面试验因素与水平设计表Table 1 Factors and levels designed for response surface analysis

表2 响应面试验结果Table 2 Experimental results for response surface analysis
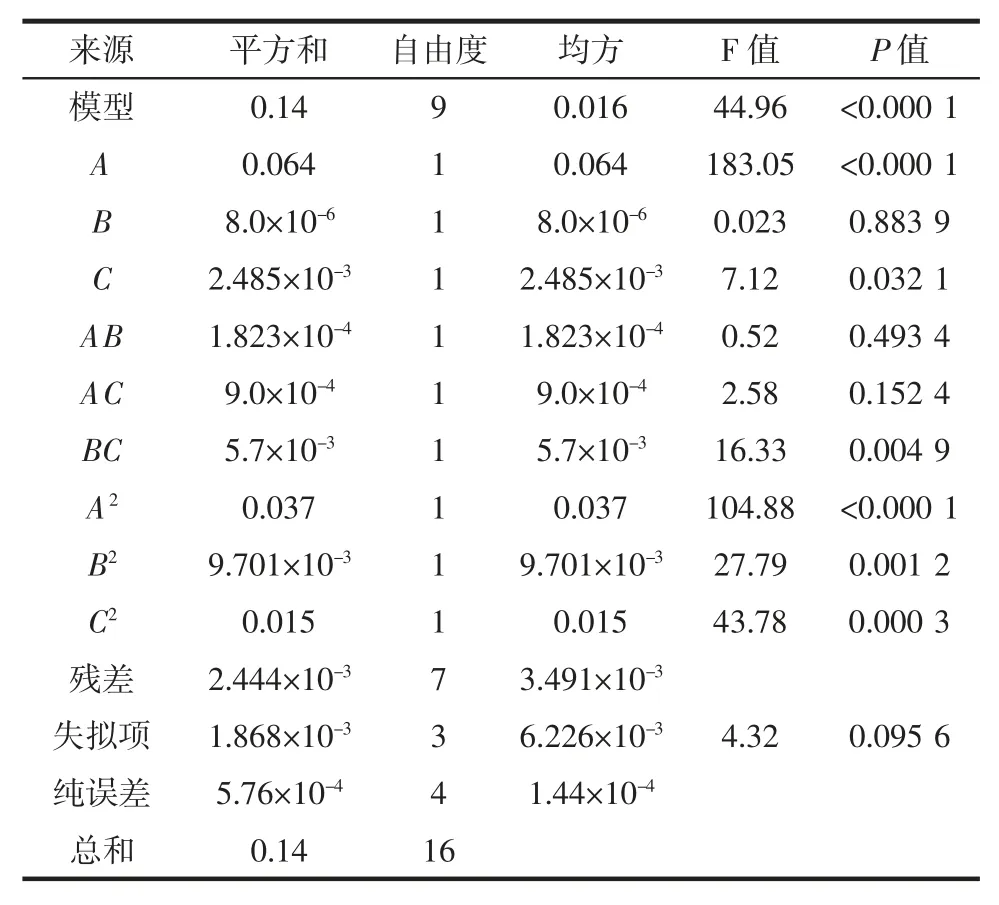
表3 回归模型方差分析Table 3 Analysis of variance for the fitted quadratic polynomial mode
利用Design-Expert 软件对表2 中的试验结果进行二次方程拟合,得到TFP 对反应时间(A)、反应温度(B)和乙酸酐用量(C)与乙酰基取代度(Y)之间的二次多项回归方程的模型为:
Y=0.43-0.089A-0.001B-0.018C-0.006 75AB-0.015AC-0.038BC-0.093A2-0.048B2-0.06C2
表3 中的数据显示,F 值为 44.96,P<0.000 1,结果为二次多项回归方差的模型极显著,失拟误差的P 值为0.095 6,大于0.05,结果为不显著,则表明建模成功。拟合得到的二次多项回归方程系数R2=0.983 0,证明建模可信度较高。
表3 的方差分析结果中还可看出,试验组合中的各因素中,A 和C 的P 值都小于0.05,即反应时间和乙酸酐用量对Ac-TFP 乙酰基取代度的影响显著,并且时间因素的影响最为显著,3 个因素对Ac-TFP 乙酰基取代度的影响大小为:反应时间(A)>乙酸酐用量(C)>反应温度(B)。
2.2.2 TFP 乙酰化修饰响应面分析
反应时间和反应温度对TFP 乙酰基取代度的影响效果见图4。
由图4 可知,相较于反应温度,反应时间的影响更显著,曲线更陡,等高线更密集。反应时间和乙酸酐用量对TFP 乙酰基取代度的影响效果见图5。
由图5 可知,相较于乙酸酐用量,反应时间对TFP乙酰基取代度的影响效果更为显著,曲线更陡,等高线更密集。反应温度和乙酸酐用量对TFP 乙酰基取代度的影响效果见图6。

图4 反应时间和反应温度对取代度的影响Fig.4 Effects of reaction time and reaction temperature on substitution degree of Ac-TFP

图5 反应时间和乙酸酐用量对取代度的影响Fig.5 Effects of reaction time and acetic anhydride amount on substitution degree of Ac-TFP

图6 反应温度和乙酸酐用量对取代度的影响Fig.6 Effects of reaction temperature and acetic anhydride amount on substitution degree of Ac-TFP
结果显示为反应温度和乙酸酐用量相比较而言,对TFP 乙酰基取代度的影响相差不大,交互影响较为显著,从曲线陡的程度看来,乙酸酐用量对TFP 乙酰化修饰的影响程度要大于反应温度对TFP 乙酰化修饰的影响程度。
2.2.3 TFP 乙酰化修饰最佳工艺条件确定及验证
利用Design-Expert 8.06 软件对响应面试验结果进行分析,可预测得到TFP 乙酰化修饰最佳工艺条件为:反应温度61.04 ℃,反应2.37 h,添加的乙酸酐用量2.89 mL,在该条件下,乙酰化银耳多糖取代度为0.39。按照此预测条件进行验证试验,为使试验更具有可行性,调整预测工艺条件为:反应时间2.4 h,反应温度61 ℃以及乙酸酐用量为2.9 mL。重复试验3 次,得到的DS 值为0.385,与预测值差异很小,证明建立的模型可靠。
2.3 Ac-TFP的结构表征分析
TFP 和Ac-TFP 的红外光谱图见图7。

图7 TFP 和Ac-TFP 的红外光谱图Fig.7 Infrared spectra of TFP and Ac-TFP
TFP 和Ac-TFP 的特征峰与对应的波长和基团振动情况见表4。
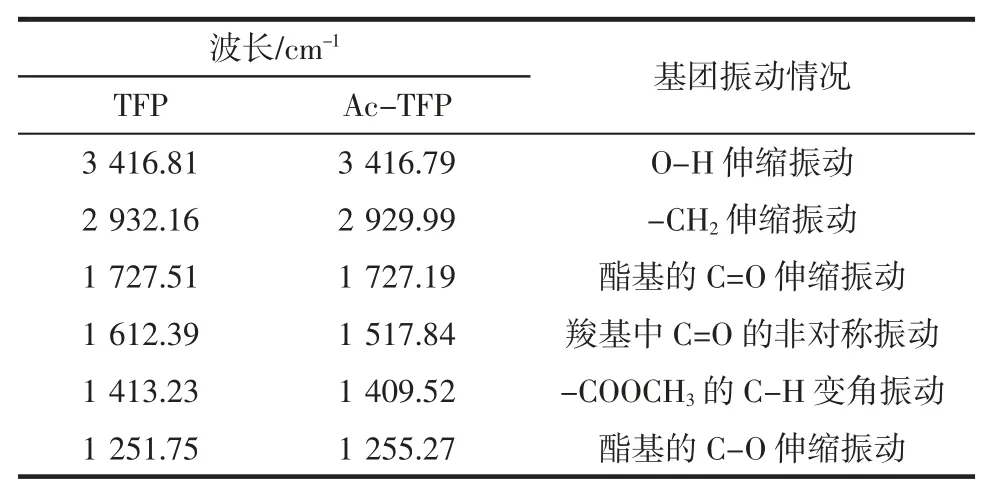
表4 TFP 和Ac-TFP 特征峰对应的波长和基团振动情况Table 4 Wave numbers and peaks belong to the Fourier transform infrared(FTIR)spectra of TFP and Ac-TFP
3 416 cm-1左右为糖分子内或分子间氢键O-H 伸缩振动峰,2 932cm-1左右为次甲基(-CH2-)中的 C-H 的伸缩振动的吸收峰[16]。修饰后Ac-TFP 在1 727.19 cm-1处出现的吸收峰为酯基C=O 双键的收缩振动,同时在1 255.27 cm-1处有一个较弱的酯基C-O 的收缩振动[17],说明乙酰化衍生物中已经成功加入了乙酰基。
2.4 Ac-TFP的抗氧化活性
2.4.1 Ac-TFP 对·OH 清除作用
TFP 和 Ac-TFP 对·OH 的清除作用见图8。
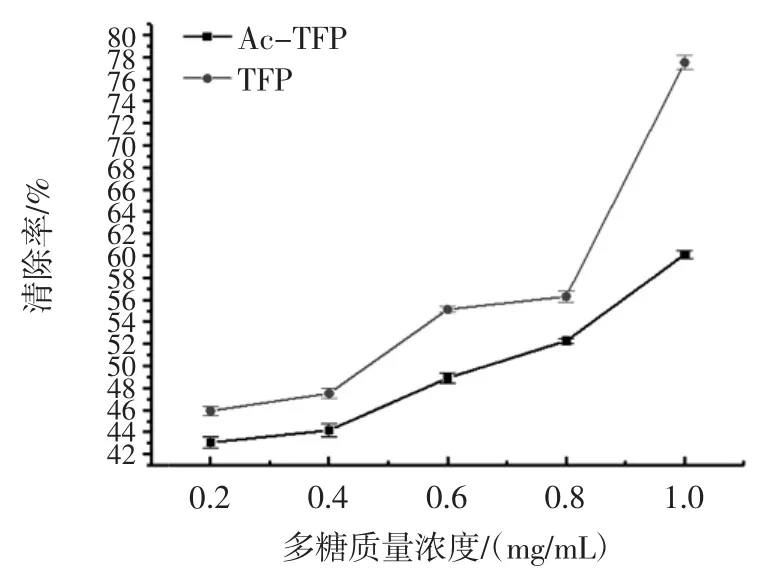
图8 TFP 和 Ac-TFP 对·OH 的清除作用Fig.8 Scavenging capacity of TFP and Ac-TFP on hydroxyl free radicals
从图中8 可以看出,TFP 对·OH 具有较为良好的清除效果。在多糖质量浓度为0.2 mg/mL~1.0 mg/mL时,TFP 和 Ac-TFP 对·OH 的清除能力逐渐变强,尤其是在0.8 mg/mL 后,两者对·OH 的清除效果增强的最为明显。且TFP 对·OH 的清除作用明显高于Ac-TFP对·OH 的清除作用,在多糖质量浓度为1.0 mg/mL 时,TFP 对·OH 的清除率达到 77.52%,而 Ac-TFP 对·OH的清除率为60.11%。一般来说,化学基团的引入可能会增强多糖的活性,或使多糖产生新的活性,但同时也可能使某些活性降低或者消失。与TFP 相比,Ac-TFP 对·OH 的清除作用有所减弱,可能与乙酰基引入的位置等有关,抑制了多糖的生物活性的发挥,从而降低了对·OH 的清除作用。
2.4.2 Ac-TFP 对DPPH 自由基的清除作用
TFP 和Ac-TFP 对DPPH 自由基的清除作用见图9。
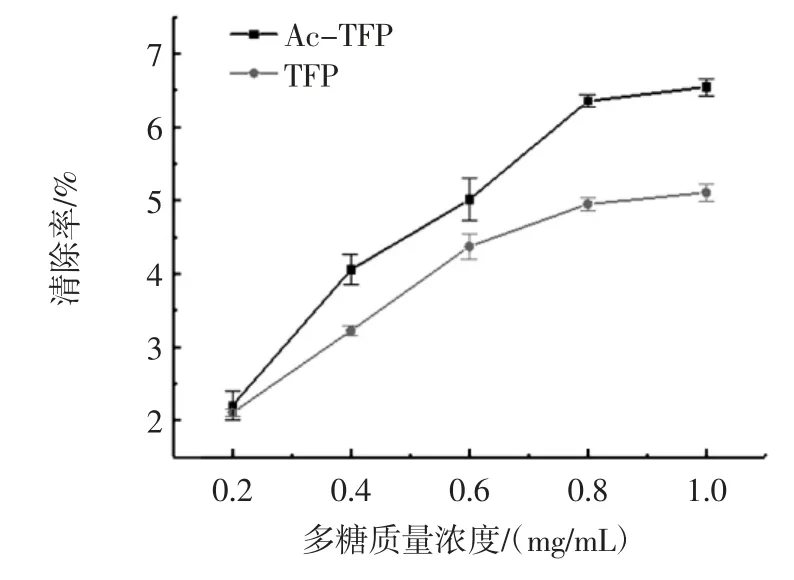
图9 TFP 和Ac-TFP 对DPPH 的清除作用Fig.9 Scavenging capacity of TFP and Ac-TFP on DPPH free radicals
从图9 可以看出,在一定的多糖质量浓度范围内,TFP 和Ac-TFP 对DPPH 自由基的清除效果都随着多糖质量浓度的升高而增强,与TFP 相比,Ac-TFP 对DPPH 自由基的清除作用增强,这可能是因为乙酰化修饰使得银耳多糖分子间的构象发生了改变,乙酰基的引入增加了多糖分子的溶解性,更易于发挥生物活性作用,使其对DPPH 自由基的清除效果得到了相应的增强。王之珺等[18]研究了乙酰化青钱柳多糖对DPPH自由基的清除能力,发现乙酰化修饰后的青钱柳多糖对DPPH 自由基的清除能力明显增强。
2.4.3 Ac-TFP 对 O2-·的清除作用
TFP 和 Ac-TFP 对 O2-·的清除作用见图10。

图10 TFP 和 Ac-TFP 对 O2-·的清除作用Fig.10 Scavenging capacity of TFP and Ac-TFP on superoxide anion free radicals
从图10 可以看出,在一定质量浓度范围内,TFP和Ac-TFP 对O2-·自由基均有一定的清除作用,且随着多糖质量浓度的升高而增强,且增强的幅度在逐渐增大,但Ac-TFP 的清除作用弱于TFP,表明对TFP 进行乙酰化修饰后会减弱其对O2-·自由基的清除能力。
3 结论
该文以TFP 为原料,使用乙酸酐法对TFP 进行乙酰化修饰,以取代度为指标,利用响应面优化分析确定了TFP 乙酰化修饰的最佳工艺条件为:反应时间2.37 h,反应温度为61.04 ℃,乙酸酐用量为2.89 mL,在此工艺条件下,乙酰基取代度为0.39。抗氧化活性结果表明,TFP 和 Ac-TFP 对·OH、DPPH 自由基和 O2-·均有一定的清除能力,且清除能力随多糖质量浓度的升高而增大。与TFP 相比,Ac-TFP 对DPPH 自由基的清除能力有所增强,而对·OH 和O2-·清除能力减弱。
