大头菜发酵过程中生香酵母的分离、筛选及鉴定
2019-09-18黄鑫唐红梅唐青莲刘阳邓静
黄鑫,唐红梅,唐青莲,刘阳,*,邓静
(1.四川旅游学院,四川成都610100;2.四川理工学院,四川自贡643000)
大头菜又名根用芥菜、辣疙瘩、诸葛菜[1],广泛种植于中国西部地区。它富含维生素、膳食纤维和大量的微量元素、糖类、蛋白质等[2],可促进结肠蠕动,防止便秘[3]。大头菜皮厚,肉质致密坚实,水分少且具有强烈的辛辣味和少许苦味,不宜生吃,因此,多通过腌制进行加工食用[4]。腌制大头菜一般经选料、初晒、拌料、复晒、加料、密封和腌制等工序加工而成,经60 d~90 d发酵后成熟[5]。大头菜经腌制加工后,组织脆爽、风味独特、营养丰富,深受消费者欢迎[6]。目前,对大头菜的研究主要集中于挥发性风味物质[7]、工艺[8]、乳酸菌[9]等方面,但对发酵过程中生香酵母的研究较少。
生香酵母是一类能够代谢产生香气成分的酵母菌的总称,发酵过程中除参与醛缩醇类、含硫化合物等香气成分的生成外,还一定程度地参与氨基酸和有机酸类的生成,因此能显著增加食品的香气成分[10]。目前,对生香酵母的研究应用较多,但主要集中在酒类[11]、调味品[12]、面制品[13]及其特性研究上。Jie Feng 等[14]从酱油中分离出一株嗜盐生香酵母(Candida etchellsii),利用高效液相技术与气质联用技术对酵母产生的有机酸、氨基酸、挥发性风味物质进行了分析。A Cadière 等[15]采用一种以葡萄糖酸酯为唯一碳源的自适应进化策略,获得了具有改良特性的葡萄酒酵母。
本试验从腌制大头菜的发酵液中筛选生香酵母,通过形态学、生理生化试验及18S rDNA 对菌株进行分类鉴定,为生香酵母在大头菜中的研究与应用提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 材料来源
腌制大头菜发酵液:四川内江威宝食品有限公司。
1.1.2 仪器设备
SHP0201147047 型电子分析天平:上海恒平科学仪器有限公司;BH200 型光学显微镜:宁波舜宇仪器有限公司;SW-CJ-IF 型超净工作台:苏州安泰空气技术有限公司;SM530C 型立式压力蒸汽灭菌锅:成都盛德先华科贸有限公司;LRH-250 型生化培养箱:上海齐欣科学仪器有限公司;QYC-2102C 型摇床:上海福玛实验设备有限公司;201-3AB 型电热恒温干燥箱:余姚市东方电工仪器厂;S1000 型PCR 扩增仪:美国BIO-RAD公司;DY-6C 型电泳仪:北京市六一仪器厂;Gel Doc 2000型凝胶成像系统:美国BIO-RAD 公司。
1.1.3 主要试剂
蛋白胨、葡萄糖、磷酸二氢钾、硫酸镁、琼脂、孟加拉红、氯霉素、乙醇、酵母膏、琼脂粉、亚甲基蓝、蔗糖、麦芽糖、乳糖、可溶性淀粉、硫酸铵、硫酸镁、氯化钠、氯化钙、硝酸钾、尿素、溴甲基酚紫、酚红、氢氧化钾、品红、异戊醇、乙醇、溴化乙锭(EB)、十六烷基三甲基溴化铵(CTAB)(均为分析纯):成都市科龙化工试剂厂。
1.1.4 培养基
孟加拉红固体培养基:蛋白胨0.5%,琼脂2%,葡萄糖1%,硫酸镁0.05%,磷酸二氢钾0.1%,1/3000 孟加拉红溶液10 %,补足蒸馏水,分装后121 ℃灭菌20 min,氯霉素0.01%,用少量乙醇将氯霉素溶解,加入已灭菌的45 ℃~50 ℃培养基中。
YPD 培养基:蛋白胨2%,葡萄糖2%,琼脂2%,酵母膏0.1%,自然pH 值。
PDA 培养基:马铃薯20%,葡萄糖2%,琼脂2%,自然pH 值。
碳源同化基础培养基:酵母膏0.02%,磷酸二氢钾0.1%,氯化钙0.01%,硫酸铵0.5%,硫酸镁0.05%,氯化钠0.01%,糖或其它碳源0.5%,自然pH 值。
氮源同化基础培养基:磷酸二氢钾0.1%,硫酸镁0.05%,酵母膏0.02%,氮源0.5%,葡萄糖2%,自然pH 值。
1.2 试验方法
1.2.1 菌株分离
取腌制大头菜发酵液1.0 mL 注入9 mL 无菌水中,制成 1∶10 的样品匀液。再吸取 1 mL 1∶10 的样品匀液注入9 mL 无菌水中,制成1∶100 的样品匀液。按上述操作制备10 倍系列稀释样品匀液。分别吸取各稀释度的样品匀液0.1 mL,无菌环境下在孟加拉红培养基上涂布分离,于28 ℃恒温培养箱中培养48 h,挑取与酵母菌菌落形态相符的单个菌落再于PDA 与YPD 培养基上划线,纯化2 次,观察菌落形态,确定为单菌落后将所分离的酵母菌转接于PDA 和YPD 试管斜面培养基上,于4 ℃生化培养箱保存[16]。
1.2.2 生香酵母的筛选
挑选纯化培养后的单菌落点种于YPD 培养基和PDA 培养基上,28 ℃培养24 h,仔细观察菌株形态并进行记录,并分别挑取YPD 培养基和PDA 培养基上的单菌落接种于50 mL YPD 液体培养基和50 mL PDA液体培养基上,于28 ℃下恒温培养24 h~72 h,采用嗅闻法判断产香情况[17]。
1.2.3 菌株形态学鉴定
参照《真菌鉴定手册》[18]以及《酵母菌的特征与鉴定手册》[19]对生香酵母进行形态学和生理生化鉴定,初步确定其分类地位。
1.2.3.1 菌落形态观察
按无菌操作将各个菌株点种于YPD 培养基、PDA培养基以及孟加拉红培养基上,28 ℃培养48 h,观察菌落大小、形态、颜色、光泽度、透明度等,作好记录[20]。
1.2.3.2 细胞形态观察
取洁净载玻片,加入0.1 mL 美蓝染液,接种环挑取少量菌体在载玻片上涂匀,染色15 min~20 min,用流水冲洗载玻片至流出水无色,吸水纸吸干残留水分,晾干。于100 倍油镜下观察,形态、大小、有无孢子等,记录并拍照。
1.2.4 生理生化试验鉴定
通过糖发酵试验、碳源同化试验、氮源同化试验、分解尿素试验对已分离出的生香微生物进行鉴定,从而确定其生理生化特性,初步判断菌株的种属。
1.2.5 菌株分子鉴定
18S rDNA 是真核生物中编码的核糖体小亚基的DNA 序列,其为微生物种群的区分、鉴定以及生物进化关系的研究提供了极大的可能[21]。将待测菌株接种于 YPD 液体培养基中,28 ℃、180 r/min 培养 48 h,过滤,收集菌体,采用十二烷基硫酸钠-十六烷基三甲基溴化铵方法(SDS-CTAB)提取菌株的总DNA,采用真菌 18S rDNA 通 用 引 物 对 NS1 和 NS8 (NS1:5′ -GTAGTCATATGCTTGTCTC -3′;NS8:5′-TCCGCAGGTTCACCTACGGA-3′)对菌株进行聚合酶链式反应(PCR)扩增[22]。50 μL PCR 反应体系为:50 μg 模板、5 μmoL 正反引物、50 μmol/L dNTP、5 μL 10×PCR 缓冲物(MgCl2)、2.5 U E×Taq DNA 聚合酶,无菌纯水补齐到50 μL。PCR 扩增条件[17]:94 ℃预变性 10 min,94 ℃变性 1 min,55 ℃退火 1 min,72 ℃延伸 1 min,共 30 个循环,最后72 ℃补平7 min,终止温度4 ℃。
将PCR 扩增产物送至检测机构进行测序。利用NCBI 对测得序列进行BLAST 同源性比对,并利用MEGA 7.0 绘制系统发育树。
2 结果与分析
2.1 生香酵母的筛选
经1.2.1 筛选得9 株菌,经过YPD、PDA 培养纯化后,编号为 J1、J2、J3、J4、J5、J6、J7、J8、J9。为进一步筛选,对9 株菌的生香能力进行测试,结果见表1。
在 PDA 培养基中,J1、J5、J7、J9 产生的香气较强,J3、J8 产生的香气一般,J2、J6 产生的香气较弱,J4 则不产香;在 YPD 培养基中,J5 产生的香气较强,J1、J3、J7、J8、J9 产生的香气一般,J6 产生的香气较弱,J2 不产香。通过嗅闻法,初步选定 J1、J3、J5、J7、J8、J9 这 6株生香能力较强的菌株进行下一步鉴定。
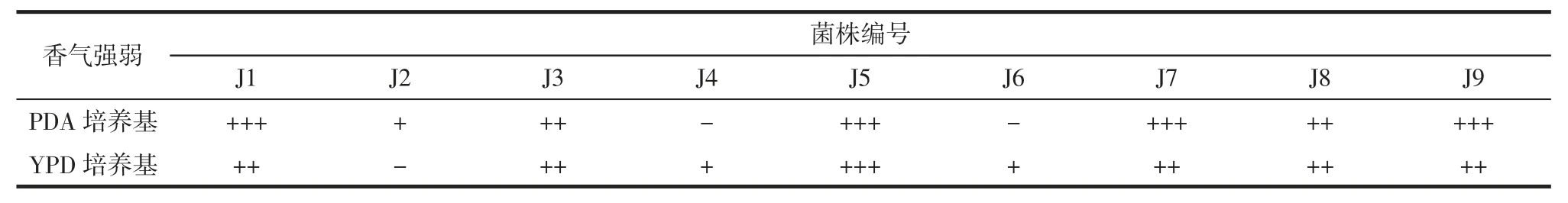
表1 9 株菌生香能力研究Table 1 The ability to study 9 strains of aroma-producing yeast
2.2 菌株形态学鉴定
将生香能力较强的6 株菌点种于PDA 培养基上,28 ℃培养48 h,观察菌落形态;利用美蓝染色,于100倍油镜下观察细胞形态,结果见图1。根据《真菌鉴定手册》与《酵母菌的特征与鉴定手册》对各菌株的形态进行描述,结果见表2。
2.3 生理生化鉴定
对已纯化培养后的6 种单菌株进行生理生化试验,得到试验结果如表3,根据试验结果,确定其生理特征,从而得出菌株的种类。
由表3 可知,J1 可以发酵葡萄糖、蔗糖、麦芽糖,可以同化乙醇、可溶性淀粉、硝酸钾、硫酸铵,能够分解尿素;J3 可以发酵葡糖、蔗糖、麦芽糖,可以同化乙醇、可溶性淀粉、硝酸钾、硫酸铵,能够分解尿素;J5 可以发酵葡萄糖、蔗糖,可以同化乙醇、硫酸铵;J7 可以发酵葡萄糖、蔗糖、麦芽糖,可以同化乙醇、可溶性淀粉、硝酸钾、硫酸铵,可以分解尿素;J8 可以发酵葡萄糖、麦芽糖,可以同化乙醇、可溶性淀粉、硫酸铵;J9 可以发酵葡萄糖、蔗糖,可以同化乙醇、硫酸铵。
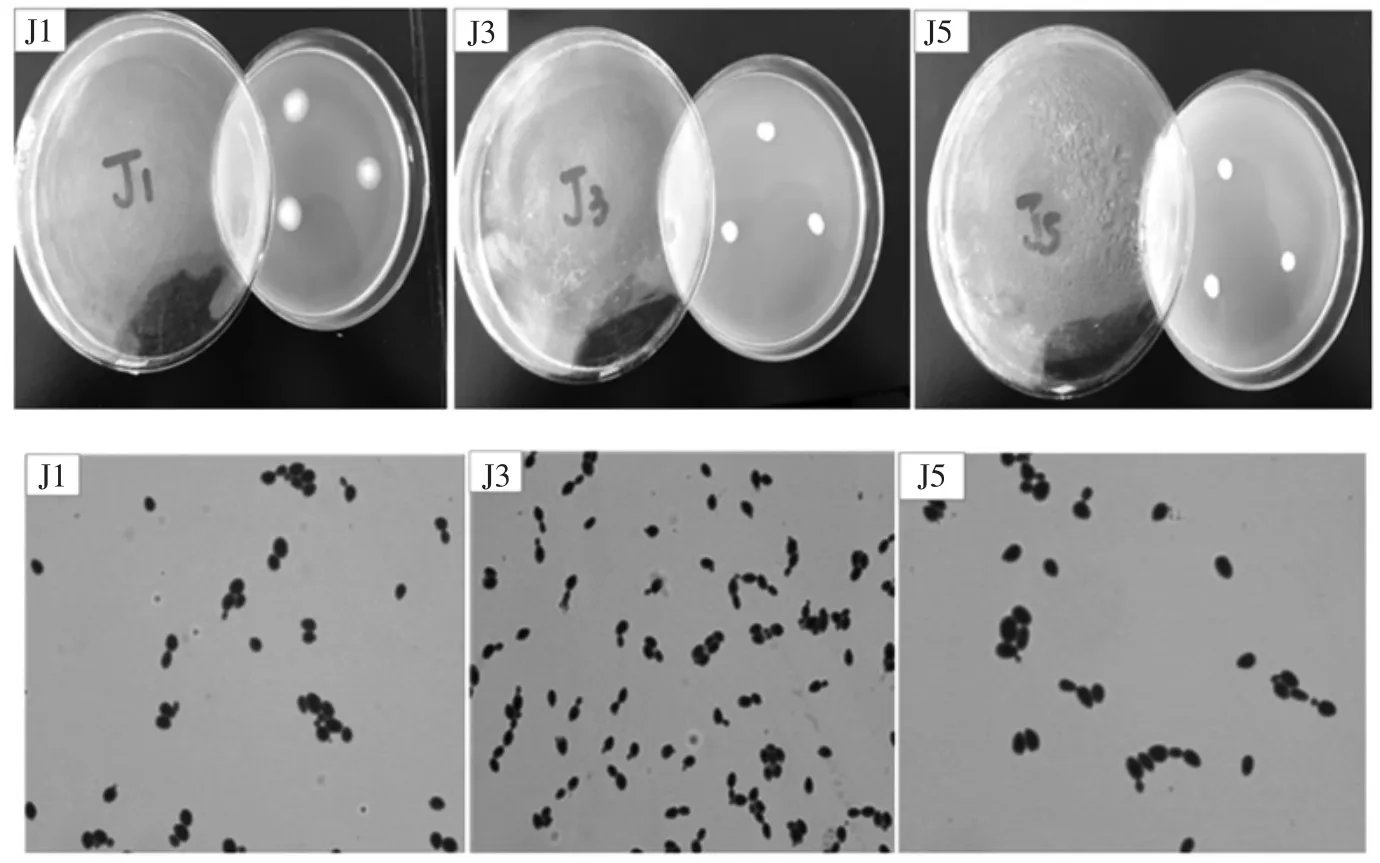
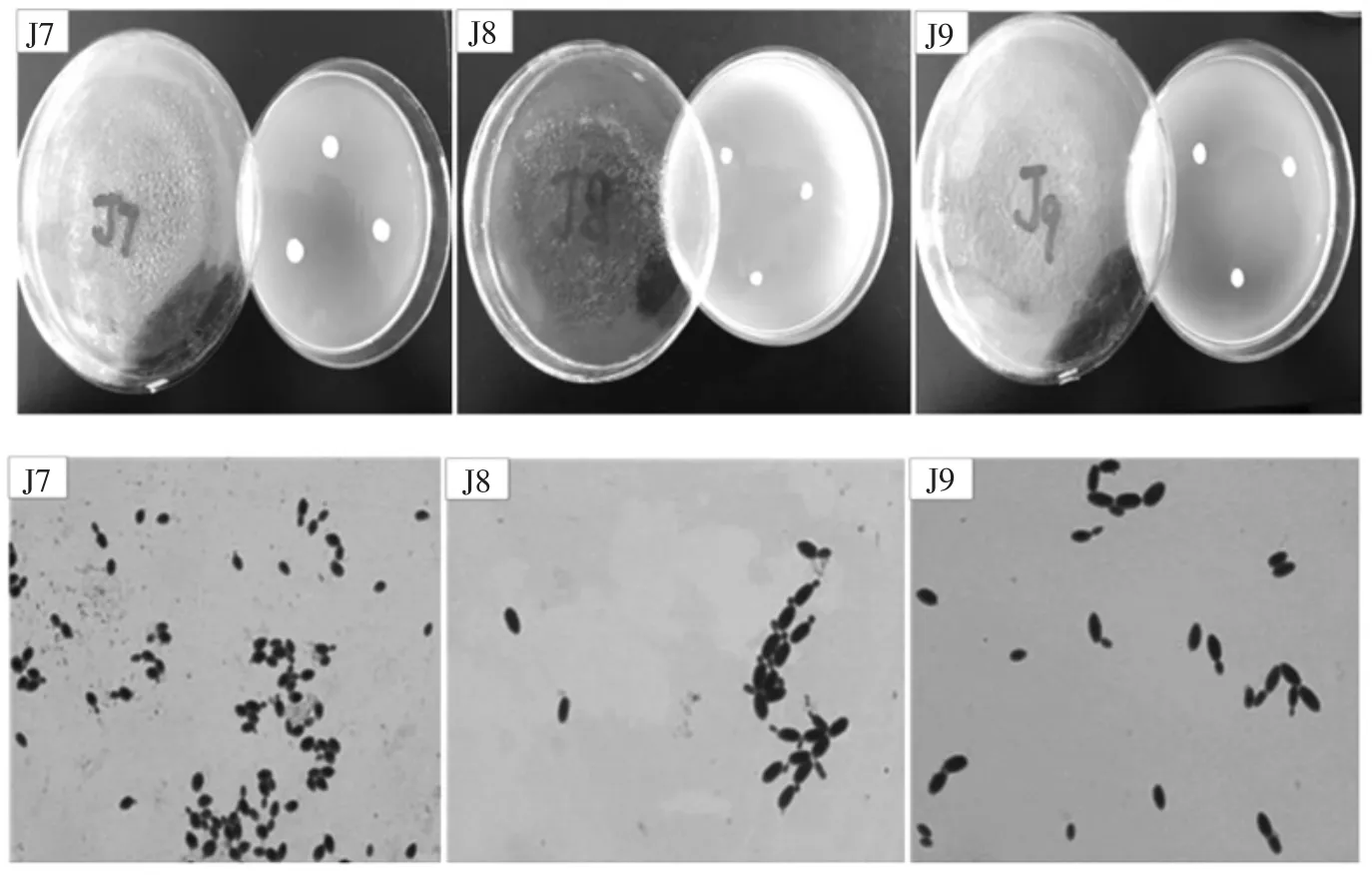
图1 菌株的菌落形态和细胞形态Fig.1 The colony morphology and cell morpholopy of strains

表2 菌株形态描述Table 2 The description of morphology of strains
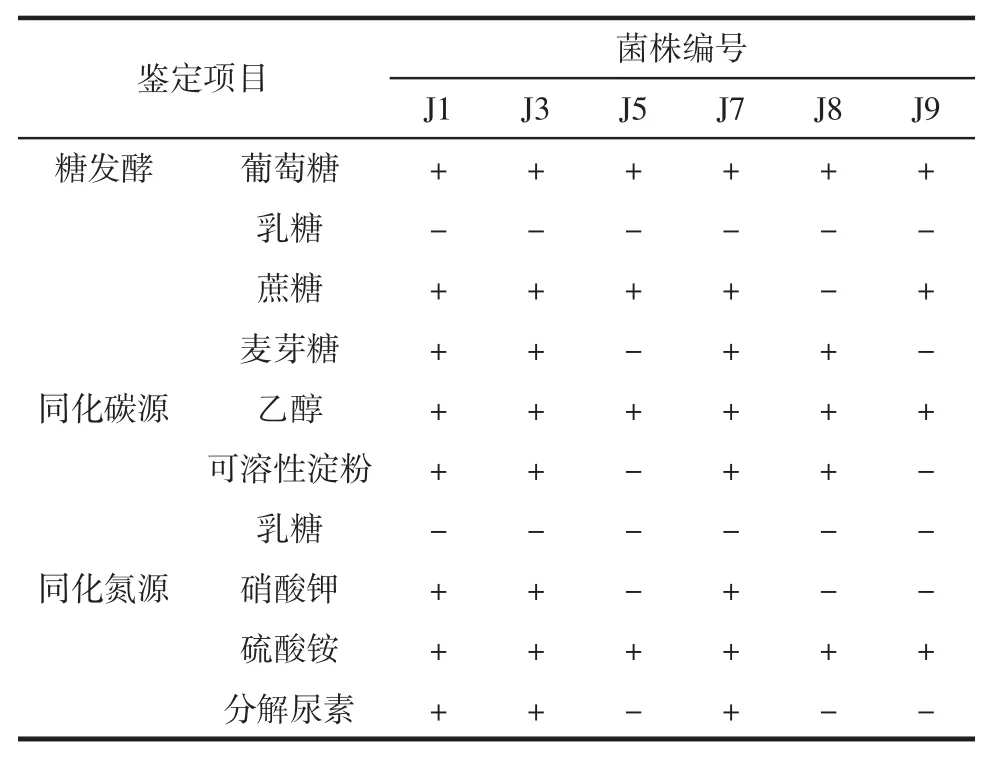
表3 生理生化试验结果Table 3 The results of physiological and biochemical test
根据《酵母菌的特征与鉴定手册》、《真菌鉴定手册》并结合图 1,表2、3,可以初步判断 J1、J3、J7 为奥默柯达毕赤酵母属,J5、J9 为毕赤酵母属,J8 为假丝酵母属。
2.4 菌株分子鉴定
将筛选得出的6 株生香酵母进行18S rDNA 基因序列测定,各菌株基因序列检测结果见表4。使用DNASTAR 以及CHROMAS 峰图将相同属菌株基因序列进行比对,得出 J1、J3、J7 属于同一菌种,J5、J9 属于同一菌种,J8 为一个菌种。
将 J1、J5、J8 的 18S rDNA 基因序列输入美国国立生物技术信息中心(NCBI)中进行核苷酸序列比对检索(BLAST)比对,选取同源性较高的模式菌株运用邻接法(Neighbor-Joining)构建系统发育树,且Bootstrap对进化树进行1 000 次可信度分析,见图2。具体鉴定结果见表5。
由表5、图2 可以看出,J1 与奥默柯达酵母(Ko-damaea ohmeri)(KY684065.1)处于同一分支上,且同源性为100%,因此J1 鉴定为Kodamaea ohmeri。J5 与季也蒙毕赤酵母(Meyerozyma guilliermondii)(MG846137.1)处于同一分支,同源性为99%,最终确定J5 为 Meyerozyma guilliermondii。J8 与热带假丝酵母(Candidatropicalis)(MG599246.1)处于同一分支,同源性仅为87%,可能是新发现的Candidatropicalis。

表4 菌株18S rDNA 基因序列Table 4 The genetic sequence of 18S rDNA

表5 18S rDNA 菌种鉴定Table 5 The identification of 18S rDNA strain
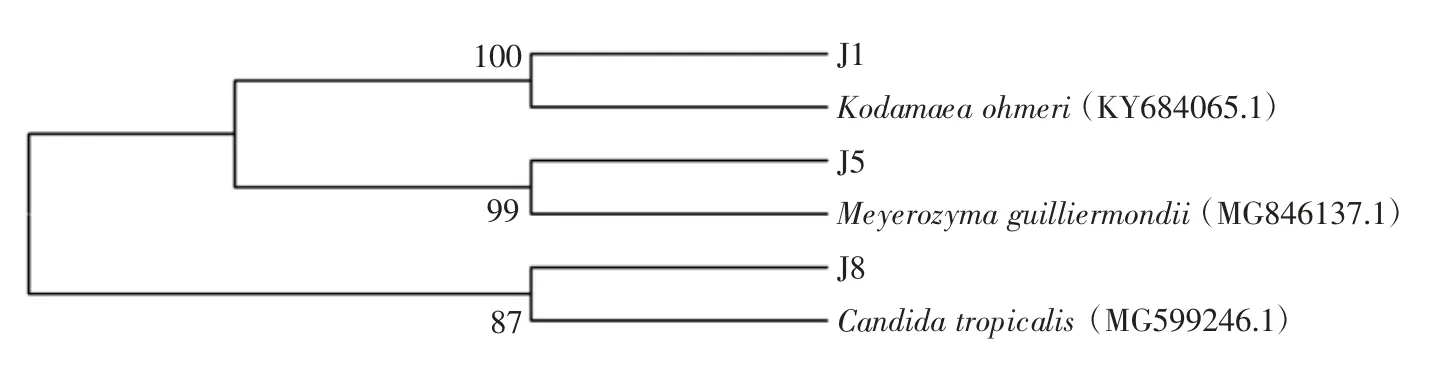
图2 菌株18S rDNA 序列系统发育树Fig.2 The phylogenetic tree of 3 kinds of fungi based on 18S rDNA sequence
3 结论
从腌制大头菜的发酵液中分离出9 株酵母菌,经过产香特性的比较选取产香能力较强6 株菌进行形态学、生理生化试验及18S rDNA 鉴定。结果表明:J1、J3、J7 属于同种菌株,为奥默柯达酵母(Kodamaea ohmeri);J5、J9 属于同种菌株,为季也蒙毕赤酵母(Meyerozyma guilliermondii);J8 为热带假丝酵母(Candidatropicalis)。目前,对于大头菜发酵过程中生香酵母的研究还处于起步阶段,生香酵母的筛选鉴定、生香特性、耐盐机理的研究、菌剂的制备等领域均未见文献报道。因此,本研究结果为大头菜中生香酵母的进一步研究提供参考依据。
