人源骨肉瘤原代细胞的分离及其CDX模型和PDX模型的构建
2019-09-16邹昌业苏乔李武国赵巨鹏樊泽培陈俊恺尹军强沈靖南
邹昌业 苏乔 李武国 赵巨鹏 樊泽培 陈俊恺 尹军强 沈靖南
骨肉瘤是源自骨间叶细胞的恶性原发骨肿瘤,多见于青少年和儿童。肿瘤肺转移是骨肉瘤患者病死的主要原因。化学治疗可以降低骨肉瘤患者的肺转移率[1]。截止至2018年,美国14岁以下骨肉瘤患者5年生存率为69.8%,15~19岁患者5年生存率为65.5%[2]。骨肉瘤的规范化疗方案仍待进一步研究。目前,关于骨肉瘤治疗的一线药物已基本达成共识,但化疗方案和治疗时间还存在较大差异[3]。个体化治疗的兴起对化疗方案提出了新的要求。为了得到更加有效的化疗方案,制备适宜的临床前模型至关重要。目前常用的临床前模型包括细胞株模型、细胞株异种移植(cell-derived xenograft,CDX)模型和源自患者的异种移植(patient-derived xenograft,PDX)模型等。细胞株的培养与使用方便快捷,但在体外培养过程中缺乏肿瘤在体内生长的微环境,反复传代后为适应体外培养环境而发生变异,不能较好地反映肿瘤的异质性和患者的个体特征,也不具有免疫系统。将细胞株植入免疫缺陷鼠,建立CDX模型[4],所得到的肿瘤组织相较于细胞株具有有限的瘤内异质性和免疫系统,但依然不能反映患者的个体特征。PDX模型实现了患者肿瘤组织在免疫缺陷鼠体内成瘤,保留了患者的分子表型和基因型,可以很好地预测后期临床结果[5]。本研究收集骨肉瘤患者的肿瘤组织标本,建立该患者肿瘤细胞的CDX模型和PDX模型,为骨肉瘤患者化疗方案的研究奠定基础。
资料与方法
一、资料
1.肿瘤细胞:患者,女,24岁,2016年8月21日因“右小腿近端疼痛”就诊于中山大学附属第一医院骨肿瘤科。诊断为右胫骨骨肉瘤。接受3次新辅助化疗后,与2016年11月2日接受右胫骨上段和下段肿瘤切除及假体重建术。术后接受12次辅助化疗并定期复查。2018年4月13日病理学检查结果提示:穿刺物镜下为梭形细胞肿瘤,细胞具轻度异性,初步考虑间叶源性恶性肿瘤。2018年4月27日在接受化学治疗期间出现持续发热和肿块疼痛、增大,遂停止化学治疗。2018年5月17日接受右大腿截肢术。术中获取患者新鲜活性肿瘤组织。
2.实验动物:使用4~6周龄BALB/c裸鼠15只(购于江苏集萃药康生物技术有限公司)。饲养于中山大学附属第一医院动物实验中心SPF级实验室[动物使用许可证:SYXK(粤)2015-0108]。
本研究获中山大学附属第一医院伦理委员会批准。患者签署知情同意书。
二、方法
1.原代肿瘤细胞的获取:于截肢术术中切取患者肿瘤包膜下无坏死区域。使用磷酸缓冲盐溶液(PBS)对活性标本进行震荡洗涤,去除标本组织中的血液。将标本剪切为2 mm3组织块,加入少量胎牛血清(fetal bovine serum,FBS)重新悬浮,以眼科镊将组织块逐块贴附于直径10 cm培养皿中,于37℃ 5% CO2培养箱中静置4 h,添加完全培养基(高糖DMEM培养基添加10%FBS、1%青霉素和链霉素和1%谷氨酰胺,均购自美国Gibco公司),置于37℃ 5%CO2培养箱中培养。
待组织块中大量细胞迁出后,使用0.25%胰蛋白酶37℃消化3 min,收集细胞,标记为原代(P0)。收集的细胞重新种植后,标记为第1代(P1)。细胞长满90%培养皿时,分别使用0.25%胰蛋白酶37℃消化3 min和5 min,收集不同消化时间的细胞。将不同消化时间的细胞以培养液重新悬浮后,反复贴壁,进一步将成纤维细胞和肿瘤细胞分离。重复胰蛋白酶消化、反复贴壁、静置培养3次后,观察到多边形和球形肿瘤细胞。使用灭菌后的棉签划去周边成纤维细胞,得到原代肿瘤细胞。对其进行扩增,至第5代(P5)得到肿瘤细胞比例较高的原代肿瘤细胞。
2.CDX模型的建立:取指数增长期第10代(P10)原代肿瘤细胞,使用0.25%胰蛋白酶消化,收集细胞,计数后使用PBS重新悬浮。使用10只裸鼠分为2组,分别建立皮下和胫骨原位CDX模型,每组5只。75%乙醇溶液消毒BALB/c裸鼠皮肤后,在小鼠背部皮下注射75 μl细胞悬液(含150万个细胞),胫骨髓腔注射20 μl细胞悬液(含150万个细胞)。30 d后以颈椎脱臼方法处死小鼠,收集肿瘤组织,使用4%多聚甲醛固定,制备石蜡切片。
将备好的石蜡切片置于组织切片架上并置入烘箱,65℃静置30 min。将组织切片置于通风橱中,自然冷却至室温,依次在二甲苯、梯度(100%、90%、80%、70%、60%)乙醇溶液和超纯水中复水。使用滤纸吸干水分后,浸入苏木素染料中3 min,取出组织切片,使用超纯水洗去多余的苏木素。再次吸干水分后,滴加1%盐酸乙醇溶液,分化5 s,使用超纯水清洗后,吸干水分,加入1%氨水乙醇溶液返蓝10 s,使用超纯水清洗后,吸干水分。浸入伊红溶液中20 min,使用超纯水清洗后,吸干水分,滴加乙醇脱水,滴加中性树胶,使用盖玻片封片。风干后显微镜下检查。
3.PDX模型的建立:使用BALB/c裸鼠5只。将骨肉瘤患者新鲜活性肿瘤组织剪成2 mm×2 mm×3 mm 的组织块,使用FBS混悬。75%乙醇溶液消毒小鼠皮肤后,以眼科剪在小鼠背部剪开约0.6 mm长的切口,于切口两侧皮下分别接种肿瘤组织,每只小鼠接种3~4个部位,以手术缝合线缝合切口。将小鼠置于保温毯上,待苏醒后放回笼盒中。
将从患者身上获得的活性肿瘤组织标记为P0肿瘤组织,移植于BALB/c裸鼠体内首次形成的肿瘤组织(体积为800~1 500 mm3)标记为P1移植肿瘤组织。植入小鼠体内5个月后,P1组织体积达到900 mm3,收获肿瘤组织。将得到的肿瘤组织分为3部分:第1部分用以重复上述操作,以建立稳定的PDX模型;第2部分用以剪碎至10 mm3,加入冻存液(10%DMSO+90%FBS)冻存于液氮罐;第3部分用以制备HE染色切片。
结 果
一、患者肿瘤组织标本
患者肿瘤组织标本中的肿瘤细胞异型性明显,存在病理性核分裂,形态符合间叶源性恶性肿瘤(图1)。
二、原代细胞的获取
患者活性肿瘤组织块迁出的细胞,经胰蛋白酶消化和反复贴壁方法处理后,可以观察到呈多边形的细胞,形态与纤维状的成纤维细胞明显不同(图2A)。刮去成纤维细胞后再进行种植扩增,所获得细胞具有类上皮样细胞形态特点,多为多边形,部分为球形(图2B)。
三、CDX模型的建立
小鼠皮下和胫骨原位CDX成瘤率均为100%。P10肿瘤细胞在胫骨髓腔成瘤后,逐渐侵袭骨组织。收取标本时,小鼠胫骨横截面可见骨肉瘤组织由肌肉组织包裹,未见骨组织(图3A)。肿瘤组织内存在坏死,肿瘤细胞核质比较大,呈多核,存在有核分裂像(图3B)。皮下肿瘤组织与周边组织有明显的分界(图3C)。肿瘤细胞排列紧密,细胞核质比较大,呈多核,核分裂明显(图3D)。
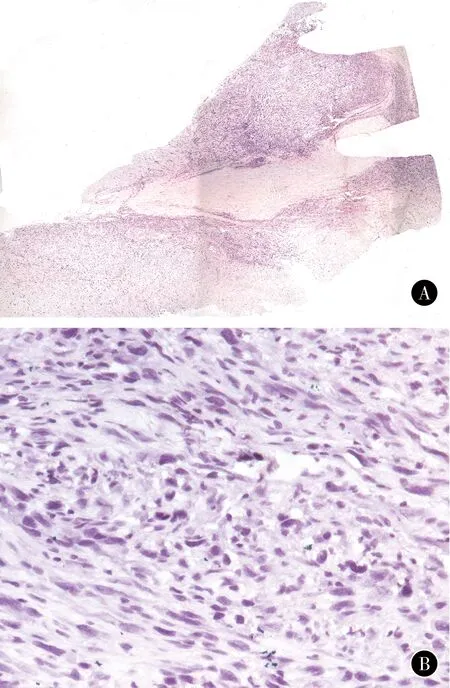
图1患者肿瘤组织标本病理学表现(HE)A肿瘤组织标本全貌B肿瘤细胞存在核分裂像,符合间叶源性恶性肿瘤特点(×400)
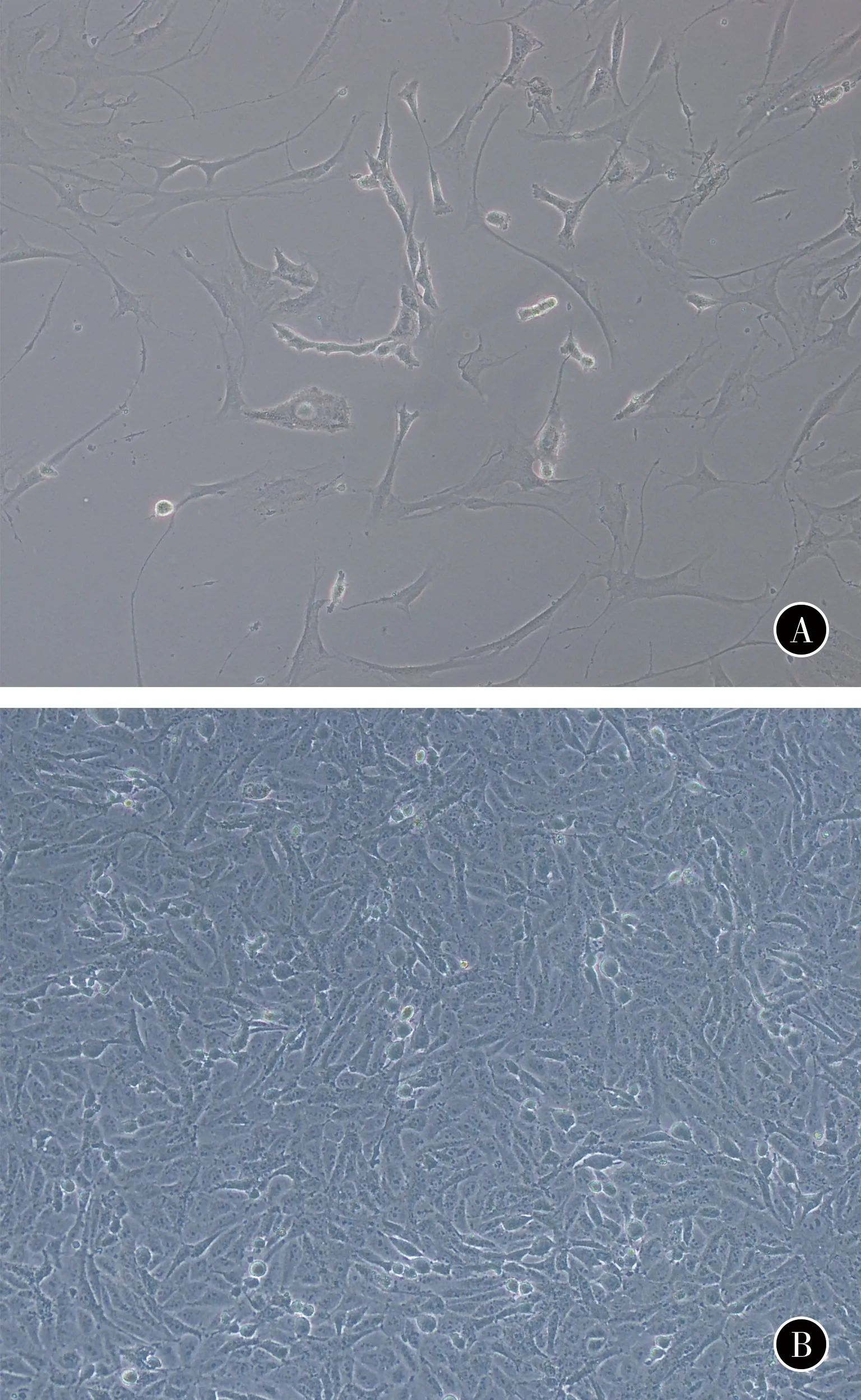
图2原代肿瘤细胞(×100)A反复贴壁后的细胞形态B肿瘤细胞生长形态

图3CDX模型肿瘤组织病理学表现(HE)A胫骨髓腔成瘤及周边组织形态B肿瘤细胞成无规排列,核质比较大(×400)C皮下成瘤及周边组织形态D肿瘤细胞多核分布,核分裂像明显(×400)
四、PDX模型的建立
PDX成瘤率为60%。小鼠肿瘤组织有明显的包膜(图4A),细胞与患者肿瘤组织细胞形态基本相似,呈异型性,核质比较大,存在核分裂像(图4B)。
图4PDX模型肿瘤组织病理学表现(HE)A肿瘤及周边组织形态B肿瘤组织与患者肿瘤组织相似,细胞间质较多,存在核分裂像(×400)
讨 论
骨肉瘤是儿童和青少年人群常见的原发恶性骨肿瘤,严重危害青少年身体健康。骨肉瘤主要包括3种类型,即髓内骨肉瘤、表面骨肉瘤和骨外骨肉瘤,每种类型又可分为多个病理亚型,患者个体差异较大[6]。临床上通过规范的手术和化学治疗可以显著改善骨肉瘤患者的预后。然而,骨肉瘤的病理多样性和基因组异质性导致其诊断困难[7]。现代医学针对患者的个体差异,提出了个体治疗概念。骨肉瘤的治疗亦需要针对不同的患者,结合其病理特征和对药物的反应,制订不同的个体化治疗方案。
适宜的临床前模型是制订有效化疗方案的基础。传统的骨肉瘤细胞株,由于在体外培养过程中缺乏体内生长的微环境,细胞的生物学特性可能发生不可逆转的改变,不能反应患者肿瘤细胞最初的特征,不能满足制订个体化治疗方案的需要。PDX模型是将患者新鲜的肿瘤组织植入免疫缺陷小鼠体内,保留了原代肿瘤细胞更多的特性,同时便于监测肿瘤的生长状况。待肿瘤生长到一定体积,可以对肿瘤组织再进行异位或原位移植。原位移植是将肿瘤组织直接植入小鼠体内人类原发灶对应器官。原位移植肿瘤具有与患者肿瘤更加相似的微环境,能够更准确地模拟其来源肿瘤[8]。孙梦熊等[9]使用骨与软组织肉瘤组织建立PDX模型,成功率为30%~40%,模型与临床病例具有较好的相似性。Blattmann等[10]通过手术建立骨肉瘤胫骨原位PDX模型,MRI和组织病理学研究结果显示移植后的组织与原代肿瘤组织具有相同的结构,移植后的组织传代3次后,基因组与原代肿瘤组织仍高度相似。但是,PDX模型存在生长周期长、费用高和成功率低等局限性[11]。
为弥补PDX模型的不足,本研究在建立PDX模型的基础上,分离患者的原代细胞系,并使用传代次数较少的原代细胞系细胞进行异种移植,建立CDX模型。一方面,原代肿瘤细胞保留了患者肿瘤细胞最初的特点,可以更高程度反应患者肿瘤的特性;另一方面,在CDX模型建立过程中为肿瘤细胞提供了类似患者体内肿瘤细胞生长所需的微环境,可避免体外培养引起的肿瘤细胞变异,使CDX模型可以起到类似PDX模型的作用,呈现出肿瘤细胞在类似患者体内微环境下对化学治疗药物的反应。自新鲜肿瘤组织块迁出的细胞以纺锤状成纤维细胞为主,未能直接观察到肿瘤细胞。肿瘤细胞与成纤维细胞贴壁后的黏附强度不同,使用胰蛋白酶消化3 min后,大量成纤维细胞从培养皿上脱落,可以初步将肿瘤细胞和成纤维细胞分开。这两种细胞贴壁的速度也不同,设置不同的贴壁时间并反复贴壁,进一步筛去成纤维细胞,最终观察到形态明显不同于成纤维细胞的肿瘤细胞。当单位面积内肿瘤细胞较多时,形成肿瘤细胞克隆,与成纤维细胞具有明显的界线,使用灭菌后的棉签划去周边的成纤维细胞,得到骨肉瘤原代细胞。骨肉瘤原代细胞在体外培养时间较短,保留了患者肿瘤的生物学特性。相较于PDX模型的建立,肿瘤原代细胞的分离过程时间较短,可以快速用于化疗方案的体外研究;亦可收集分离出的成纤维细胞,用于化疗方案副作用的体外研究。将分离出的原代肿瘤细胞植入小鼠皮下和胫骨髓腔,建立CDX模型。结果显示分离出的原代肿瘤细胞具有较高的致瘤性,成瘤率为100%,所致肿瘤呈现恶性肿瘤的特点。收集成瘤后的组织,通过HE染色可见肿瘤细胞存在多核、核分裂像,与患者肿瘤细胞相似,但细胞密度高于后者。
总之,本研究分离出骨肉瘤患者的原代肿瘤细胞,同时建立CDX模型和PDX模型,弥补了现有骨肉瘤临床前模型的部分不足。所建立的3个不同层面临床前模型可以反映患者肿瘤细胞的生物学特性,可为临床制订有效的个性化化疗方案奠定基础。本研究亦有明显的不足之处:仅有1例病例;缺少必要的方法对照;尚未开展患者个性化化疗方案的研究。
