土壤中一株溶磷菌的筛选和溶磷能力初探
2019-09-16许昌超郑富海叶少萍张俊涛
许昌超,郑富海,李 铤,叶少萍,张俊涛
(广州市林业和园林科学研究院,广东 广州 510405)
在中国南方地区,红壤是比较常见的土壤类型,研究表明,因红壤独特的理化性质导致红壤更容易缺乏有效磷,进而造成植物营养性缺磷,磷元素已成为南方农林生产过程中重要的养分限制因子[1-2].为了满足植物生长对磷元素的需求,大量使用含磷化肥导致土壤环境问题加剧,同时造成水体严重的富营养化[3].此外,由于磷富矿资源的大量消耗,我国国土资源部已把磷矿列为2010年后不能满足国民经济发展需要的20种矿产之一[4].因此,研究如何提高土壤环境中磷元素利用效率问题具有迫切的实际意义.
土壤微生物的代谢活动对土壤的理化环境和土壤肥力具有很大的影响,研究表明土壤中存在为数不少的能够溶解难溶性磷酸盐的微生物,这些微生物被统称为溶磷微生物[5].已经发现的具有溶磷能力的微生物包括真菌、放线菌以及细菌,利用微生物来提高土壤中有效磷的含量对解决植物生长缺磷问题具有重要意义[6].目前,已经有相当一部分含有溶磷微生物的菌肥在玉米、水稻等种植过程中得到应用,并获得预期的效果,展现了良好的开发和应用前景[7-8].笔者拟从南方典型红壤中筛选出具有优良溶磷效果的菌株,初步对其溶磷特性展开研究,为利用溶磷菌提高土壤中有效磷的含量提供一些科学依据.
1 材料与方法
1.1 实验材料
供试土壤:广州市番禺区典型林地红壤.3个取样点分别是乔木、灌木和草坪植物的根际土壤样品,标记为JL1、JL2和JL3,每种样品3个重复,JL1、JL2和JL3是3个重复的混样.
试剂材料:无机磷基础培养基[9]、可替换无机磷源(AlPO4、Ca3(PO4)2或磷矿粉)、可替换碳源(葡萄糖、果糖、蔗糖、麦芽糖、淀粉或纤维素)、富集培养基[10]、真菌DNA提取试剂盒(OMEGA)、HPLC标准品(乙酸、苹果酸、柠檬酸、琥珀酸、丙二酸、葡萄糖酸、酒石酸和乳酸,标准品,均购自Sigma-Aldrich).
1.2 实验方法
1.2.1 初筛及复筛
取3 g供试土壤样品,在无菌条件下研磨成粉状,加入50 mL富集培养基中,隔夜培养.取适量富集培养基按照10-2,10-3,10-4,10-5进行梯度稀释至1 mL,取0.1 mL稀释液涂布于无机磷筛选培养平板上,每个梯度3个重复.27 ℃条件下(经实验获得的适宜生长温度)培养3~7 d,挑取周围具有明显溶磷圈的菌落,分别重新接种于无机磷筛选培养平板上并划线,直至出现明显的单菌落.
1.2.2 固体平板上溶磷能力测定
挑取菌株,接种于固体筛选平板上,27 ℃条件下培养,测定溶磷圈直径(D)和菌落直径(d),通过二者比值(D/d)初步确定对应菌株的溶磷能力[11].
1.2.3 菌株的分子遗传学鉴定
将M1接种于5 mL的液体培养基,培养48 h,提取基因组.扩增的通用引物为ITS1 (5′TCCGTAGCT GAACCTGCGG3′) 以及ITS4 (5′TCCTCCGCTTATTGATATGC3′)[12].优化后的PCR反应程序如下:95 ℃ 5 min;95 ℃ 45 s,56 ℃ 30 s,72 ℃ 1.5 min,32循环;72 ℃ 5 min;4 ℃保存.PCR反应体系:2 × PCR预混液25 μL、上游引物1.5 μL、下游引物1.5 μL、模版2 μL,补水至50 μL.使用1%琼脂糖凝胶纯化并回收PCR产物,测序并分析,利用MEGA 5.0进行系统发育树的建立.
1.2.4 液体培养条件下解磷能力测定
从平板上分别挑取单菌落接种于3 mL无机磷基础培养基,27 ℃培养2 d.取1 mL菌液按1∶100体积比接种于500 mL摇瓶中(含100 mL无机磷基础培养基),设置接种1 mL无菌无机磷培养基作为对照.连续培养7 d,每天取样,离心收集上清液,利用钼蓝比色法测定有效磷含量,并记录对应pH,重复3次.
为了检测M1对不同无机磷源的溶解能力,将M1分别接种到以AlPO4、Ca3(PO4)2或磷矿粉为无机磷源的液体培养基中进行培养[9].培养和数据监测如上.
为了研究碳源对菌株溶磷能力影响,以葡萄糖、果糖、麦芽糖、蔗糖、淀粉以及纤维素分别单独作为无机磷基础培养基中的碳源来培养菌株M1[13].培养和数据监测如上.
1.2.5 有机酸种类及含量测定
取发酵液样品进行高速离心后,取上清经过滤、除盐、稀释等处理,用高效液相色谱仪(岛津,LC-20A)对发酵液中有机酸成分进行分析.色谱条件:色谱柱Suprsil C18,250 mm×4.6 mm,5 μm;检测波长214 nm;流动相为25 mmol·L-1KH2PO4水溶液,用磷酸调pH至2.5;流速1.0 mL·min-1;柱温30 ℃.
1.2.6 数据分析
采用SPSS 21.0软件对培养基pH和溶磷量进行Pearson相关性分析;各项指标测定结果表示为平均值±标准差;相关图表用Excel 2007制作.
2 结果与分析
2.1 解磷微生物的筛选
土壤微生物在部分无机磷基础培养基平板上的生长情况如图1所示,其中,样品JL2、JL3对应的平板上均观察到明显的溶磷斑块(图1中黑色箭头所示),CK为涂布等量无菌水的阴性对照.对JL2平板上的溶磷菌株进行了纯化和传代培养验证(图2所示),证明了菌株的纯度和溶磷能力的遗传稳定性.由图2可以看出,该菌株为丝状真菌,培养基质中的菌丝为乳白色,气生菌丝为灰黑色(颜色随着成熟程度加深),初步判定为黑曲霉(简写M1),菌落周围可观察到透明溶磷斑块.其27 ℃条件下培养4 d后溶磷圈直径(D=(46.4±5.17) mm)和菌落直径(d=(26.8±2.28) mm)对比最为明显,D/d可达1.73.

图1 采样点对应的土壤微生物在部分无机磷基础培养基上溶磷斑的鉴定

从第2列到第5列为传代过程,图示为依次传代后第7天的生长状况.图2 解磷霉菌M1的纯化
2.2 菌株M1的分子生物学鉴定
霉菌M1的ITS序列PCR产物测序结果显示该序列长度为600 bp左右.利用MEGA 5.0 构建系统发育树(图3),M1与黑曲霉Aspergillusniger的ITS序列同源性达99%.

图3 M1基于ITS序列差异的系统发育树构建
2.3 M1对不同磷源的溶磷能力测定
图4为M1对不同磷源的溶磷结果.

图4 菌株M1的溶磷能力鉴定
图4显示,在以Ca3(PO4)2为磷源的液体环境下,培养5 d后,溶液中有效磷含量达到峰值为75.4 mg·L-1(图4(a));在以AlPO4为磷源的液体环境下,培养6 d后,溶液中有效磷含量达到峰值为138.3 mg·L-1(图4(b));在以磷矿粉为磷源的液体环境下,培养5 d后,溶液中有效磷含量达到峰值为82.4 mg·L-1(图4(c)),存在一定差异.综合图4的趋势来看,随着M1培养液pH的降低,溶液中可溶性磷的含量升高.对培养液pH与溶磷值的相关性进行了分析,表明M1对Ca3(PO4)2、AlPO4以及磷矿粉的溶解能力与对应发酵液的pH均具有显著负相关性(p≤0.01).
2.4 碳源种类对M1溶解磷矿粉的能力影响
不同碳源培养下M1溶解磷矿粉的结果列于表1.

表1 M1在6种碳源培养条件下的溶磷量与对应的pH和菌体质量
由表1可知,在以麦芽糖和蔗糖为碳源时,M1的溶磷峰值分别可达161.0 mg·L-1和147.2 mg·L-1,较以葡萄糖为碳源条件下的溶磷峰值(82.4 mg·L-1)提升了约两倍;果糖培养条件下,溶磷峰值(57.4 mg·L-1)低于葡萄糖;在以淀粉为碳源的培养条件下,M1的溶磷峰值(4.8 mg·L-1)大幅降低,纤维素作为碳源时,溶磷能力(2.7 mg·L-1)最低.从数值上来看,发酵液的pH与溶磷量也存在一定的关联.对菌体质量的研究结果表明,在以葡萄糖、果糖、蔗糖和麦芽糖为碳源培养条件下,M1可以正常生长,但是M1很难利用淀粉和纤维素进行增殖.
2.5 HPLC测定结果
对有机酸标准品与M1发酵液的HPLC分析测试结果如图5、6所示.

图5 8种小分子有机酸混合标准品色谱图
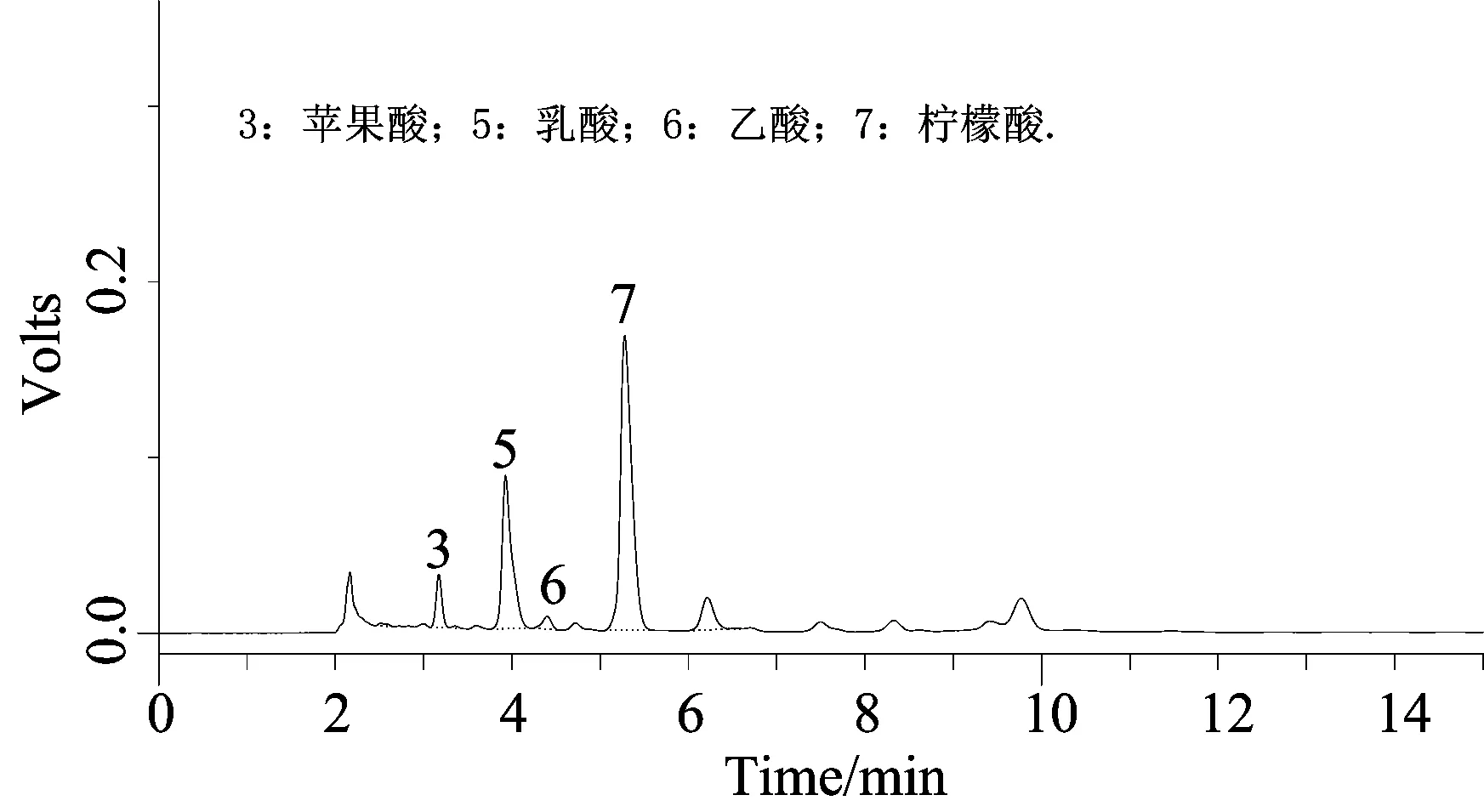
图6 发酵样品色谱图
由图5、6通过比对发现发酵液中确实含有有机酸成分,主要包括苹果酸、乳酸、乙酸和柠檬酸.
在以Ca3(PO4)2为无机磷源条件下,连续培养7 d,对4种有机酸的总量和溶磷能力之间的相关性进行分析.分析结果如表2所示,M1的溶磷能力和苹果酸、乳酸、乙酸以及总有机酸含量的相关性不显著,但与柠檬酸的含量之间存在显著相关关系(p≤0.01).

表2 M1发酵液中有机酸含量与溶磷量之间的相关性
注:**代表显著相关(n=21,p≤0.01).
3 结论与讨论
液体培 养实验表明M1对Ca3(PO4)2、AlPO4以及磷矿粉均具有较高的溶解能力,溶解能力表现为AlPO4> Ca3(PO4)2和磷矿粉(图4),对AlPO4具有一定的偏好性.已有研究表明,同一株解磷微生物对不同的难溶性无机磷酸盐的溶解能力存在差异[14].目前,一般认为真菌溶磷的能力主要与其向培养基中分泌的小分子有机酸有关.分泌有机酸一方面可以降低培养基pH,利于难溶性磷酸盐的溶解;另一方面可以通过结合铁、镁、钙、铝等离子将磷酸盐释放出来[15-16].因此,造成M1对不同无机磷源溶解能力的差异可能与M1分泌的有机酸对不同金属离子的螯合能力存在差异有关.
在实验中添加了3种无机磷源的培养液在接种M1之后,培养液的pH较对照均有明显的下降趋势,通过相关性分析发现,M1对AlPO4、磷矿粉以及Ca3(PO4)2的溶磷能力与发酵液的pH存在显著的负相关关系(p≤0.01),这一结果反映出溶磷量与发酵液pH在数值上的相关性,至于二者是否存在机制上的因果或其他关系,还有待于从分子遗传学角度进一步验证,如Goldstein等[17]将细菌Erwiniaherbicola中一段与吡咯喹啉醌(PQQ)合成相关的序列导入E.coliHB101中,使其能够产生葡萄糖醛酸(GA),从而获得了解磷能力;Miller等[18]通过转座子随机插入的方式构建了解磷菌PseudomonasfluorescensF113突变体库,对解磷能力显著下降的突变体分析发现,大部分插入突变都发生在葡萄糖脱氢酶(GDH)和PQQ合成基因上,这些结论说明了葡萄糖醛酸的分泌与若干菌株的解磷能力直接相关,未来的工作可以朝着这一方向开展.
笔者在研究中还发现M1在不同碳源的培养条件下,对磷矿粉的溶解能力表现为麦芽糖>蔗糖>葡萄糖>果糖>淀粉>纤维素.其中,以葡萄糖为碳源有利于菌体生长, 利用麦芽糖和蔗糖作为碳源可以显著提高M1的溶磷能力,淀粉和纤维素不适宜M1的增殖和溶磷,这些结果具有一定的发酵和生产意义.未来可以根据实际需求来选择碳源的种类.同时,从数值上来看,对应的6种碳源的发酵液pH越低,发酵液溶磷量也越高,这一现象说明碳源可能通过影响有机酸的分泌来改变菌株的溶磷能力.
发酵液的HPLC分析结果表明发酵液中含有苹果酸、乳酸、乙酸和柠檬酸,显著性分析表明M1的溶磷量和乳酸、乙酸、苹果酸和总有机酸含量之间关系不显著,和柠檬酸含量显著相关,这可能和不同有机酸与金属离子的螯合能力不同或者有机酸的含量有关.余文煜等[19-21]通过研究发现小分子有机酸或有机酸盐可以作用于Ca3(PO4)2、AlPO4等无机磷源来提高土壤有效磷含量,并且不同有机酸或有机酸盐之间的能力存在差异.目前,也有研究表明有些溶磷菌的溶磷能力与其分泌的有机酸含量和pH并无明显相关性,推测可能存在其他复杂的溶磷机制[22-23].
