一种新颖的荧光生物传感系统对大肠杆菌的荧光检测
2019-09-18杨席席韦瑞林
任 乐,杨席席,韦瑞林,余 跃*
(1.中国科学技术大学 附属第一医院消化内科,安徽 合肥 236001;2.合肥市第二人民医院 消化内科,安徽 合肥 230000)
大肠杆菌(Escherichiacoli)是一种常见的肠道细菌,在肠道微生态中占有重要地位[1].肠道菌群与其宿主相互作用、相互影响,直接影响着人体的健康[2].其中,E.coli被认为可能导致肠易激综合征、消化性溃疡、炎症性肠病、肝脏疾病等肠内外多种疾病的发生[3-6].目前,E.coli的常规检测方法主要有多管发酵法、滤膜法以及稀释平板计数法等[7],但存在着耗时长、灵敏度低、操作繁琐等缺点.因此,建立快速、灵敏、准确的E.coli检测方法,具有重要的临床应用价值.光学生物传感器由于具有低成本优势,被越来越多地用于临床诊断.聚二乙炔(PDA)同时具有肉眼可见的蓝-红颜色变化和荧光响应的特性,并且对外部刺激(如压力、pH、温度等)非常敏感,这使得PDA适用于荧光传感器系统.笔者利用静电纺丝技术制备了一维(1D)结构的凝胶/PDA纤维,并与E.coli及其他菌群进行共培养,利用荧光显微镜记录纤维产生的荧光,同时通过扫描电镜(SEM)观察纤维表面的变化,以揭示该纤维是否可用于E.coli的检测.
1 材料和方法
1.1 主要仪器和试剂
二十戊二酸酯,分析纯,日本东京化学工业株式会社;HydroMed-D4(凝胶),美国AdvanSource生物材料公司;胰蛋白酶大豆肉汤(TSB),海博生物技术公司;四氢呋喃等试剂和溶剂,均为分析纯,中国医药集团总公司;紫外可见吸收光谱(UV-Vis),型号为SHIMADZU UV-2550 PC,日本岛津公司;荧光显微镜,型号为BX-51,上海赖氏电子科技有限公司;荧光光谱仪,型号为RF-5301,日本岛津公司;氙灯光源扫描电子显微镜(SEM),型号为FEI Sirion200,德国蔡司集团公司;光谱仪,型号为iHR550,日本HORIBA公司;相机,型号为DS-U2,日本尼康.
1.2 PDA纺丝制备
将含有150 mg二烯酸的溶液加入2 mL四氢呋喃中并过滤至450 mg凝胶(二乙炔(DA)/凝胶重量比1∶3)中,持续搅拌6 h,直至均匀透明.通过静电纺丝制备含有DA的微细纤维.正极电压为12.5 kV,负电压为-0.5 kV,注射速度为0.5 mm·min-1,喷嘴与收集载玻片之间的距离为10 cm,溶液在喷嘴位置形成高压电场“泰勒锥”,形成直径1~3 μL的丝状纤维.将纤维置于事先紫外线灭菌好的载玻片上.将254 nm紫外灯置于超细纤维8 cm上方,持续的紫外线照射小于或等于5 min,用于聚合纤维中的小分子DA.DA单体聚合成PDA,纤维从原来的白色聚合成蓝色.将这种附着有电纺纤维的载玻片置于无菌培养皿中备用.整个过程注意无菌操作,以防止环境中的杂菌污染对随后实验产生影响.
1.3 细菌培养
分别将E.coli(ATCC25922)、鼠沙门氏细菌(CS093)和金黄色葡萄球菌(ATCC25923)菌落接种到新鲜胰蛋白酶大豆肉汤(TSB)中,并在37 ℃下孵育18 h至平稳期.将400 μL培养物用新鲜的TSB 40 mL,并在37 ℃至中期对数期间再生长(OD600=0.7).细菌细胞用新鲜胰蛋白酶大豆肉汤调整至1×107CFU·mL-1,备用.
1.4 扫描电子显微镜(SEM)图像
利用2%戊二醛固定待测样品,并用0.1 M磷酸缓冲盐溶液(phosphate buffer saline,简称PBS)(pH 7.2~7.4)在37 ℃下静置2 h.随后用乙醇/水梯度(30%~100%)进行纤维脱水,并在室温下浸入六甲基二硅氮烷(HMDS)/乙醇梯度溶液(30%~100%)中.该过程重复7次(每个不同浓度梯度1次),每次持续15 min.空气干燥直到HMDS完全蒸发,脱水样品真空干燥2 h,并用溅射装置EMITECH K575x(Emitech Ltd,UK)镀金.使用仪器软件进行操作和分析的Jeol JSM-7400F扫描电子显微镜(FEI Sirion200)记录SEM图像.
1.5 荧光显微镜及光波导
将无菌培养皿中附着有纺丝纤维的载玻片置于UV灯中3 min,然后将4 mL 3种不同的细菌悬浮液缓慢滴加到培养皿中.在含有凝胶/PDA纤维的无菌培养皿和等量的细菌溶液(1×107CFU·mL-1)在37 ℃下的恒温培养箱中持续培养.并在显微镜下每2 h观察1次,观察纤维样品前用蒸馏去离子水(DDW)缓慢洗涤.使用BX-51荧光显微镜获得附着在纤维上的细菌诱导荧光显微镜图像.来自氙灯的435 nm光源(Δλ=5 nm),可见光强度为20 mW·cm-2.通过氩/氪产生568 nm波长的激发光.发射的光通过屏障滤光片(580~700 nm).记录640 nm激发光下不同细菌培养后的PDA纤维的荧光变化.最后将事先培养好的107CFU·mL-1E.coli菌液分别用营养液逐渐稀释至106,105,104CFU·mL-1,同时将不含有菌液的营养液作为对照组,将4种浓度梯度的菌液分别取4 mL,与凝胶/PDA纤维共培养,观察前先用去离子水缓慢冲洗纤维表面,然后将单个纤维置于光波导系统中进行测定.在纤维体上发射532 nm的激发光,同时改变细菌溶液浓度,在与细菌一起培养6 h后测量纤维尖端耦合光的输出强度的变化并记录图像(上述实验重复至少3次).
1.6 统计学处理
2 结果与分析
2.1 实验原理及凝胶/ PDA纤维的制备和表征
图1为凝胶/PDA纤维用于细菌荧光检测过程示意图.

图1 凝胶/PDA纤维用于细菌荧光检测过程示意图
如图1所示,首先用载玻片作为支撑材料,收集利用静电纺丝技术制备的凝胶掺杂的DA纤维,进一步通过紫外聚合成为蓝相,随后利用事先培养好的E.coli菌液(107CFU·mL-1)在无菌培养皿中和该纤维共培养.4 h后,蓝相PDA纤维出现肉眼可见蓝红相转换.当凝胶/PDA纤维向红相转变时,可以检测到纤维的荧光变化.
图2展示了凝胶/PDA纤维与细菌孵育前后吸收峰和荧光的变化.
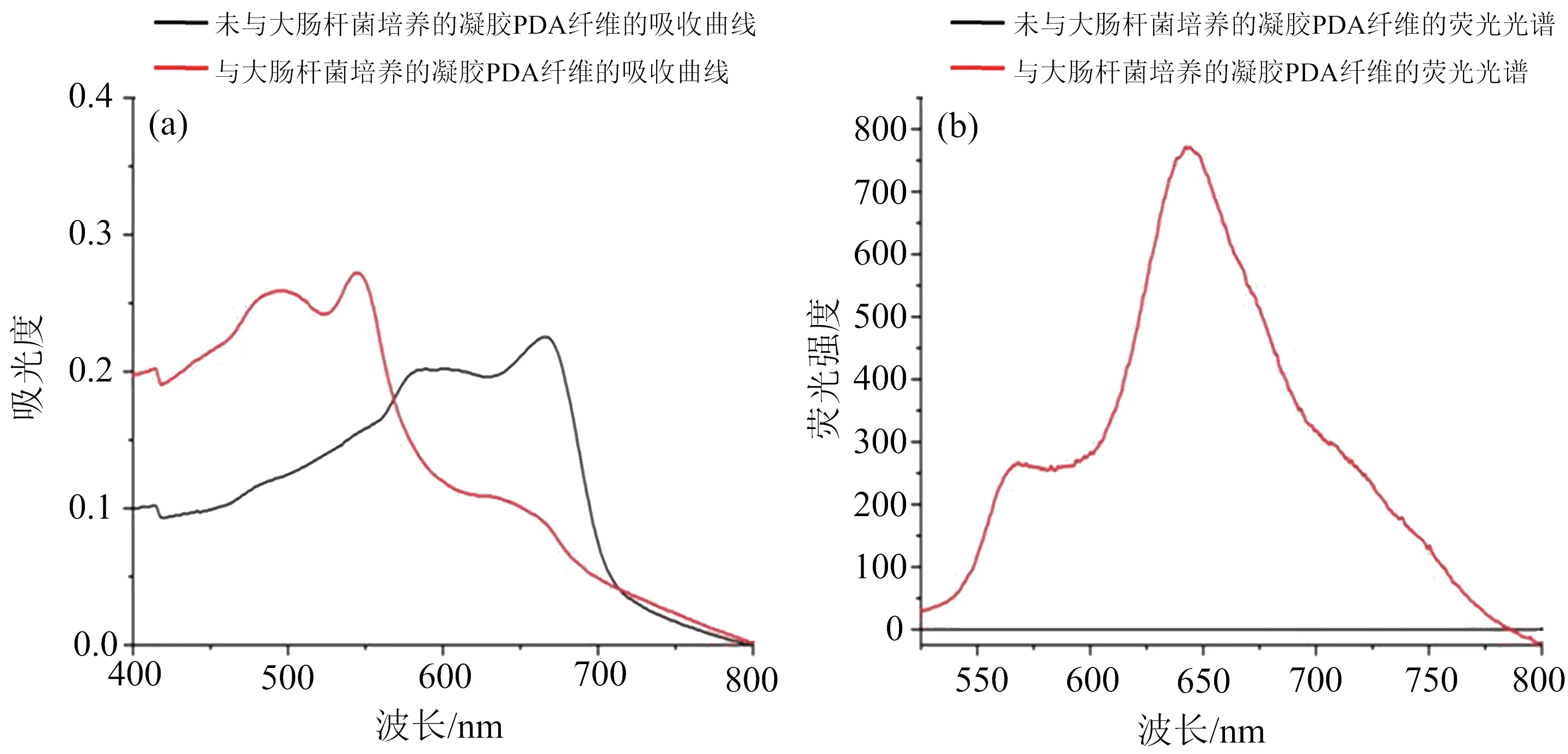
图2 凝胶/PDA纤维的吸收光谱(a)和荧光光谱(b)
如图2(a)所示,未与E.coli培养的蓝相凝胶/PDA纤维具有的特征吸收峰在585 nm和645 nm.与起始浓度为107CFU·mL-1的E.coli菌液培养2 h后,蓝相凝胶/PDA纤维逐渐转变为红相,此时,红相凝胶/PDA纤维的吸收峰偏移到500 nm和550 nm(图2(a)).图 2(b)展示了凝胶/PDA纤维激发荧光强度的变化.未与E.coli培养的蓝相凝胶/PDA纤维不发出荧光,与E.coli共孵育后,红色凝胶/PDA具有明显的荧光(图2(b)).以上结果表明,E.coli可能是引起凝胶/PDA荧光性质变化的原因.
图3展示了凝胶/PDA纤维与E.coli孵育前后纤维表面的变化.

(a):E. coli培养前凝胶/PDA纤维的SEM图像;(b):E. coli培养后凝胶/PDA纤维的SEM图像.图3 E. coli孵育前后纤维表面的SEM图像
如图 3(a)所示,通过SEM观察,电纺纤维的直径约为1~3 μm.进一步观察发现,与E.coli(107CFU·mL-1)孵育4 h后,E.coli可在PDA电纺纤维周围黏附,并产生生物膜(图3(b)),提示凝胶/PDA吸收峰和荧光强度的改变可能与E.coli的附着有关.
2.2 凝胶/ PDA纤维对E. coli检测的专属性
进一步观察凝胶/PDA纤维是否可应用于检测不同类的菌株(E.coli、鼠沙门氏菌、金黄色葡萄球菌),结果如图4所示.

(a):凝胶/PDA纤维与不同细菌培养0~6 h的荧光变化;(b):凝胶/PDA纤维与不同细菌培养6 h后的荧光强度比较.&&p<0.01,与对照组相比;##p<0.01,与鼠沙门氏菌组相比;**p<0.01,与金黄色葡萄球菌相比.图4 凝胶/PDA纤维与不同细菌培养后的荧光变化
如图4(a)所示,共培养2 h后,4组凝胶/PDA纤维均未观察到明显的荧光.4 h后,E.coli组能够检测到较弱的红色荧光,随着时间的推移,在培养6 h时可以观察到明显的红色荧光,而其他3组在培养4 h和6 h时均未观察到明显的荧光.图4(b)展示了培养6 h后各组荧光强度的统计值比较,与其他3组相比,E.coli组具有更高的荧光强度,差异具有统计学意义(p< 0.01).以上结果提示,凝胶/ PDA纤维用于E.coli的检测具有一定的专属性,可作为E.coli的高选择性生物传感器.
2.3 凝胶/PDA纤维对E. coli检测的敏感性

(a):耦合光强度变化随细菌浓度变化的光波导系统示意图;(b):不同浓度的E. coli孵育时,532 nm激发光下凝胶/PDA纤维光波导照片;(c):不同浓度梯度的E. coli对凝胶/PDA纤维耦合光强度的影响;(d):在6 h时间点,4个浓度取对数值和凝胶/PDA纤维的耦合光强度的线性变化曲线.图5 不同浓度梯度的E. coli对凝胶/PDA纤维光波导成像的影响
进一步观察不同浓度梯度的E.coli对凝胶/PDA纤维光波导成像的影响,结果如图5所示.由图5(a)~(c)所示,随着E.coli浓度的增加,凝胶/PDA纤维输出端端口耦合光的强度随着E.coli浓度(104~ 107CFU·mL-1)的增加而增强.并且,浓度的对数值和纤维尖端的耦合光强度间呈线性关系(Y=42.328X-420.633,图5(d)),这种线性关系进一步表明了凝胶/PDA纤维的荧光变化是由E.coli引起,为临床上通过凝胶/PDA纤维检测E.coli提供了一定的理论依据.
3 讨 论
研究中,笔者利用静电纺丝技术制备了一维(1D)结构的凝胶/PDA纤维,其制备过程快速,结构简单,成本低,适合大规模商业化的生产和应用.PDA作为生物传感器常用的一种材料,由于成本低,近年来被越来越多地用于细菌的快速检测[8].PDA对外部刺激(压力、pH、温度等)非常敏感,具有肉眼可见的蓝红相转变和外界刺激诱导下产生荧光的两种特性,使得PDA更适用于基于荧光激发的传感器系统.因此,利用PDA以上的特性,该研究设计的凝胶/PDA纤维被发现可方便快捷地应用于E.coli的检测.目前,关于E.coli的检测光学生物传感器还包括氧化多孔硅纳米材料,可实现对103CFU·mL-1的E.coli快速、灵敏和可重复的检测[9].与该纳米材料相比,虽然该实验设计的凝胶/PDA纤维灵敏度略低(104CFU·mL-1),但是与纳米材料高昂的成本相比,该研究使用的PDA材料成本非常低,可应用于大规模生产,并且在后续的研究中,将通过纯化E.coli、减少外界环境的干扰等措施,逐步提高凝胶/PDA纤维的灵敏度.另外,传统的E.coli检测方法耗时较长且操作复杂,不适合大批量样品的检测,检测时间过长还会造成诊治的延误,该研究设计的凝胶/PDA纤维仅仅需要4~6 h就可以实现对E.coli的检测,并且操作步骤简单易掌握,适合医技人员的使用.
笔者利用纤维作为整合材料,易于小型化,可以进一步集成到芯片中以实现便携式诊断.纤维可以用作有源光波导,允许局部激发的光沿着其进行传播.近年来,研究人员利用这种纤维波导传感器系统进行了大量的科研和检测工作[10-12],其具有几个显著的特点:第一,凝胶/PDA纤维中的激发位置和输出耦合位置位于纤维的两端,因此有助于减少环境荧光的干扰.凝胶/PDA纤维的波导传感器可以应用于复杂的化学和生物环境中.第二,1D的凝胶/PDA纤维结构中的高表面体积比有利于分析物分子的扩散,有利于细菌表面物质变化的瞬间捕获以及记录荧光淬灭过程中的波导变化.
使用另外两种常见的菌种鼠沙门氏细菌和金黄色葡萄球菌作为对比组,进一步利用该光学生物传感系统观察对E.coli的特异性检测.结果显示,鼠沙门氏细菌组和金黄色葡萄球菌组在与凝胶/PDA纤维共培养后,几乎观察不到荧光的产生,而E.coli组则表现出较高的荧光强度,提示凝胶/PDA纤维可特异性地应用于E.coli的检测.随后利用不同浓度梯度的E.coli和凝胶/PDA纤维孵育,结果发现随着E.coli浓度的增加,荧光强度逐渐增强,并且存在线性关系.分析特异性和相关性发生的原因,可能是由于E.coli产生的生物膜和/或由膜活性细菌分泌物引起.这些活性物质可能是目前被广泛研究的E.coli标记物和公认的毒力因子.如乳铁蛋白B,即通过胃乳糖酶消化牛乳铁蛋白产生的肽,在pH 5.5~7.5的范围内与E.coli的活性存在一定的关联[13].另外,E.coliα-溶血素的钙依赖性构象转变[14]、细菌表面膜中的脂质以及细菌产生的毒素等[15]均被认为可以间接反映E.coli的活性,可作为用于E.coli的检测指标.因此,这些分泌物可能是E.coli诱导凝胶/PDA纤维产生荧光的原因和机制所在,需要进一步的研究加以论证.
综上所述,该研究成功开发了一种用于检测E.coli的新型光波导传感器.该微米纤维具有成本低、制备工艺简单、材料灵活性好、应用广泛等优异性能.另外,这种光波导系统由于尺寸小,预计未来可以进一步整合到芯片中用于E.coli感染的临床诊断.
