微生物合成纳米银的一般方法及产物性质鉴定与生产应用
2019-09-16董周焱ManikPrabhuNarsingRao李文均
董周焱, Manik Prabhu Narsing Rao, 肖 敏, 李文均
(中山大学 生命科学学院,广东 广州 510275)
“纳米”一词来源于希腊语的“矮人”,是介于宏观材料与微观粒子之间的桥梁[1]。1959年11月, Richard Feynman在美国理工学院所做的著名演讲“ There′s a plenty of room at the bottom ”中首次提出了纳米技术的概念[2];1974年,东京科技大学的谷口纪男教授首次用纳米技术(Nanotechnology)一词来描述半导体工艺;1981年,随着扫描隧道显微镜的发明,人类的目光开始接触原子世界;1990 年7月,美国巴尔的摩举办了第一届国际纳米科学技术会议,纳米科学自此逐渐兴盛起来,成为全球科研领域的热点。
纳米材料独特的理化性质引起了科学界的广泛兴趣,由于其尺度与电子的相干长度相近,强相干效应所带来的自组织会使材料性质发生很大变化;而且纳米材料的尺度与光的波长接近,加上其具有极大的比表面积,因此纳米粒子所表现的特性,如熔点、磁性、光学、导热、导电特性等,往往不同于该物质在整体状态时所表现的性质。虽然纳米技术自20世纪90年代才起步,但人类对纳米粒子的应用古已有之。早在千年前,中国人的祖先学会了使用纳米级的金粒子为陶瓷染色。收藏于大英博物馆的莱克格斯杯应用了纳米级重金属染料,能够在不同光照条件下呈现不同的颜色。中世纪时,纳米粒子也常常用来装饰大教堂的彩绘玻璃,印度古代著名的科学家Siddhars也曾使用纳米级银粒子作为药物[3-4]。
银的抗菌特性早已为人们所熟知,其应用可以追溯到公元前4 000年,中国古代和古埃及都有覆盖银片为伤口消毒的记载,亚里士多德曾建议亚历山大大帝用银器来储存煮过的水,延长储藏时间。无独有偶,罗马药典中也记载了使用银离子作为抗菌剂的历史[5]。近代在医药领域应用银抗菌作用的例子也很多,如18世纪晚期,德国产科医生Crede推广了一种用1%硝酸银溶液治疗新生儿眼炎的方法,19世纪中叶Joseph Lister和Marion Sims用银线作为手术的缝合线,大大降低了败血症的风险[6]。
因为独特而卓越的杀菌作用,在众多纳米粒子中,纳米银的应用最为广泛,中国现今已开始大量使用纳米银作为火车和电梯的杀菌剂。其抗菌活性不会引起耐药突变,可应用于多种医药领域,例如烧伤药膏和医疗器械涂层[7-8]。鉴于其广泛的应用前景,纳米粒子合成技术成为研究的热点。迄今为止,纳米银合成主要有化学、物理和生物三种途径,其中化学途径又可细分为单糖还原法、硝酸盐还原法、氰硼化钠还原法、多元醇法、核心生长法、镜像反应法;物理途径主要是离子注入法。这两种方法虽然能够快速合成尺寸均一的纳米银粒子,但所使用的试剂毒性强,生产过程污染大[5]。因此,在倡导绿色工业、可持续发展的今天,生物合成途径逐渐受到人们的重视[9]。生物法合成纳米粒子有微生物法和植物法两种,其中微生物法合成纳米银以真菌和细菌最为常见(表1)。纳米银粒子的形态并不单一,大致可分为球形、三角形、立方体形等,纳米粒子材料的各项特性受到其构成粒子尺度的影响,即使尺度不变,粒子形状发生改变,也会使纳米银材料的光学特性发生改变。相比较物理法和化学法,生物法合成的纳米银粒子尺度并不均一,形态也不甚相同,但通过控制反应条件(如温度、pH、浓度等)仍然可以对产物的质量进行一定程度上的控制,使其具有投入生产应用的潜力。植物法合成纳米粒子往往需要大量原材料,而植物材料的生长较为缓慢,相比较而言,微生物法合成纳米粒子的优势在于经济环保,对反应条件要求较温和,在追求绿色产业、可持续发展的今天,微生物法与物理法、化学法合成纳米银粒子可以在不同领域互为补充,降低成本、减少污染。本文将对近年来该方法的进展做一个综合性阐述,旨在为纳米粒子合成技术的突破提供参考。

表1 部分微生物法合成的纳米银粒子

续表1
1 纳米银粒子产物的性质鉴定
验证纳米银的生成首先可以通过颜色变化来判断,纳米银溶胶一般呈粉红色到红褐色,如图1所示,溶液颜色改变可以初步认为产生了纳米银粒子。而纳米银粒子的性质一般通过尺度、形状、表面积和分散度来表征。在生产应用中,保持这些性质的稳定非常重要,因此有必要对合成的纳米粒子进行性质鉴定,常用鉴定技术如下。

图1 银离子溶液在微生物作用下形成纳米银后的颜色变化[29]Fig.1 Color change of silver ions solution during forming silver nanoparticles[29]
1.1 UV-可见光吸收光谱(UV-vis)
1.2 动态光散射(DLS)
也称光子相关光谱(Photon Correlation Spectroscopy,PCS),准弹性光散射quasi-elastic scattering,用于测量生成的纳米银溶胶中粒子直径和表面电荷。
1.3 电子显微镜
扫描电镜(SEM)和透射电镜(TEM)都可以对生成的纳米银粒子形态进行鉴定,其中扫描电镜可以用来观察纳米银粒子的表面特性,透射电镜则可以对生成的纳米银粒子的直径、形态进行观察(图2)。
1.4 X射线衍射(XRD)
X光能够透过纳米材料形成衍射图谱,该图谱与晶体结构密切相关,每种晶体所产生的衍射花样都反映出该晶体内部的原子分配规律,因此通过比较衍射图谱与X射线衍射技术可用于鉴别纳米银晶体结构的相位和性质。
1.5 傅氏转换红外线光谱(FTIR)
在微生物合成纳米粒子的过程中,纳米颗粒表面附着着许多有机功能基团(羰基、羟基等)和其他化学物质残留,利用红外线光谱经傅里叶变换进而分析杂质浓度的光谱分析,能够对纳米粒子形成过程中的表面化学特性转变进行分析。

图2 不同反应时间透射电镜下观察到的微生物法合成的纳米银粒子[30]Fig.2 TEM images of silver nanoparticles[30]a:4 min; b:6 min; c:8 min; d:10 min; e:12 min
2 合成纳米银粒子的微生物
Deepak等[31]指出,在微生物合成纳米银的过程中,银离子有着双重作用,一方面诱导纳米颗粒的形成,一方面则会引起微生物的死亡。此外,合成的银粒子还需要稳定剂使其保持纳米尺度,在物理方法和化学方法中,充当稳定剂的通常是聚丙烯酸、聚乙烯吡咯烷酮、明胶等高聚物或柠檬酸、柠檬酸钠等还原剂,而微生物法则需要自行产生稳定剂。综合以上两点,微生物法生产纳米银粒子对微生物材料本身有一定要求,在筛选中,菌株要兼顾还原性、银离子抗性和稳定性三方面,才能作为生产纳米粒子的较理想材料。微生物对银离子胁迫的耐受都是有限度的,所以微生物合成纳米粒子的过程中,银离子的浓度必须适中,以免对微生物产生毒害作用,影响合成效果和产量。
综合各类研究成果,能够合成纳米银粒子的微生物种类十分丰富,真菌和细菌都被报道具有合成纳米银粒子的能力。表1列出了一部分相关研究,包括合成纳米粒子的微生物分类地位,合成方式和纳米粒子的生物活性功能。其中,合成方式分为胞外和胞内两种,通常微生物只以其中一种方式产生纳米银粒子,但Choudhury等[32]在研究中发现黑曲霉(Aspergillusniger)能够以胞内和胞外两种途径合成纳米粒子,其SPR峰值分别为415 nm和435 nm,形状为球形,粒径在43~63 nm之间; Prakasham等[33]也发现一种海洋中分离出的链霉菌(Streptomycesalbidoflavus)同样具有两种合成途径,产物粒径平均为14.5 nm。以何种方式产生纳米银粒子与微生物细胞的还原组分所在位置息息相关。
令Θ为多边形,顶点表示为Q1,Q2,…,Qn。此外,引用|·|表示欧式距离,例如|AB|表示点A与点B间的欧式距离,||表示线的欧式长度。pΘ表示Θ的边。令A、B是Θ边上的点,而分别表示从A至B的逆时针、顺时针边。
2.1 纳米银粒子的胞内合成
胞内与胞外合成的纳米银粒子具有相似的特性,包括粒径、UV-VIS吸收峰值、X射线衍射图谱等,但胞内合成的纳米银粒子对细胞毒性更大,产量相对较低。Xue等[29]利用皮肤分节真菌以胞内途径合成了纳米银粒子,UV-VIS吸收峰值为420 nm,X射线衍射图谱符合银晶体,透射电镜下观察生成的银粒子,其平均直径为(15.5±2.5)nm,最佳反应条件为底物浓度1.5 mmol/L,55 ℃度反应10 h,其生成的纳米银粒子对念珠菌属(Candidaspp.)、曲霉属(Aspergillusspp.)、镰刀菌属(Fusariumspp.)等多种病原菌具有抑制作用,其中对念珠菌属的抑制作用最为明显。
Otari等[24]发现,红球菌(Rhodococcusspp.)能够通过胞内途径合成纳米银,通过UV-Vis、X射线衍射、能量色散谱、傅氏转换红外线光谱、透射电镜等技术手段分析,红球菌产生的纳米银粒径在5~50 nm之间,具有良好的稳定性,对革兰阳性和阴性细菌抑制作用明显。
纳米银粒子除了可以单独发挥抗菌活性,也可以与其他材料结合,例如二氧化硅和棉纤维。Velhal等[34]利用曲霉属真菌(A.sterrerus(Thom) MTCC632)经胞内途径合成出纳米粒子,检测了纳米粒子的形态特征,发现其UV曲线吸收峰值在290 nm左右,其粒径随着底物银离子浓度和反应温度的变化而发生改变,当底物浓度为6 mmol/L,温度为45 ℃时,能够生产出最小粒径(2 nm)的银粒子。FTIR结果显示,该种真菌胞内合成纳米银粒子可能有两种机制:第一,来源于杂环化合物的-C-O-C-、 -C-O-或者-C=C=官能团,或者来源于蛋白质的酰胺I键成为了纳米粒子的限制配体;第二,真菌细胞内部具有硝酸盐还原酶,还原了银离子,扫描电镜的观察结果显示,该实验生成的纳米银粒子是球形。在这次实验中,真菌生产的纳米银粒子被覆盖在棉纤维表面,作为一种合成材料进行抗菌活性的检验,结果表明革兰阳性细菌金黄色葡萄球菌(Staphylococcusaureus)和蜡样芽胞杆菌(Bacilluscereus)均得到有效抑制,且其对合成材料的敏感性更强于革兰阴性细菌绿脓杆菌(Pseudomonasaeruginosa)、大肠埃希菌(Escherichiacoli)和普通变形杆菌(Proteusvulgaris)。
随着时代的发展,纳米银粒子与医药材料的结合逐渐紧密。2009年Vijayakumar等[35]发现1株赭曲霉(Aspergillusochraceus)也具有胞内合成纳米银粒子的能力,鉴于这样生产的纳米粒子具有良好的抗菌活性,但很容易在清洗时脱离表面失去效果,研究者首先通过加热使其产生纳米粒子,然后包裹在高分子材料的碳骨架上,开发出一种合成材料,并检验了这种合成材料的抗菌活性。结果发现,无论是革兰阴性、阳性细菌还是病毒(M13噬菌体)的生长都受到了抑制,在进行清洗后,这种抗菌性依然存在,表明其结合十分稳定。2014年, Nayak等[36]重新检验了这株菌产生的纳米银粒子,证实其UV吸收峰在420 nm,粒径为30~40 nm,本身就具有良好的抗菌特性,并将赭曲霉产生的纳米银粒子与抗生素结合,使其对金黄色葡萄球菌的抗菌效果增强了3倍,对蜡样芽胞杆菌的抗菌效果增强了1倍。
2.2 纳米银粒子的胞外合成
Mohanpuria等[37]的研究发现,当微生物细胞壁上含有还原酶或能够分泌可溶性酶的时候,金属纳米粒子就会在胞外形成,由于纳米粒子对细胞具有一定毒性,在胞内大量积累会引起细胞死亡,降低生产效率,因此与胞内合成的纳米粒子相比,胞外合成更广泛地应用于生产领域,涵盖了光电、电子、生物成像、传感等技术。Absar等[38]经过一系列研究,发现了一批能够形成纳米粒子的放线菌,并且能够通过改变反应条件对纳米粒子的形态和粒径分布进行控制,不同形态和粒径的纳米银粒子其UV-VIS吸收峰值也有所不同,Subashini[39]使用土壤中分离出的链霉菌(Streptomycessp. VITBT7)合成的纳米银粒子形态为球形,粒径在20~70 nm之间,Costa Silva等[40]利用嗜线虫真菌(Duddingtoniaflagrans)合成的纳米银粒子呈现近似球形,通过改变反应条件,粒径从12~486 nm不等,UV-VIS吸收峰值在440 nm左右变化。
KAbdelrahim等[41]利用匍枝根霉(Rhizopusstolonifer)进行纳米银的胞外合成实验,通过UV-可见光吸收光谱、X射线衍射、透射电镜和傅氏转换红外线光谱检测,其产物的最大吸收峰在420 nm左右,粒子为面心立方体,X射线衍射图谱对应晶面指数为(111), (200)和(220),纳米银粒子呈单分散的球状,粒径在9.47 nm左右。FTIR结果显示,粒子外有蛋白质层包裹。在该实验中,通过控制反应条件能够控制纳米银产物的粒径,在40 ℃下采用0.01 mol/L AgNO3作为反应底物能够得到最小粒径(2.86±0.3)nm的银粒子。Verma等[42]也使用印度楝内分离出的内生曲霉属真菌(Aspergillusclavatus)通过胞外途径合成了纳米银粒子,粒径在10~25 nm之间,形状是多分散的球状。
近年来,研究人员越来越多地关注纳米银粒子所普遍具有的抗菌和细胞毒性。Kumar等[22]发现1株分离自印度农田的链霉菌(Streptomycessp. 09 PBT 005)具有胞外合成纳米银粒子的活性,经过鉴定,其UV-VIS吸收峰值为440 nm,最适反应时间为72 h,产生的纳米银粒径在198~595 nm之间,具有表面粗糙的球状结构。FTIR检测结果表明氨基酸中的羰基化合物和蛋白质中的肽链在结合金属离子中发挥了重要作用,推测在纳米银形成的过程中,菌液中的蛋白质组分覆盖住银粒子,达到了生物稳定剂的效果。琼脂扩散法检验表明,菌株09 PBT 005生成的纳米银粒子对革兰阴性和阳性细菌都具有良好的抑制作用,其中革兰阴性细菌Shigellaflexneri和Enterobacteraerogenes最为敏感。以0.02 mol/L AgNO3为底物合成的纳米银粒子抗菌活性最好,超过或低于这个浓度的AgNO3溶液都会造成抗菌活性下降。
Jo等[43]对假单胞菌PseudomonasdeceptionensisDC5的研究表明,这株菌也能够通过胞外途径生产纳米银,其UV-VIS吸收峰值为428 nm,反应时间在48 h以内,纳米银粒径为127 nm左右,其产物对副溶血弧菌(Vibrioparahaemolyticus)具有很高的抗菌活性,对白色念珠菌(Candidaalbicans)、金黄色葡萄球菌、肠球菌(Salmonellaenterica)和炭疽杆菌(Bacillusanthracis)也有较好的抑制作用。Sarsa等[44]发现青霉菌(PenicilliumatramentosumKM)经胞外合成途径形成的纳米银同样具有广谱抗菌活性,对金黄色葡萄球菌、蜡样芽胞杆菌和嗜水气单胞菌(Aeromonashydrophila)都具有良好的抗菌活性,值得注意的是,该研究所使用的青霉菌是迄今为止最适合作为工程菌改造的菌种,具有很大的生产潜力。
2017年, Costa Silva等[40]研究并发现了食线虫真菌Duddingtoniaflagrans的产纳米银特性,Duddingtoniaflagrans是捕食线虫性真菌的一个代表种类,强大的环境耐受力与捕食线虫能力使其在动物寄生性线虫防治方面具有不可比拟的优势,因此常常被应用于生物防治,是农业领域近年的热点之一。Costa Silva等经过实验证明,Duddingtoniaflagrans能够通过胞外途径产生纳米银,根据菌液和AgNO3比例的不同,其UV-VIS吸收峰值在410 nm左右,粒径在12~486 nm之间,可以通过控制反应条件来控制产物质量。FTIR检测结合拉曼光谱的检测表明,跟还原银离子和保持纳米银稳定有关的物质可能是几丁质,此外,以稳定性和单分散性来说,菌液和AgNO3最理想的比例应该是1∶50。
虽然纳米银产物的UV-VIS吸收峰通常被认为在400~450 nm之间,但有时因为微生物分泌的特殊物质,其产生的纳米银也会形成特殊的Ag/AgCl复合体, Rasulova等[45]用1株产胞外多糖的圆褐固氮菌(AzotobacterchroococcumXU1)合成的Ag/AgCl复合粒子的UV-VIS吸收峰值从260~420 nm不等,在胞外多糖和纳米复合体的共同作用下,其产物表现出了对植物病毒尖孢镰刀菌(Fusariumoxysporumf.sp.vasinfectum)和黄萎病菌(Verticilliumdahliae)有较强的抑制作用。这也给微生物合成纳米银的应用提供了崭新的思路。
以上研究中,虽然发现了多种多样具有产纳米银粒子活性的微生物,但无论以何种途径合成,其效率普遍较低,从开始反应到产生稳定的纳米银粒子需要几小时到几十小时不等的时间,这成为了微生物法合成纳米银投入生产的一大技术难题。本课题组的前期研究中,Manikprabhu等[46]利用光照辐射一株放线菌(SinomonasmesophilaMPKL 26),使纳米银的合成过程不超过20 min,Dong等[30]使用相同方法用另一株放线菌(Isoptericolasp.)合成纳米银粒子,整个反应过程只需4 min。上述两个研究中生产的纳米银粒子从吸收峰值、粒径、表面性质、稳定性和抗菌活性方面都与其他方法得到的产物没有明显差别。相比较传统方法平均需要12~16 h完成生产,阳光辐射显然能够极大缩短反应时间(见图2),提高生产效率。
3 纳米银粒子的应用
纳米银的合成受到瞩目,是由于其应用越来越广泛,相比传统材料优势非常明显。迄今为止,纳米银的应用价值主要表现在以下几个方面。
3.1 催化特性
尽管纳米银粒子最常见的应用是医药和抗菌领域,但近年来,其催化特性也逐渐引起了研究者的关注。许多报道表明,纳米银粒子可以催化染料、苯、一氧化碳等化合物的氧化还原反应[47]。
3.1.1 二氧化硅表面材料——染料还原 主要利用的是在二氧化硅表面合成的纳米粒子。二氧化硅起到的作用是稳定纳米粒子结构,使纳米粒子成为良好的电子传递者,在这种合成材料的催化下,氰硼化钠能够与众多染料——包括亚甲基蓝、曙红和孟加拉红发生反应[47]。
3.1.2 中介气凝胶——苯的选择性氧化 由于纳米粒子具有数量极多的活性位点,它们可以被应用于中介气凝胶[48]。研究表明,气凝胶中低质量百分比(1%)的银粒子具有很高的选择氧化性,能够把苯氧化成苯酚,其效果来自这些银粒子极高的单分散性[48]。
3.1.3 金银合金纳米粒子——一氧化碳的协同氧化 纳米金和纳米银粒子在单独氧化一氧化碳时,其活性都不高,但同时使用两种纳米粒子,催化活性就会大大增加。在这个过程中,纳米金能够结合氧原子,使纳米银发挥其氧化催化性。当金/银比例在3∶1~10∶1之间时,能够在室温下完全催化1%的一氧化碳,且纳米颗粒的尺度对催化效果影响不大[49]。
3.1.4 光催化 电浆效应是一种被广泛研究的效应,但迄今为止,对纳米材料通过表面电浆共振而氧化催化作用增强的现象仍缺乏认识。研究表明,纳米银粒子表现出耦合低强度持续光和热能的能力,未来纳米银粒子在光催化方面重要的应用可能是通过可见光产生共鸣等离子体[50]。
3.2 生物学特性
研究者们已经开发出了以纳米银粒子为载体,将细小药物颗粒或者大生物分子转运至特定靶点的技术。只要纳米银粒子有足够充裕的时间到达靶点位置,运送的药物就能够被细胞内外的刺激因子激活,这种基于纳米银粒子的载体技术能够特异性地在目标位置积累药物,使其产生的副作用最小化[51]。
3.2.1 化学疗法载体 纳米技术最有希望引入医药领域的是改善癌症成像技术和治疗药物的设计标准[52],在纳米尺度上揭示生物系统的组织、形态和功能,用包埋技术结合纳米银粒子和靶向药物治疗癌症是未来纳米粒子在医药领域的重要研究方向[53]。通过镀膜技术,纳米银粒子能够呈现出一种标准的功能化表面,这种表面可以添加各种基质。例如,用二氧化硅镀膜的纳米银粒子,可以通过稳定的醚键和酯键连接基质,避免了基质被自然代谢的酶分解[54-55]。最新的化疗技术利用光敏链(邻硝基苯桥)将抗癌物质连接到了纳米粒子表面的基质上[56]。低毒的纳米粒子复合物能够在新陈代谢中保持活性,这样就有足够的时间让药物扩散至肿瘤位置。肿瘤被标记后,使用穿透皮肤组织的紫外线使光敏链断裂,释放出药物。相比已有的化学疗法,这种利用纳米银粒子的靶向技术有三个优点,第一,避免使用高毒性的化合物作为载体运送药物;第二,无需使用有害辐射使药物释出;第三,不依赖特定的化学反应,就能够使药物有选择性地在目标组织中释放。
另外一种方法是把化疗药物直接连接到纳米银粒子外覆盖的功能化表面上[57-58]。例如,当纳米粒子-药物复合物进入或接近肿瘤细胞时,一种谷胱甘肽单酯就能够发挥作用,其中的氧能够附着在纳米粒子的功能表面,形成一条新的酯链,与此同时向周围释放出药物,通过这种手段,药物就能够在肿瘤位置被激活并发挥生物功能,而对相邻的组织没有过多损害。
3.2.2 应对多重抗药性 在癌症的化疗过程中,癌细胞常常产生多重抗药性,其机制十分复杂。针对多重抗药性中过表达的转运蛋白,可以设计出特异性的纳米粒子作为转运载体,是未来解决多重抗药性的一种方法[59]。纳米粒子可以通过其表面蛋白质的过表达设计成特异性的药物载体[60],但普通纳米药物的缺点就在于,在细胞内部释放的药物重新暴露于多重耐药性转运蛋白中,然后又被排出了。为了解决这个难题,Liu等[61]使用HIV-1病毒的转录活化因子作为细胞穿透肽处理粒径8 nm的纳米银晶体。一般来说,纳米银的效果会受到细胞摄入能力的限制,然而,细胞穿透肽处理能够增加纳米粒子的细胞转运能力,一旦摄入后,由于分子筛作用,纳米银粒子也不会再被排出,因为其体积已经超过了多重耐药性转运蛋白,因此就能够在肿瘤细胞中聚集,使药物积累到有效浓度。
3.2.3 抗菌活性 银会使细菌细胞产生高度的形态和结构改变而导致细胞死亡。纳米银会附着在细菌细胞壁和含硫元素的细胞膜上[62],一旦与膜结构结合,在膜上的纳米银形成的银-硫相互作用会使膜的半透性发生改变,细胞内容物因为渗透压而流出[63]。一部分的纳米银粒子会进入到细菌内部,与DNA和RNA等含磷结构产生作用,使DNA浓缩,抑制细菌繁殖[63],而且溶液中的纳米银粒子会释出微量的银离子,抑制细菌中酶的活性和产ATP相关蛋白质的表达[64],由于其卓越的抗菌活性,纳米银被广泛应用于医疗器械和耗材中。纳米银具有广谱抗菌性,一般来说,无论是什么类型的细菌,无论细胞膜是什么结构,平均粒径在10 nm以下的纳米银粒子都能表现出电子效应,极大地抑制细菌生长,这可能是得益于比表面积的增加[65]。另外,研究认为纳米粒子可以与传统抗生素产生协同作用,例如青霉素、氨比西林、红霉素、克林霉素和万古霉素[66]。纳米银粒子能够阻止细菌生长或附着,因此被广泛应用于外科手术中,因为所有与患者接触的仪器都要求无菌,且它能够应用于多种材料,如金属、塑料和玻璃[67]。在医药设备中,纳米银消毒比传统方法处理的杀菌作用更好,但由于在清洗过程中银离子大量流失,纳米银很容易失去效果。纳米银粒子更广泛的应用是治疗烧伤的植皮手术,在植皮创面上的纳米银能够提供更高的抗菌活性,减轻疤痕产生的程度,这是沿袭银离子处理溃疡的古老方法的一种创新。现在,纳米银被广泛应用于绷带和药物贴片来加快创伤痊愈[68]。纳米银在饮用水净化领域也展现出了一定潜力[69],利用了碳酸盐,能够使微生物对纳米银更敏感,除去毒性巨大的杀虫剂残留。纳米银还可以与特定的离子结合,如铁、铅、砷,且完成净水作用不需要再消耗电力或水力。Barker等[70]研究了低浓度纳米银粒子的作用,结果表明只要时间足够,这些纳米银依然能够在水体中发挥长期效应。
4 展 望
在过去的十年中,微生物法纳米银的方法、验证和应用都得到了长足进展,但还需要完成很多工作(图3)。首先,微生物法合成纳米银的过程耗时太长(几小时到几十小时不等),相比较传统物理和化学方法来说效率较低,如果能减少反应时间则可以大大增加合成效率,本课题组已有利用光照缩短反应时间的成功案例[30];其次,银粒子的尺度和单分散性是最重要的特性,虽然现有手段已经能够通过控制底物浓度、温度、pH值等反应条件达到对粒径和形状的一定控制效果,但仍不能做到十分精确;第三,一些研究表明,经过较长时间后,已经形成的纳米银粒子会被再次分解,因此,微生物法合成的纳米粒子的稳定性和其稳定剂来源都需要进一步的分析。
由于胞内合成的纳米银粒子还需要使用超声或化学反应才能使其释出,因此胞外途径相比之下是更好的选择。尽管人们已经发现了许多种胞外合成纳米银的微生物,但迄今为止所有研究都仅限于实验室范围,如何利用这些微生物,将它们产生纳米银的功能真正应用于生产实践,将是一个重要的挑战。
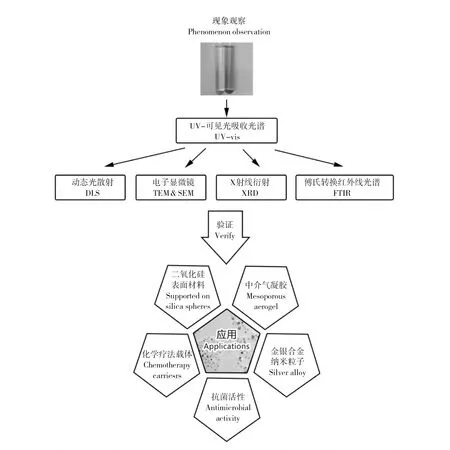
图3 纳米银粒子的特性验证和应用Fig.3 Characterization and application of silver nanoparticles
如果能够克服所有困难,鉴于其环保的特性和温和的反应条件,微生物法应该是纳米银合成方法中的首选项。除此之外,现有结果中对微生物产纳米粒子机制的研究仍不够透彻,这应该是深入了解微生物与银离子互作的当务之急,一旦揭示了其中的规律,微生物法产纳米银粒子的应用必将得到巨大推进,甚至能够影响纳米技术的更新换代。
尽管纳米银粒子被应用最多的领域是抗菌,但其应用仍不够充分,原因在于纳米粒子具有极为丰富的多样性,尤其是微生物法产生的纳米银,其形状和粒径各不相同,即使是同一种微生物,改变反应条件也会影响其产物的特性。除此之外,纳米银粒子与其他材料如二氧化硅和高分子聚合物的复合材料也有待进一步研究。
随着科技和社会进步,人们对产业技术绿色化的要求越来越高,纳米银作为一种毒副作用极低、应用范围不断扩大的优良材料,其物理和化学生产过程却往往伴随着剧毒原料和环境污染,因此,微生物法生产纳米银作为一种反应条件温和,无污染、绿色环保的方法逐渐进入人们的视线。在过去的十年里,许多不同种类的微生物被发现能够生产纳米银,经过一系列技术手段检测,每种微生物所产生的纳米银都不尽相同,改变反应条件能够在一定程度上控制产物的特性。一系列抗菌实验表明,这些纳米银粒子普遍具有广谱抗菌活性。近年来,纳米银的应用越来越广泛,在催化、医药、灭菌等领域发挥着重要作用,微生物法合成的纳米银也开始与传统技术和药物结合,随着人们研究的深入,必将发挥更广泛的作用。
