肺淋巴管肌瘤病1例并文献复习*
2019-09-14涂玉凤李丽娜
涂玉凤,李丽娜
(广州中医药大学第一临床医学院,广东 广州 510405)
肺淋巴管肌瘤病( pulmonary lymphangioleiomyomatosis,PLAM )是一种以弥漫性肺间质病变为主要临床特征的肺部罕见病,分为散发性淋巴管肌瘤病(sporadic LAM,S-LAM) 和遗传型结节性硬化症相关肺淋巴管肌瘤病(tuberous sclerosis complex associated lymphangioleiomyomatosis,TSC-LAM)[1]。成年女性TSC患者患LAM比例约为30%~40%[2]。近年来,肺淋巴管肌瘤病的个案报道不断涌现,但PLAM症状多样,临床表现缺乏特异性,导致该病误诊、漏诊现象较普遍。现将我院收治的1例肺淋巴管平滑肌瘤病报道如下,并通过相关文献复习,探讨其发病情况、临床表现、影像学特征及病理特点、诊断治疗及预后。
1 临床资料
患者女性,21岁,因“右侧胸闷痛1周”于2017年9月5日入院。患者于1周前无明显诱因出现右侧胸闷痛,曾至某三甲医院就诊,行胸部DR示:右侧气胸(50%~60%),予行右侧胸腔闭式引流术1周后,胸腔引流管内仍有气泡溢出,进一步行胸部CT(图1):(1)双肺间质纤维化改变,考虑淋巴管肌瘤病,胸骨及多个椎体及附件骨质硬化,结合患者既往有视网膜胶质瘤、肾血管平滑肌脂肪瘤(renal angiomyolipomas,AML)病史,考虑结节性硬化综合征;(2)右侧气胸,肺组织压缩约40%;(3)右肺下叶含气不全。为行进一步治疗入住我院。患者既往曾于2009年在外院行视网膜胶质瘤手术。2015年在外院行右肾血管平滑肌脂肪瘤手术。否认其他慢性病史,否认传染病史、过敏史、家族遗传性疾病史。体格检查:体温:36.3 ℃,呼吸:22次/分,脉搏:86次/分,血压:125/80 mmHg。患者神清,全身浅表淋巴结无肿大。额面部及口鼻三角区可见红褐色多发斑丘疹。右上肺触觉语颤减弱,叩诊鼓音,呼吸音减弱,双下肺闻及细湿性啰音。心率:86次/分,心律齐,各瓣膜听诊区未闻及病理性杂音,腹平软,无明显压痛反跳痛,肝、脾肋下未触及,肾区叩击痛(-)。四肢肌力、肌张力正常,生理反射存在,病理反射未引出。入院辅助检查:自免五项:补体C3 1.65 g·L-1,风湿三项:C反应蛋白:15.6 mg·L-1;血常规、肝肾功能、电解质、心肌酶谱、肌钙蛋白均未见异常。2017年9月8日查胸片示:符合右侧液气胸引流术后,现右肺压缩约15%,少量积液,右下肺炎症。患者于9月11日在全麻下行胸腔镜右侧肺大疱楔形切除术+胸膜固定术,术后复查胸片对比前片(2017-9-8):右肺较前复张,右侧胸腔积液基本吸收,考虑右下肺炎症较前进展,左侧气胸,左肺压缩约70%。9月12日行左胸腔闭式引流术,术后复查胸片(图2):符合双侧液气胸引流术后,现右侧少许气胸,肺组织压缩约10%,左肺组织已复张;右下肺炎症较前稍进展。术后病理回复:右肺淋巴管肌瘤病。免疫组织化学(图3):肺组织内见多个小囊肿组成,梭形细胞增生分布于囊肿的边缘,或沿着血管、淋巴管和细支气管分布;瘤细胞胞浆红染,核圆形或椭圆形,未见明显异型性。IHC结果(1号片):SMA(+++)、D2-40(-)、HMB45(++)、Desmin(+++)、Ki-67(<2%+),PR(+)。符合(右肺)淋巴管肌瘤病。确诊后患者拒绝使用雷帕霉素治疗,予以对症处理,患者症状缓解后出院。

注:A:双肺间质纤维变;B:双肺对称散在囊腔;C:右侧气胸;D:右肺下叶炎症。
图1胸部CT图
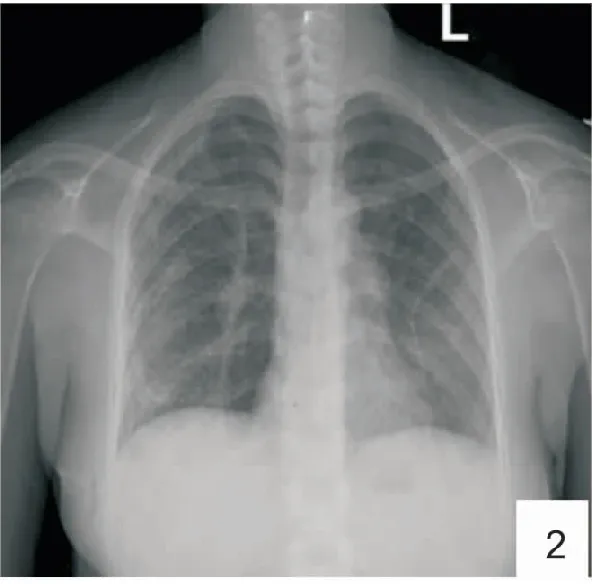
图2 胸片示右侧少许气胸,肺组织压缩约10%
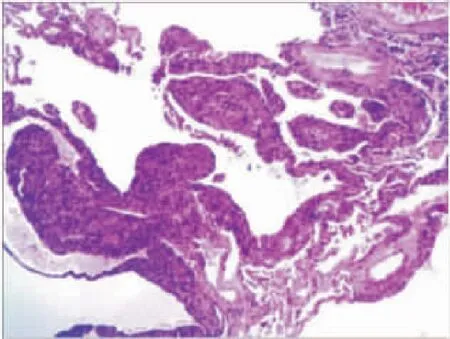
图3 肺活检显示肺组织内见多个小囊肿组成,梭形细胞
2 讨 论
PLAM是一种肺部罕见病,有孤儿肺病之称,其发病机制目前尚未十分明确。PLAM以弥漫性肺间质病变为主要临床特征,好发于育龄期女性,妊娠、月经期、使用雌激素或避孕药可使病情加重,其中妊娠期女性PLAM发病率比健康人群高11倍[3]。大量基础研究表明,PLAM具有明显的性别特征,在PLAM患者组织中雌激素、孕激素受体阳性,由此推测PLAM与女性性激素相关[4]。但当患者接受抗雌激素治疗后,疗效并不确切,Oprescu等[5]报道激素疗法会增加死亡或肺移植风险,由此推断可能存在其他方面的防病机制。有研究认为该病与结节性硬化症相关[6],分子生物学研究表明:PLAM与结节性硬化症(tuberous sclerosis complex,TSC) TSC2基因杂合体缺失(loss of heterozygosity,LOH) 及突变密切相关[7]。TSC2定位于染色体16p13区域,TSC2基因杂合体缺失影响基因的翻译与表达,引起哺乳类雷帕霉素蛋白激酶(mTOR)持续活化,导致平滑肌细胞的异常增殖[8-9]。因此目前有学者认为TSC2 LOH可能是导致PLAM发生的遗传基础。
PLAM的早期诊断十分困难,误诊率高。大部分PLAM患者早期没有症状,大约5%~10%女性PLAM患者主要以进行性加重的呼吸困难、胸痛、反复发作性气胸、乳糜胸为临床表现[10],严重者进展为呼吸衰竭。少数PLAM患者以肺外表现最先出现,如胸腹腔多发淋巴结肿大、腹膜后或盆腔肿物和肾脏血管平滑肌脂肪瘤等。刘杰等[6]回顾了30例肺淋巴管肌瘤病例,结果表明与S-LAM 组相比,TSC-LAM组常伴家族史,具有典型TSC皮肤损害,累及中枢神经系统,双侧多发AML,且瘤径较大,易致大出血,呼吸系统症状则无明显差异。本例患者以胸闷痛症状为主要临床表现并伴有TSC皮肤损害,且出现AML并累及中枢神经系统。这给我们的提醒是,对于育龄期女性,尤其是TSC患者,应完善胸部CT进行PLAM 的筛查并密切随访。
影像学对于PLAM尤其是TSC-LAM的诊断及预后具有重要意义。早期影像学无明显改变,当HRCT(高分辨率CT)出现特征性改变有助于该病诊断。同时根据CT提示肺内病灶囊腔大小、数量多少可判断病情的进展及严重程度,有助于评估治疗效果及判断其预后[11]。PLAM的CT改变为全肺弥漫分布的囊腔,大小不一,均匀分布,囊腔呈类圆形,囊壁较薄且完整,厚度<2 mm[12],随着病情进展,可形成肺大疱,发生气胸。病理结果可帮助诊断PLAM。其病理表现为肺间质中梭形或上皮样平滑肌细胞异常增生,并围绕淋巴管、小血管、小气道压迫管腔结构,引起管腔狭窄和闭塞[13]。HMB45、α2 平滑肌肌动蛋白、结合蛋白及弹性蛋白等免疫组织化学及雌激素受体、孕激素受体监测可协助诊断[14]。本例患者病理可见梭形细胞增生,并沿着血管、淋巴管和细支气管分布,HMB45(++),符合PLAM病理改变。
本病目前尚无明确的特效治疗方法,一旦明确PLAM诊断,需立即停用避孕药,妊娠患者妊娠风险极高,及时处理咯血、气胸、乳糜胸等并发症。目前关于药物治疗方面,西罗莫司做为雷帕霉素蛋白激酶特异性抑制剂,已被证实能够稳定PLAM患者肺功能[9,15],2015年5月,美国FDA批准西罗莫司用于治疗PLAM。Faehling等报道过一例PLAM妊娠患者孕期服用西罗莫司产下一名健康女婴。但目前尚无大样本的西罗莫司治疗妊娠期妇女的临床试验[16],雷帕霉素对孕妇的安全性仍需大样本临床试验进一步明确。对于晚期PLAM患者,肺移植是唯一有效的治疗方法,3年生存率超过80%[17],但部分患者仍易复发。
根据WHO肺部肿瘤分型,LAM定义为低度恶性、侵袭性、转移性肿瘤,目前TSC-LAM病因未明,起病缓慢。早期PLAM患者缺乏典型的临床表现及特征性影像学表现,其首诊误诊率可达100%[18],目前尚无特效治疗方法,其预后较差,患者出现呼吸困难等症状后多于10年内死于呼吸衰竭。因此育龄期妇女一旦出现不明原因的呼吸困难、胸痛等症状,尤其是TSC患者,一定要注意完善胸部CT,防止对PLAM的误诊、漏诊。
