大黄素对脂多糖诱导损伤胰岛INS-1细胞TLR4、HO-1蛋白表达的影响
2019-09-13梁珊珊刘铭珍赖思羽张小琴
梁珊珊 ,刘铭珍 ,赖思羽 ,向 青 ,张小琴
(1.福建中医药大学药学院,福建 福州 350122;2.福建中医药大学康复技术工程研究中心,福建 福州 350122)
研究发现胰岛B细胞分泌功能缺陷和胰岛素抵抗是2型糖尿病的核心机制[1]。其中胰岛素抵抗就是一种低度的炎症状态,而炎症又会导致胰岛B细胞功能逐渐衰竭[2-3]。已有研究表明Toll样受体4(TLR4)可诱导参与炎症反应的多种基因表达,血红素氧合酶-1(HO-1)具有明显的抗炎、抗氧化、抗凋亡的作用[4-5]。
大黄素(emodin)是蓼科植物大黄的主要有效成分,具有抗肿瘤、抗菌消炎、抑制细胞增殖、提高免疫等多种药理作用[6]。课题组前期研究发现:大黄素能显著降低糖尿病大鼠空腹血糖和空腹胰岛素等,显示出能够增强胰岛素敏感性的作用[7]。本研究旨在观察大黄素对脂多糖(LPS)诱导的胰岛INS-1 细胞模型中白介素-6(IL-6)、TLR4、HO-1 的影响,探讨大黄素对LPS诱导的胰岛INS-1细胞炎症反应的调节及作用机制。
1 实验材料
1.1 实验细胞 胰岛B细胞株INS-1购于中国医学科学院细胞库。
1.2 药品与试剂 大黄素(大连美仑生物有限公司,批号:J0616A,纯度>97%);RPMI 1640培养基、胎牛血清、磷酸盐缓冲液(美国Gibco公司);LPS(美国Sigma公司);IL-6 ELISA试剂盒(武汉博士德生物工程有限公司);RIPA裂解液、PMSF、5X蛋白上样缓冲液(上海碧云天生物技术有限公司);TLR4抗体(美国Santa Cruz公司);HO-1抗体(英国 Abcam公司);β-actin抗体(北京全式金生物技术有限公司)。
1.3 仪器 CO2培养箱(美国Thermo公司);倒置显微镜(德国Leica公司);台式冷冻离心机(美国Thermo公司);Infinite M200 Pro多功能酶标仪(瑞士TECAN公司);Mini PROTEAN Tetra小型垂直电泳槽、转印槽、ChemiDoc XRS+凝胶成像分析系统(美国Bio-Rad公司)。
2 实验方法
2.1 细胞培养 胰岛INS-1细胞培养于含10%FBS、100 U/mL 青霉素、100 μg/mL 链霉素及 50 μmol/L巯基乙醇的RPMI1640完全培养基中,置于37℃、5%CO2培养箱中培养,每隔2~3 d传代。
2.2 模型建立及药物处理 取对数生长期的INS-1细胞以3×105细胞/孔接种于6孔板,正常培养24 h后分为空白组、模型组及大黄素组。空白组不做任何处理,模型组以20 mg/L LPS作用于INS-1细胞,大黄素组以 20 mg/L LPS+0.1 μmol/L 大黄素作用于INS-1细胞。药物刺激12 h后,倒置显微镜下观察各组细胞形态差异,收集上清用于IL-6检测,收集细胞用于Western blot检测。
2.3 ELISA法检测IL-6表达水平 取出-80℃保存的细胞上清,按照试剂盒说明书步骤检测IL-6含量。以100 μL/孔加入酶标板,37℃下孵育1.5 h;取出拍干,加入稀释后的抗体工作液100 μL/孔,37℃下孵育1 h;拍干,加入经稀释的洗液300 μL/孔,浸泡 1 min后拍干,重复 3次;以 100 μL/孔加入已稀释并经37℃平衡30 min的ABC工作液,37℃下作用30 min;取出重复上述洗液步骤5次,加入平衡30 min的TMB显色液90 μL/孔,37℃反应15~20 min,最后加入TMB终止液,用酶标仪于波长450 nm处检测A值,根据标准曲线计算出含量。
2.4 Western blot法检测TLR4、HO-1蛋白表达将去除培养基后收集的细胞培养板,加入细胞裂解液(含PMSF),提取细胞总蛋白,采用BCA法测定细胞蛋白浓度,与蛋白上样缓冲液(5×)4∶1混合,100℃变性 10 min;取 30 μg蛋白样品上样,SDSPAGE凝胶电泳,转至PVDF膜,脱脂奶粉封闭2 h,一抗 TLR4(1∶500)、HO-1(1∶250) 4 ℃孵育过夜,TBST 洗涤 3 次,每次 10 min;二抗(1∶3 000)室温孵育1.5 h,TBST洗涤3次,每次10 min。采用ECL发光试剂显色,并经ImageJ凝胶成像系统进行显影检测,分析目标条带TLR4、HO-1及内参β-actin的灰度值,计算出目标蛋白与内参的比值,对组间差异进行统计学分析。
2.5 统计学方法 采用SPSS 20.0软件进行统计学分析。计量资料属正态分布的以()表示,采用单因素方差分析(one-way ANOVA),多组间的两两比较,方差齐时用LSD-t方法,不齐时用 Games-Howell方法;计数资料采用χ2检验。
3 实验结果
3.1 大黄素对INS-1细胞形态的影响 见图1。

图1 大黄素对3组INS-1细胞形态的影响(×100)
3.2 大黄素对3组INS-1细胞IL-6的影响 见图2。
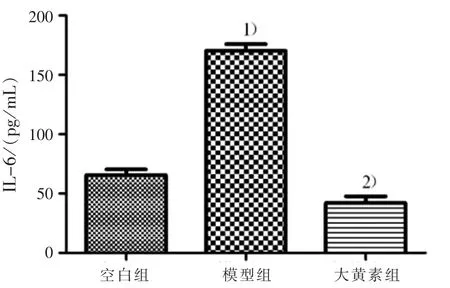
图2 大黄素对INS-1细胞IL-6的影响
3.3 大黄素对 3组INS-1细胞蛋白 TLR4、HO-1表达的影响 见图3。
4 讨 论
糖尿病是一种以高血糖为特征的代谢疾病,其中胰岛B细胞功能低下导致的糖尿病为2型糖尿病。引起血糖升高的病理机制主要是渐进性胰岛B细胞的功能衰竭和胰岛素抵抗。越来越多的研究表明,在2型糖尿病患者胰岛也出现以巨噬细胞浸润增加为主要特征的炎症反应,导致胰岛B细胞功能缺陷[8-10]。众多的细胞因子和趋化因子参与了2型糖尿病胰岛炎症反应的过程。HO-1是血红素降解的起始酶和限速酶,具有强大的抗炎及调节免疫作用。TLR4识别功能可激活NF-κB,进而导致一系列炎症细胞因子的合成与释放,诱发炎症反应[11]。
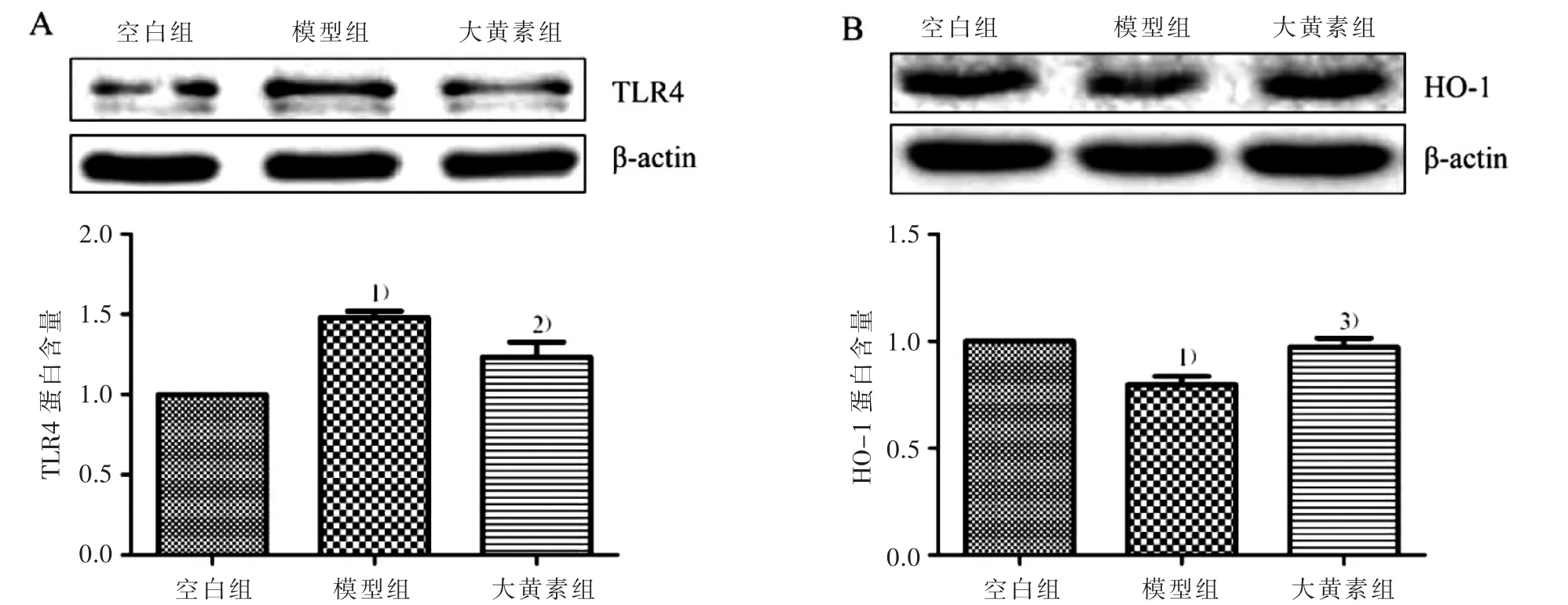
图3 大黄素对3组INS-1细胞TLR4、HO-1蛋白表达的影响
大量研究显示:大黄素能够抑制炎症,提高胰岛素敏感性,增加外周葡萄糖摄取。离体实验证实:大黄素能够通过激活PI3K/PKB信号途径,减少NF-κB p50亚基向细胞核转移,从而抑制LPS诱导的3T3-L1 脂肪细胞的炎症反应[12];通过抑制 NF-κB活性和MAPK通路,抑制经佛波醇和钙离子通道剂A23187 刺激的肥大细胞分泌 TNF-α 和 IL-6[13]。
本实验结果显示:经LPS刺激的INS-1细胞,IL-6的释放量显著增加,TLR4蛋白水平升高,HO-1蛋白表达下降;而大黄素能显著降低IL-6的释放,抑制TLR4水平的升高以及HO-1水平的下降。说明大黄素能减轻LPS诱导的INS-1细胞的炎症损伤,其机制可能与调控IL-6水平及TLR4和HO-1的蛋白表达有关。
