体外受精-胚胎移植术对子代肠系膜血管功能的影响
2019-09-13孙婧文朱嵩岳吴晨婷茅彩萍
孙婧文,朱嵩岳,尹 娜,伯 乐,吴晨婷,茅彩萍
(苏州大学附属第一医院生殖医学中心,江苏 苏州 215006)
全球约8%~12%的育龄夫妇患有不孕不育症[1],体外受精-胚胎移植术(invitrofertilization & embryo transfer,IVF-ET)为不孕不育患者带来了生育的希望。过去40年,通过辅助生殖技术诊治不孕不育的人数逐年增加,全球已有超过800万的试管婴儿诞生[2]。尽管辅助生殖技术已成功解决了不孕症患者的生育需求,但近年来,IVF-ET子代的近期和远期健康风险引起了生殖医学界的关注[3]。因为IVF-ET是一种非自然的受孕过程,随着IVF-ET子代年龄的增长,许多成年发病的疾病开始显现[4]。
世界卫生组织(WHO)2016年报告的数据显示:心血管疾病发病率高,也是全球最常见的死因,每年约可导致1 790万人死亡,占全球总死亡人数的31%[5]。已有研究表明,IVF-ET子代存在内分泌代谢紊乱、血管功能障碍等问题[3]。IVF-ET子代血压轻微升高,但在统计学上表现明显[3]。外周血管阻力在维持血压方面也起着重要作用,但IVF-ET中年子代外周血管功能情况的数据鲜见报道。基于这一现状,本研究拟通过建立IVF-ET子代小鼠模型,探讨IVF-ET在诊治不孕不育中对其子代血管功能的影响,该研究结果为IVF-ET子代血管相关的易感疾病的预防和早期干预提供重要的实验理论信息。
1 材料与方法
1.1 实验动物♂和♀野生型C57BL/6和ICR小鼠,8周龄,购自昭衍(苏州)新药研究中心有限公司,许可证号:SYXK(苏)2017-0003。在实验前,对所有小鼠进行2周的适应性喂养。整个实验期间喂食标准颗粒饲料,自由饮水,每日于7 ∶00~19 ∶00用灯光照明。所有动物实验方案均按照中国苏州大学第一附属医院的伦理委员会规定进行。
1.2 药物与试剂孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)和人绒毛膜促性腺激素(human chorionic gonadotropin,hCG),购自宁波第二制药厂;精子获能液(Toyoda, Yokoyama, Hoshi medium,TYH)、人输卵管液(human tube fluid,HTF)、CZB培养液(Chatot CL,Ziomek CA,Bavister BD medium,CZB)、KSOM培养液(potassium simplex optimization medium,KSOM)和M2培养液(M2 mouse embryo medium,M2),购自南京爱贝生物科技有限公司;矿物油,购自瑞典Vitrolife公司;ELISA试剂盒,购自Sino-UK;抗β-actin、Calm2、Itpr1抗体,购自Abcam公司。
1.3 仪器常温高速离心机(德国Eppendorf公司);ABI7500实时荧光定量PCR仪(Thermo Fisher公司);自动凝胶图像分析仪(上海培清科技有限公司)。
1.4 体外受精和胚胎培养选取10~12周龄♀ C57BL/6小鼠,通过腹腔注射5 IU(0.1 mL)PMSG刺激排卵。48 h后腹腔注射5 IU(0.1 mL)hCG。取12~14周龄的C57BL/6 ♂小鼠附睾尾内的精子,置TYH培养液中,并在37 ℃、6% CO2的湿润空气中获能50 min。在注射hCG 14 h后,从输卵管中取出卵丘-卵母细胞复合物放入HTF培养液中。随后取约106个已获能精子加入HTF培养液中,在37 ℃和6% CO2环境下受精6 h。将KSOM和CZB培养液置于37 ℃、6% CO2环境中预平衡,所述培养液均用矿物油覆盖。随后,将受精卵转移到25 μL的KSOM培养液中培养,胚胎4细胞时转移进CZB培养液中继续培养至囊胚阶段。最后将成熟囊胚移植到假孕的♀小鼠宫内。
1.5 胚胎移植在胚胎移植前2.5 d,将至少8周龄的ICR ♀小鼠与输精管结扎的♂小鼠合笼。交配后次日早晨检查♀小鼠是否形成阴道栓。在胚胎移植之前,用三溴乙醇(240 mg·kg-1,腹腔注射)麻醉假孕♀小鼠,并且在每侧子宫中植入5~7个胚胎,分娩产出的小鼠为实验组。经自然交配出生的子代小鼠为对照组。妊娠期及哺乳期所有母鼠均给予标准鼠粮和水。子代小鼠于4周龄时♀♂分笼。待实验组和对照组子代生长至中年(20~22周时),取♂用于实验。所有子代均来自不同母鼠,n代表小鼠数量。所有实验至少重复3次。
1.6 心血管功能相关的细胞因子检测腹主动脉取血样,4 000 r·min-1离心10 min,取上清液,采用ELISA法,NO浓度测定采用比色法,并按照制造商的流程及说明书进行实验。检测血清血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)、一氧化氮(nitric oxide,NO)、内皮素-1(endothelin-1,ET-1)和前列腺素E2(prostaglandin,PGE2)浓度。
1.7 实时定量PCR(qPCR检测按照RNeasy Mini Kit(德国Qiagen)说明书的步骤,提取实验组和对照组的子代小鼠肠系膜血管组织总RNA。用PrimeScriptTMRT试剂盒(TaKaRa公司)将总RNA合成cDNA[6]。使用TB GreenTMPremix Ex TaqTM(Tli RNase H Plus)(TaKaRa公司)和mRNA引物(南京锐真生物有限公司)通过qPCR检测Itpr1、Calm2、RyR2、RyR3及β-actin的mRNA的水平。反应体系如下:95 ℃ 30 s,然后进行40个循环的95 ℃ 5 s和60 ℃ 34 s。引物序列见Tab 1。采用2-△△Ct法计算目的基因的相对表达量,用于mRNA表达分析的生物学重复数不小于3。

Tab 1 Primer sequences
1.8 蛋白提取和蛋白表达检测采用Western blot法检测来自肠系膜血管组织中Calm2和Itpr1的蛋白表达。取肠系膜动脉血管组织液氮中研磨,与裂解液充分混匀,置于冰上静置15 min,随后放入4 ℃离心机中,12 000 r·min-1离心30 min,所获蛋白经SDS-PAGE电泳,PVDF转膜,加封闭液于室温封闭2 h后,按抗体说明书比例加入稀释的一抗,4 ℃过夜。洗膜后加入稀释二抗,室温孵育1~2 h后,用TBST充分漂洗,而后行曝光等处理,并以β-actin为内参照,采用Image J软件对灰度值进行分析。每组标本重复检测3次,取平均值。
2 结果
2.1 IVF-ET对胚胎发育和产仔数的影响实验组的细胞率为(79.70±10.58)%,囊胚形成率为(80.25±12.67)%,实验组母鼠的产仔数为(3.14± 1.21),明显低于对照组(5.66± 0.78)(P<0.01),差异有统计学意义。
2.2 IVF-ET对子代小鼠体长、体质量和BMI的影响如Fig 1所示,实验组小鼠体长为(10.35± 0.36)cm,与对照组体长(10.18± 0.17)cm比较差异无统计学意义(P> 0.05)。实验组小鼠的体质量为(36.65± 4.94)g,明显高于对照组(P<0.05)。实验组BMI为(3.41± 0.33)kg·m-2,对照组为(2.93± 0.05)kg·m-2,实验组BMI明显高于对照组(P<0.01)。

Fig 1 Effects of IVF-ET on body length(A),
*P<0.05,**P<0.01vscontrol
2.3 IVF-ET对血清AngⅡ、NO、ET-1和PGE2水平的影响Tab 2结果显示,实验组血清AngII水平明显高于对照组(P<0.05)。同时实验组血清NO浓度明显低于对照组,且差异有统计学意义(P<0.05)。实验组血清ET-1、PGE2水平与对照组相比差异无显著性(P>0.05)。
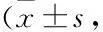
Tab 2 Serum concentration of AngⅡ, NO, ET-1 and PGE2 n=6)
*P<0.05vscontrol
2.4 IVF-ET对子代小鼠肠系膜血管Ca2+信号通路基因表达的影响考虑到Ca2+信号通路在调节内皮细胞和血管平滑肌细胞血管收缩方面具有重要作用,本研究选择了4个代表性基因,包括Itpr1、Calm2、RyR2和RyR3进一步研究。Fig 2的qPCR结果显示,实验组Itpr1、Calm2、RyR3 mRNA表达明显高于对照组(P<0.01),而RyR2 mRNA表达明显低于对照组(P<0.01)。

Fig 2 Relative mRNA expression of Calm2, Itpr1, Ryr2 and Ryr3 detected by qPCR n= 3)
**P<0.01vscontrol
2.5 IVF-ET对肠系膜血管Itpr1和Calm2受体蛋白表达的影响如Fig 3所示,实验组与对照组肠系膜血管Itpr1和Calm2受体蛋白表达明显升高(P<0.01)。

Fig 3 Relative protein expression of Calm2 and Itpr1 detected by Western bolt n= 3)
**P<0.01vscontrol
3 讨论
IVF-ET问世以来,越来越多的不孕夫妇通过该技术圆了生育子女的梦想。然而,人们对这一技术的安全性及相关风险知之甚少。尽管一些研究表明,IVF-ET不会增加子代长期的心血管疾病风险[7]。也有研究报道,在表现正常的IVF-ET年轻子代中发现血管功能障碍、血管衰老和高血压,这可能使其过早地患上心血管疾病[8]。大部分研究都主要针对IVF-ET对大血管和心脏造成的影响,而有关中年子代长期血管风险的数据仍然缺乏。本研究提示,IVF-ET可能对中年子代小血管功能及其调节功能存在影响。
IVF-ET过程中为了获取多个同步发育的卵泡,临床常用高浓度促性腺激素刺激排卵,而对超过正常生理浓度促性腺激素的影响,尤其是对卵子/胚胎发育及子代健康影响的研究仍有空白。本实验通过模拟临床IVF-ET过程,使用高浓度的PMSG,目的是通过实验探讨其对子代血管相关的生物活性物质及血管功能相关基因蛋白表达的影响及其机制。
已有报道[9],IVF-ET子代易患肥胖症和高血压。本研究数据显示,在相同的正常饮食下,实验组BMI明显高于对照组。与先前采用FVB[10]和ICR小鼠[9]的研究结果一致。本研究提示,BMI的上调可能与IVF-ET诱导的胚胎表观遗传变化,以及生命后期的环境因素有关[10]。并且IVF-ET可能改变了参与体质量调控的相关基因。鉴于BMI是心血管疾病的独立危险因素,IVF-ET子代BMI的升高会增加代谢和心血管疾病的可能性。
肠系膜血管是重要的阻力血管,在调控和维持血压中起重要作用。研究表明,血管内皮细胞可释放NO、AngⅡ、ET-1等生物活性物质,参与血管功能和体内代谢平衡的调节[11]。内皮功能障碍会导致血管舒缩功能障碍、内皮通透性增加等,可增加心血管疾病发生的可能性。尤其是血管内皮细胞损伤可导致高血压、动脉粥样硬化等血管损伤性疾病。ET-1是一种强缩血管物质,同时具有刺激血管内皮细胞以及平滑肌细胞分裂增殖的作用。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)对血管收缩功能具有重要影响,而AngⅡ是RAAS系统中的重要活性物质, 也是一种强效的缩血管活性物质。
已有的实验研究显示,遗传和环境因素可相互影响,并共同作用于血管NO合成和血压稳态的调控中[12]。本研究发现,IVF-ET子代的血清NO浓度明显低于对照组,提示体外培养液以及IVF-ET操作过程会对子代小鼠的血管功能产生不利影响。虽然这些发现的基本机制尚不清楚,但有证据表明,内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)是钙信号通路调控十分重要的基因。由eNOS合成的NO能调节血管张力,抑制血小板黏附与聚集,改善血管内皮舒张功能。eNOS的作用依赖Ca2+/钙调蛋白,当血管内皮细胞Calm2表达发生改变时,将会影响eNOS功能出现障碍, 此时eNOS合成NO减少,造成NO生物利用度降低及氧化应激增加, 导致或加重内皮功能障碍,并且IVF-ET诱导的心血管表型变化与eNOS功能改变有关[13]。此前的报道显示,与对照组相比,IVF-ET子代的血管一氧化氮合酶(nitric oxide synthase,NOS)活性明显降低[10]。由此推断这种功能上的差异与Ca2+及其信号通路的作用有关。研究发现,IVF-ET子代肠系膜血管组织中Calm2基因的表达水平明显高于对照组,证实了上述假设。由此推断,Calm2基因的异常表达可能导致IVF-ET子代的血管功能障碍。
最新研究表明[14],Itpr1介导的Ca2+释放可能在调节血管收缩和AngII诱导的高血压及血管平滑肌细胞中发挥重要作用。AngⅡ与AT1受体结合后,通过激活鸟苷酸(GMP)结合的调节蛋白,继而产生三磷酸肌醇(IP3)。IP3与内质网上IP3受体(Itpr1)结合,同时L型钙通道激活后,使细胞摄入钙和肌浆网释放Ca2+增多,导致血管功能异常。本实验结果中检测到Itpr1高表达,证实了其在整个生存期间对血管收缩的影响。本研究数据显示,与对照组相比,实验组RyR2、RyR3的表达水平存在很大差异。众所周知,Itpr1和RyR3的表达升高可能通过钙信号通路导致Calm2表达升高。在所有这些改变的共同作用下,IVF-ET可能会对子代血管调节功能产生不利影响。由此认为,当遇到高碳水化合物饮食、高脂肪饮食以及其他不健康的生活方式时,这种相互作用带来的不利后果将更加严重。
由于与体外受精-胚胎移植相关的多种因素的存在,目前尚无法证明IVF-ET过程导致的影响是否可独立于母体环境,并成为成年疾病发生、发展的主要影响因素。今后将继续研究IVF-ET中多个操作步骤等对子代生命健康的影响,并进一步研究老年子代,以获得更多关于IVF-ET对子代长期影响的数据。
综上所述,本研究显示,IVF-ET子代存在肥胖的倾向及血管相关的如高血压等疾病的易感性。本研究首次提出IVF-ET对子代高血压相关的一组基因Itpr1、Calm2的表达,以及对中老年小鼠微血管功能调节产生影响,为进一步研究IVF-ET影响子代高血压的相关机制提供了重要信息和理论依据,为预防及早期采取适当的干预措施,避免IVF-ET子代血管相关疾病的发生提供了重要的科学指导。
(致谢:本实验主要在苏州大学附属第一医院生殖医学中心实验室内完成,在此对实验室各位老师、同学的指导和帮助表示衷心的感谢!)