氮化硼纳米片负载纳米Cu2O及其催化还原对硝基苯酚
2019-09-12朱萌萌李国华张雪明翟佳欣甘思平宋潇
朱萌萌, 李国华, 张雪明, 翟佳欣, 甘思平, 宋潇
氮化硼纳米片负载纳米Cu2O及其催化还原对硝基苯酚
朱萌萌, 李国华, 张雪明, 翟佳欣, 甘思平, 宋潇
(河北工业大学 化工学院, 天津 300130)
纳米级氧化亚铜具有高效的催化性能, 但较差的稳定性使其应用受限。本研究采用简单可控的抗坏血酸液相还原及气氛焙烧法, 制备了一种兼具高催化活性与催化稳定性的Cu2O/BNNSs-OH负载型催化剂, 其中以聚乙烯吡咯烷酮(PVP)与水相变提供的“推–拉”作用剥离的氮化硼纳米片(BNNSs)为载体, 液相还原反应体系pH=11时, 抗坏血酸向Cu2+滴定制备的Cu2O纳米颗粒(2~7 nm)为活性组分。通过扫描电子显微镜(SEM)、高分辨透射电子显微镜(HRTEM)、原子力显微镜(AFM)、X射线衍射仪(XRD)、X射线光电子能谱仪(XPS)、傅里叶变换红外光谱仪(FT-IR)及拉曼(Raman)光谱仪等对样品的形貌和结构进行表征, 结果表明: Cu2O纳米粒子不但高度分散于载体表面, BNNSs对Cu2O还有一定的稳定作用, 避免其被氧化成CuO。将Cu2O/BNNSs-OH应用于对硝基苯酚催化还原反应中, 该催化剂表现出同贵金属类似的高催化活性, 5次重复利用后的转化率仍高达90%。
氮化硼纳米片; 冻融法; PVP; Cu2O纳米粒子; 对硝基苯酚; 对氨基苯酚
Cu2O纳米颗粒(Cu2O NPs)对对硝基苯酚还原反应具有催化活性[1-2], 但与Au、Ag、Pt、Pd、Rh等贵金属催化剂[3-7]相比, 催化活性明显偏低。纳米颗粒尺寸是决定催化性能的关键因素[8-9], 随着尺寸的减小, 催化剂活性提高, 当尺寸下降到10 nm以下时, Cu2O NPs表现出极高的催化活性。但纳米级Cu2O具有较高的比表面能, 易发生团聚现象[10-11], 且在空气中极易被氧化成CuO, 大大降低催化活性和循环利用性。因此, 如何制备高稳定性的Cu2O NPs成为近年来的研究热点。
氮化硼纳米片(BNNSs)具有与石墨烯相似的二维层状结构[12], 可作为负载Cu2O NPs的载体。理论计算表明, 过渡金属的dz2轨道与BNNSs中B、N的pz轨道重叠[13], 增强了BNNSs与Cu2O NPs表面结合能力; BNNSs拥有较大的比表面积, 既能提高纳米粒子的分散度, 又能最大限度地暴露出催化剂活性位点, 从而有效防止Cu2O NPs团聚[14-15]; BNNSs具有与石墨烯不同的电子结构, 虽然存在大π键, 但电子离域性低。在硼氢化钠还原对硝基苯酚反应中, 氢吸附后的BNNSs物性发生变化, 原本定域在N原子周围的电子流动起来[16], 可以避免Cu2O NPs被氧化成CuO。上述特性使氮化硼纳米片可以作为Cu2O NPs的理想载体材料。
本工作在传统冻融法[17]的基础上, 利用聚乙烯吡咯烷酮(PVP)[18]与水相变提供的“推–拉”协同作用合成单层或少层BNNSs。通过功能化修饰、液相还原和气氛焙烧法制备Cu2O/BNNSs-OH催化剂, 并利用对硝基苯酚的催化还原反应来测试其催化活性和循环利用性能。
1 实验方法
1.1 氮化硼纳米片(BNNSs)的制备
配制六方氮化硼(h-BN=5 mg/mL)与聚乙烯吡咯烷酮(PVP=1.35 mg/mL)的混合溶液, 4 ℃剧烈搅拌12 h后, 转移至-26 ℃冰箱放置12 h, 然后取出在室温下自然融化, 超声30 min。重复上述步骤30次。分散液以3000 r/min的转速在高速离心机中离心分离30 min, 取上层清液, 再以10 000 r/min的速度继续离心15 min, 取下层沉淀冷冻干燥成BNNSs粉末。用去离子水反复冲洗除去BNNSs表面吸附的PVP。
其它表面活性剂辅助冻融法制备氮化硼纳米片步骤同上。将聚乙烯吡咯烷酮分别替换为胆酸钠(SC)、十二烷基苯磺酸钠(SDBS)、十六烷基三甲基溴化铵(CTAB)、环氧丙烷与环氧乙烷共聚物(Pluronic F-127)、聚乙二醇辛基苯基醚(Triton X-100)及失水山梨醇单油酸酯聚氧乙烯醚(Tween 80)等表面活性剂。
1.2 Cu2O/BNNSs-OH催化剂的制备
在250 mL水热釜中加入100 mg BNNSs和30 mL H2O2, 100 ℃下反应2 h, 过滤、干燥后得到功能化修饰的BNNSs。将其分散于100 mL去离子水中, 超声分散1 h, 然后将10 mL 0.2 mol/L的CuCl2×2H2O水溶液加入至上述分散液中, 搅拌1 h, 形成A溶液。用氢氧化钠和盐酸调节混合溶液的pH值, 调节范围为3~11。按照抗坏血酸(VC)与Cu2+摩尔比为1 : 5配制10 mL 1.0 mol/L的VC水溶液(B)。再在65 ℃搅拌条件下将溶液B加入到溶液A中, 反应1.5 h, 所得产物经过滤、洗涤、干燥备用。将反应体系pH=11时制备的粉体放入管式加热炉中, 通入80 mL/min的氩气气流, 以2 ℃/min 的升温速率从室温升至600 ℃, 保温2 h, 降温至室温后得到Cu2O/BNNSs-OH催化剂。本研究还制备了Cu、Cu2O-Cu及CuO基催化剂与Cu2O基催化剂进行对照, 其中Cu及Cu2O-Cu基催化剂分别在反应体系pH为5和9, 并进行氩气气氛焙烧制备的; CuO基催化剂则在加入抗坏血酸前混合溶液pH=11, 并进行空气气氛焙烧制备的。
1.3 对硝基苯酚降解实验
将100 mg NaBH4加入至100 mL 71.9 μmol/L对硝基苯酚溶液中, 混合液变为亮黄色, 然后加入5 mg铜基催化剂, 每隔30 s取样测试一次UV-Vis光谱图, 直至黄色完全褪去。
2 结果与讨论
2.1 冻融剥离过程分析
冻融法剥离块状六方氮化硼机理如图1所示: PVP通过强烈的疏水作用吸附在六方氮化硼表面, 为剥离过程提供一种强烈的“拉”的驱动力。4 ℃时, 水的体积最小, 排列最为规整[19], 水分子巨大的比表面能及强烈的搅拌作用大大提高插层效率。当温度降至0 ℃以下时, 水分子逐渐聚集成蜂窝状结构, 水结冰产生的“体积膨胀力”(250 kPa)[20]能够克服层间的范德华力, 为剥离提供一种“推”的驱动力。经过反复冻融, 在PVP与水相变提供的“推–拉”协同作用下可以实现块状氮化硼的高效剥离。h-BN表面吸附的PVP可以有效防止BNNSs发生团聚。

图1 冻融法剥离的机理示意图
2.2 表面活性剂对氮化硼剥离的影响
图2(a)为利用不同表面活性剂剥离得到氮化硼纳米片的紫外–可见(UV-Vis)吸收光谱, 包括离子型表面活性剂SC、SDBS及CTAB和非离子型表面活性剂PVP、Pluronic、F-127、Triton X-100及Tween 80。BNNSs在300 nm后无明显吸收峰, 故采用300 nm处的吸光度值计算氮化硼纳米片浓度。根据朗伯比尔定律,(为吸光度,为摩尔吸收系数,为吸收层厚度,为分散液浓度), 通过绘制标准曲线得3177 L×g–1×m–1, 可计算BNNSs浓度[21]。结果表明, PVP辅助剥离得到的分散液中BNNSs浓度最高。这是因为离子型表面活性剂与水的相互作用较强, 而非离子型表面活性剂却通过强烈的疏水作用吸附在h-BN表面, PVP则因分子链中的吡咯烷酮基团与h-BN之间强烈的π–π作用[22], 为剥离提供强烈的“拉”的驱动力。
过量PVP会掩盖催化剂的活性位点, 故本研究对PVP吸附量进行了探究。PVP和PVP/BNNSs (PVP=40%h-BN)的热重分析(TGA)曲线表明, 仅有27%的PVP吸附在BNNSs表面, 并且从图中可以看出经过反复水洗的BNNSs表面已无PVP残留。与传统冻融法相比, PVP在最优实验条件下与水相变作用剥离制备的氮化硼纳米片产率显著提高, 达到32%。

图2 不同表面活性剂剥离的BNNSs紫外–可见吸收光谱图(a), BNNSs、PVP/ BNNSs、纯PVP的TGA曲线(b)
2.3 BNNSs的形貌与结构分析
利用SEM和TEM观察剥离得到的BNNSs的形貌, 由图3(a~b)可以看出与原始h-BN相比, BNNSs呈现平滑交错的薄层纳米片结构。高分辨TEM显示BNNSs保持高度有序的晶格条纹结构, 为了准确测量晶面间距, 选取层数相对较多的位置进行拍摄, 可清晰看出纳米片层数为6层, 条纹间距为0.33 nm。电子衍射(SEAD)图案显示出了BNNSs完整六方对称蜂窝状的晶体结构, 表明其六方相结构在剥离过程中得到保留, 没有发生破坏和变形。为了更加直接地测定氮化硼纳米片的厚度和层数分布, 对其进行原子力显微镜(AFM)表征。从图3(d~e)看出选取的纳米片厚度为1.4 nm, 约为4–5个原子层的厚度。经过统计分析, 90%以上纳米片厚度少于6层。以上结果表明, PVP辅助冻融法成功制备层数少于6层的超薄BNNSs。
图4(a)为剥离前后氮化硼的XRD图谱, 图中衍射峰(002)、(100)、(102)、(004)和(110)与标准卡片(JCPDS 34-0421)相对应, 说明BNNSs最大程度保留了h-BN原始的晶格结构。另外, BNNSs的(002)特征峰强度降低为原始h-BN的50%,(100)/(004)数值由2.2降为1.0, 以上数据的变化均说明剥离后的BNNSs层数减少[23]。Raman图谱表明, 由于BNNSs比块状h-BN的纳米片更薄, 更容易引起官能团 振动, BNNSs相对于h-BN发生蓝移, 特征峰强度降低。
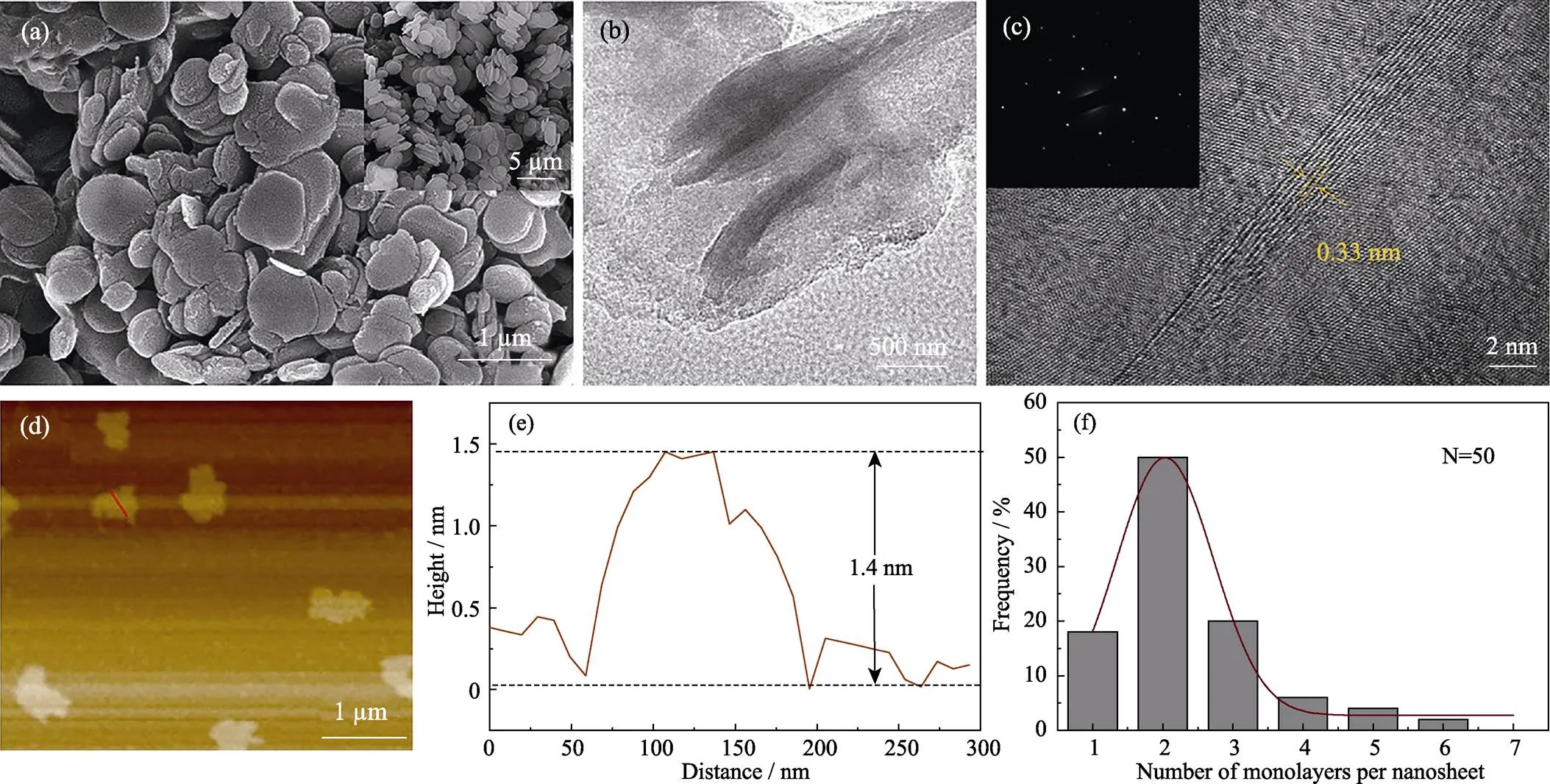
图3 BNNSs的SEM ((a)右上角为块状h-BN放大图片), TEM (b)和HRTEM照片((c)左上角为SEAD图案), 及其AFM图(d)、高度轮廓图(e)和厚度统计图(f)

图4 氮化硼剥离前后的XRD图谱(a)和Raman谱图(b)
2.4 反应体系pH对催化剂组成与形貌的影响
在液相还原法制备纳米Cu2O/BNNSs-OH过程中, 不同pH环境下, 产物的组成与形貌有所不同。前驱体阶段(图5(a)), 当混合溶液pH在5~7区间, Cu2+转变为Cu(OH)2形式, 随着pH升至9~11区间, 则以CuO形式为主。抗坏血酸还原阶段(图5(b)), 当反应体系pH分别为3、5时, 以载体BNNSs-OH的XRD图谱为参照, 图谱中其余三个尖锐的衍射峰分别对应Cu的(111)、(200)、(220)晶面, 与Cu标准卡片(JCPDS 04-0836)相对应, 且图中未出现Cu2O和CuO的衍射峰。当反应体系pH为7时, 除了Cu以外, 产物开始出现Cu2O物相(JCPDS 77-0199), 但Cu仍为主要产物。随着反应体系pH升高至9, Cu2O(111)衍射峰的强度逐渐增强, 而Cu(111)衍射峰的强度大幅降低, 说明Cu2O的含量随着反应体系pH的升高而增加, 产物物相的组成发生剧烈变化, 主导相变为Cu2O。当反应体系pH持续升高至11时, 反应产物为Cu2O, 其特征衍射峰归属于Cu2O的(110)、(111)、(200)、(220)、(311)晶面, 且没有其他杂质峰。发生上述物相变化的原因是, 抗坏血酸的还原能力与反应体系的pH有关。在强碱性条件下, VC还原能力降低, CuO作为反应前驱体仅能被还原为Cu2O[19](2CuO+C6H8O6®Cu2O+ C6H6O6+H2O); 在酸性或弱碱性条件下, VC的共轭体系能够提供足够的电子将前驱体Cu(OH)2还原为单质Cu(Cu(OH)2+C6H8O6®Cu2O+C6H6O6+H2O, Cu2O+C6H8O6→Cu+C6H6O6+H2O); 在液相还原过程中, VC的存在可以抑制Cu及Cu2O被氧化成CuO[24]。
为了进一步了解催化剂的成分和元素价态, 采用XPS对样品进行表征, 结果如图6所示。B1s和N1s谱图中190.3和398.0 eV与文献报道中h-BN的出峰位置一致[25], O1s图谱中530.1 eV信号对应Cu2O中晶格氧O1s的电子结合能[26], Cu2p轨道能谱图中位于932.3 (FWHM=1.8 eV)和952.1 eV的强峰分别对应Cu2p3/2和Cu2p1/2的电子结合能, 均属于Cu2O中Cu(I)的特征峰, 且Cu2p3/2出峰位置与块状Cu2O(932.6 eV)[27]相比向低电子结合能方向移动, 说明Cu2O以纳米晶体形式负载在BNNSs-OH表面上[28]。Cu2p谱图中并未出现任何卫星峰和伴峰, 表明抗坏血酸液相还原及气氛焙烧法成功制备了高纯度的纳米级Cu2O/BNNSs-OH催化剂。
图7(a)为功能化氮化硼纳米片的SEM照片, 可以清晰地看出BNNSs-OH 为平滑交错的片状结构。前驱体阶段(混合溶液pH=11)制备的CuO/ BNNSs-OH由大量细小的CuO颗粒构成, 其粒径相对较大, 且紧紧团聚在一起(图7(b))。抗坏血酸还原阶段, 不同pH下制备的铜基催化剂SEM照片如 图7(c~g)所示。当反应体系pH在3~7时, Cu颗粒粒径随着pH增加逐渐减小, 最终变为球形颗粒 (图7(c~e))。当反应体系pH升高至9时, 在亚微米级Cu颗粒的表面开始产生纳米级颗粒, 对应上述XRD结果可知, 新生的Cu2O NPs附着在原来的Cu颗粒上(图7(f))。高分辨TEM图说明反应体系pH为11时, 产物全部为2~7 nm左右的Cu2O球形纳米粒子, 高度分散于氮化硼纳米片的表面, 且Cu2O NPs具有清晰的晶格, 层间距为0.24 nm, 对应立方相Cu2O的(111)晶面[29](图7(h~i))。
2.5 混合方式对催化剂形貌的影响
不同混合方式影响成核速率和生长速率, 进而影响催化剂晶粒粒径大小。正向滴注时(抗坏血酸滴加到Cu2+溶液, VC→Cu2+), 反应开始时还原剂浓度较低, 与Cu2+形成水溶配合物, 一段时间后Cu2+达到过饱和浓度爆发成核。由于在成核过程中Cu2+消耗很大, 生长过程中Cu2+浓度很低, 故最终晶粒粒径较小。反向滴注时, 溶液中抗坏血酸浓度很高, Cu2+被还原马上成核, Cu2O连续生长, 保持较快的生长速率, 最终得到的Cu2O颗粒粒径较大。
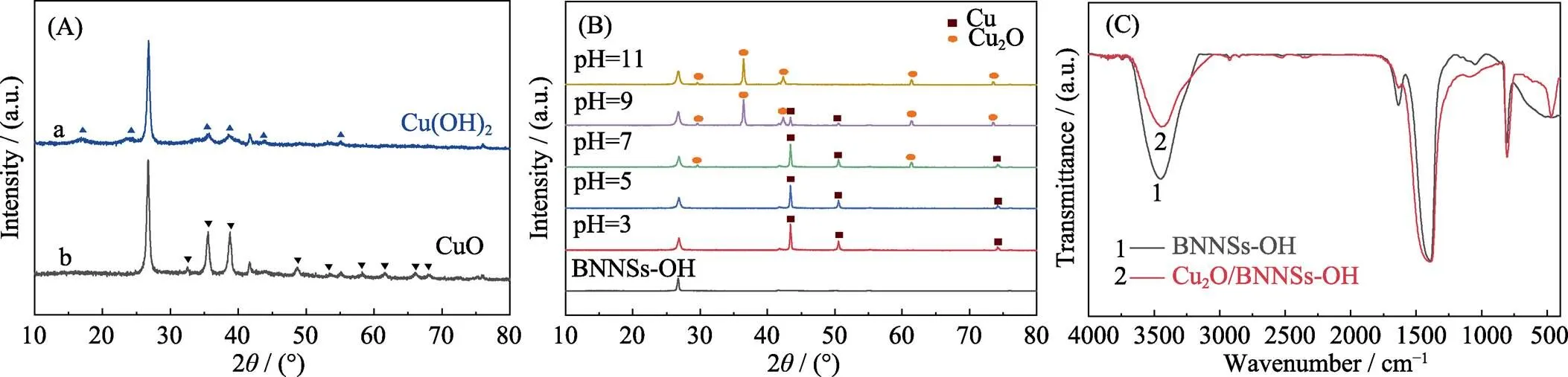
图5 加入抗坏血酸前混合溶液不同pH(a: pH 5–7, b: pH 9–11)下得到前驱体的XRD谱(A), 抗坏血酸还原反应体系不同pH下制备的样品的XRD图谱(B), Cu2O/BNNSs-OH的红外光谱图(C, pH11)
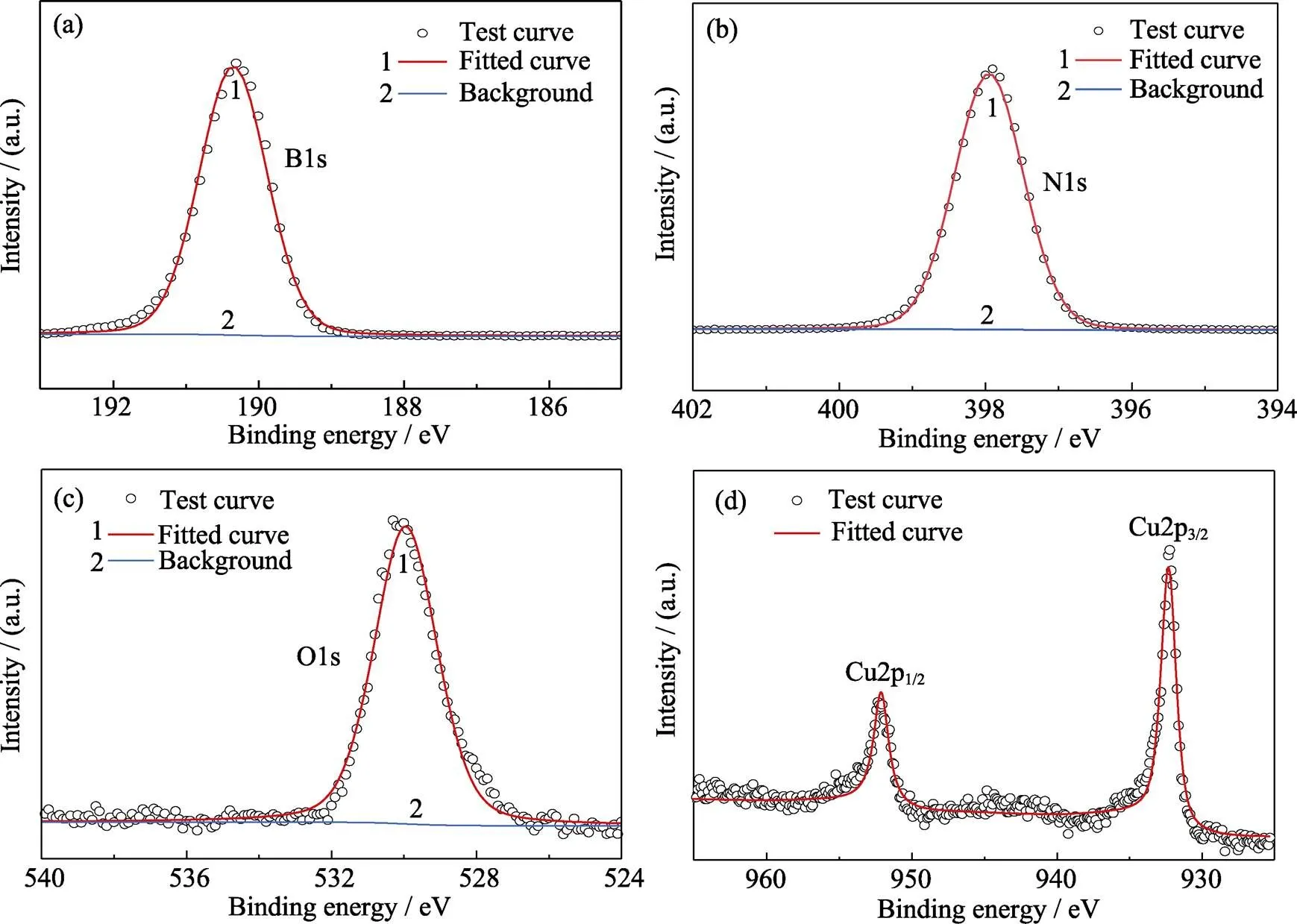
图6 Cu2O/BNNSs-OH的的XPS谱图

图7 羟基化氮化硼纳米片(a), CuO/BNNSs-OH(b)在不同pH抗坏血酸还原反应体系下制备样品的SEM照片((c) pH 3, (d) pH 5, (e) pH 7, (f) pH 9, (g) pH 11), Cu2O/BNNSs-OH的HRTEM照片(h~i) (h)右上角为Cu2O NPs粒径统计图, (i)左下角为SEAD图案及晶格条纹图案, pH 11
对铜盐与抗坏血酸溶液的不同混合方式获得的Cu2O/BNNSs-OH催化剂的形貌进行观察。图8(a)为在抗坏血酸还原阶段, 反应体系pH=11条件下, 正向滴注混合时制备的Cu2O/BNNSs-OH催化剂的SEM照片。Cu2O球形纳米粒子高度分散于BNNSs- OH载体表面上; 反向滴注混合时, 由图8(b)可以看出载体表面的Cu2O颗粒尺寸明显增大, 呈亚微米级。由于纳米级粒子具有更高的催化活性, 故本研究采用正向滴注的混合方式制备纳米Cu2O/BNNSs- OH催化剂。
2.6 催化剂催化性能研究
研究以NaBH4还原对硝基苯酚反应为模型考查不同铜基催化剂的催化性能, 不同铜基和载体对还原反应进程影响的UV-Vis光谱变化情况如图9所示, 五种铜基催化剂均能催化还原4-NP。随着反应的进行, 4-NP的吸收峰逐渐下降直至几乎完全消失, 并且4-NP溶液颜色也逐渐褪去直至透明, 4-AP特征峰相应增加直至达到最高值, 表明4-NP已经完全转化为4-AP。
铜基纳米粒子的价态数、颗粒尺寸及分散程度是影响催化活性的关键因素。Cu2O/BNNSs-OH反应速率最快, 仅在1.5 min内就将4-NP完全还原为4-AP(图9(c)), 亚微米级Cu2O-Cu、Cu及CuO催化剂, 反应速率较缓慢, 分别在3、5、8 min时4-NP吸光度基本为零。Cu2O/BNNSs-OH的催化活性最高。同Cu及CuO催化剂相比, 处于中间价态的Cu2O具有较强的电子迁移能力, 还可以催化水分解产氢[30], Cu2O NPs作为电子和氢原子的中转站, 将电子和氢转移至4-NP将其快速催化还原为4-AP。

图8 不同混合方式下制备Cu2O/BNNSs-OH的SEM照片
(a) VC→Cu2+; (b) Cu2+→VC
载体也是影响催化活性的一个重要因素。氮化硼纳米片中B、N的pz轨道与铜的dz2轨道重叠, 增强BNNSs与Cu2O NPs表面结合能力, 但功能化氮化硼纳米片表面的-OH同样有利于Cu2O NPs的固定。相对BNNSs而言, BNNSs-OH拥有更多的活性位点, 可作为Cu2O NPs的理想载体材料。由Cu2O/ BNNSs-OH的FT-IR图谱(图5(c))看出, 除了出现BNNSs-OH特征峰外, 在631 cm-1处有强烈的Cu-O振动, 且3400 cm-1处羟基吸收峰强度明显减弱, 表明载体表面及边缘的羟基能够充当Cu2O NPs与载体接触的活性位点。由UV-Vis光谱变化情况看出, 未功能化的氮化硼纳米片为载体(图9(e))时, 催化活性远不如BNNSs-OH。图9(f)为不同类型催化剂还原4-NP速率图, 结果表明, 单独的NaBH4和载体都不能还原4-NP, 进一步证明Cu2O/BNNSs-OH还原速率明显高于其他类型催化剂。
2.7 催化还原4-NP机理研究
为了更深入地了解4-NP催化还原反应, 本研究分别对反应过程中的NaBH4, BNNSs-OH及Cu2O NPs催化剂对4-NP的光谱吸收峰的影响进行考查。如图10(a)所示, 4-NP在317 nm处有特征吸收峰, 当加入NaBH4后, 4-NP中的羟基被去质子化, 在碱性条件下转化成4-NP阴离子, 吸收峰从317 nm红移至400 nm, 此时溶液由淡黄色变为黄色。虽然NaBH4是强还原剂, 但在无催化剂作用的情况下也不能直接还原4-NP离子, 这是因为4-NP阴离子与BH4-之间强烈的相互排斥作用以及两者氧化还原电位之间的巨大差异(H3BO3(aq.)/BH4–(aq.)= –1.33 V和4-NP(aq.)/4-AP(aq.)=0.76 V), 故通过NaBH4将4-NP还原为4-AP在动力学上是不可行的。用BNNSs-OH代替NaBH4加入到上述体系后, 也会发生光谱吸收峰移动(图10(b)), 这是由于BNNSs-OH表面和边缘含有大量的–OH, 可以当作吸附和4-NP离子化的活性位点。在催化剂的作用下, 可以克服BH4–到4-NP阴离子电子转移的动力学限制, 促进反应快速 进行。
基于以上研究, Cu2O/BNNSs-OH催化还原对硝基苯酚的作用机理如图10(c)所示。BNNSs-OH和Cu2O NPs在催化还原4-NP反应过程中具有协同作用。4-NP被BNNSs-OH吸附并离子化, NaBH4仅被当作电子供体和氢源(式(1))[31], Cu2O NPs作为电子和氢原子的中转位点, 传递表面氢原子和电子至对硝基苯酚阴离子, 最终使–NO2加入质子移除氧转化为–NH2(式(2))[31]。而Cu单质及CuO颗粒尺寸较大且电子迁移能力相对较弱, Cu2O-Cu基催化剂因为Cu2O附着在亚微米级的Cu上, 也在一定程度上减缓反应进行, 故与Cu2O NPs相比催化活性相对较差。

图9 Cu/BNNSs-OH(a)、CuO/BNNSs-OH(b)、Cu2O/BNNSs-OH(c)、Cu2O-Cu/BNNSs-OH(d)以及Cu2O/BNNSs(e)催化还原4-NP紫外-可见吸收光谱图, At/A0与化学反应时间T的关系图(f)
BH4–+2H2O®BO2–+4H2(1)

2.8 催化剂循环稳定性分析
催化剂循环稳定性在工业生产应用中至关重要, Cu2O/BNNSs-OH催化剂的重复性测试结果如图11(a)所示。随着循环次数的增加, 催化剂对4-NP的还原活性没有明显降低, 转化率仍保持在90%以上, 表明催化剂具有优异的循环稳定性。由5次重复降解前后催化剂的XRD图谱(图11(b))可以看出, 5次循环后, Cu2O仍为主要物相, 但出现了极少单质Cu的特征峰, 表明极少Cu2O NPs被反应体系中过量NaBH4还原为Cu NPs。此时, 催化剂主要活性组份变为Cu-Cu2O NPs, 由于在催化剂中引入原位生成的Cu NPs, 促进Cu和Cu2O之间的界面电荷转移, 使得 Cu2O/Cu NPs同样展现优异的催化性能。
3 结论
1) 通过PVP辅助的温和冻融剥离法可以获得高产率及大尺度的BNNSs, 经表面修饰增加更多的活性位点, 得到理想的催化剂载体。
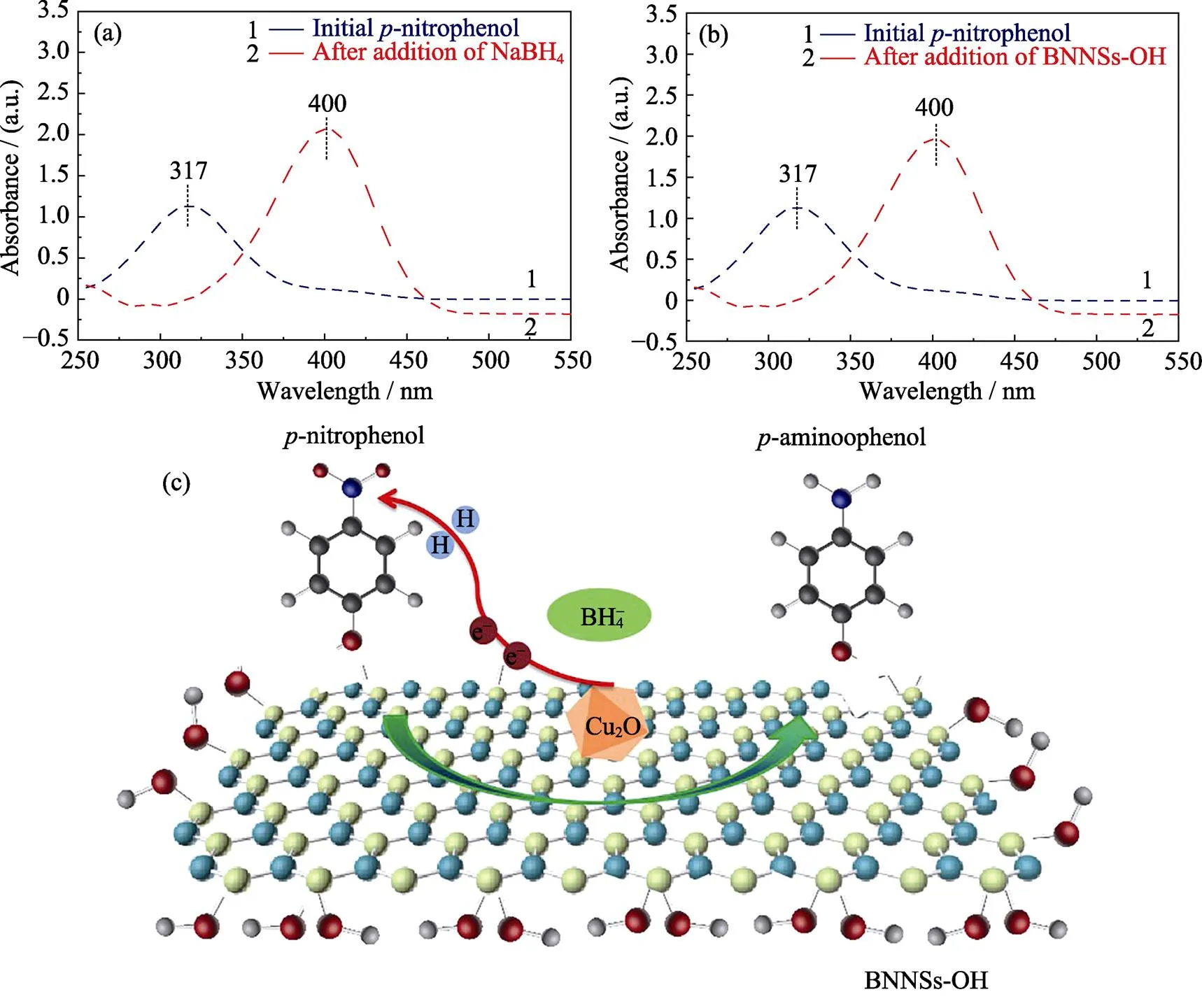
图10 加入NaBH4(a)、BNNSs-OH(b)前后4-NP的紫外–可见光谱图, 及Cu2O/BNNSs-OH催化还原4-NP的机理示意图
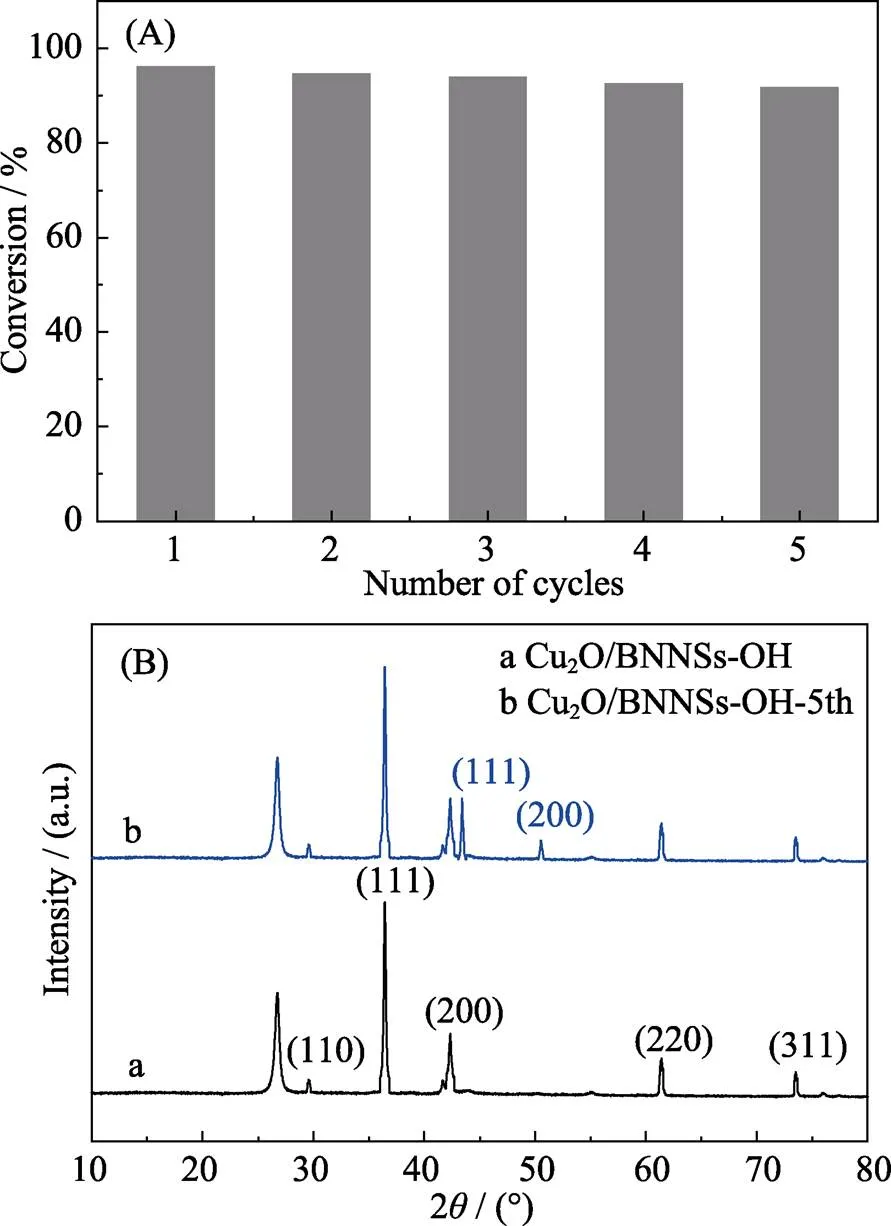
图11 Cu2O/BNNSs-OH催化还原4-NP循环利用图(A), 5次循环前后Cu2O/BNNSs-OH催化剂XRD图谱(B)
2) 抗坏血酸液相还原过程中pH值、混合方式控制催化剂组成和形貌。当反应体系pH=11时, 正向滴定可获得分散性良好的Cu2O球形纳米粒子(2~7 nm)。
3) 纳米Cu2O/BNNSs-OH在对硝基苯酚催化还原过程中活性最高, 表现出同贵金属类似的高催化活性。同亚微米级Cu及CuO相比, 处于中间价态的Cu2O具有较强的电子迁移能力, Cu2O NPs作为电子和氢原子的中转站, 将电子和氢转移至4-NP将其快速催化还原为4-AP。
[1] RATH P C, SAIKIA D, MISHRA M,Exceptional catalytic performance of ultrafine Cu2O nanoparticles confined in cubic mesoporous carbon for 4-nitrophenol reduction.,2018, 427: 1217–1226.
[2] NIU H, LIU S, CAI Y,. MOF derived porous carbon supported Cu/Cu2O composite as high performance non-noble catalyst.,2016, 219: 48–53.
[3] ROCHA M, COSTA P, PEREIRA C,. L-serine-functionalized montmorillonite decorated with Au nanoparticles: a new highly efficient catalyst for the reduction of 4-nitrophenol., 2018, 361: 143–155.
[4] MAHAM M, NASROLLAHZADEH M, SAJADI S M,. Biosynthesis of Ag/reduced graphene oxide/Fe3O4using Lotus garcinii leaf extract and its application as a recyclable nanocatalyst for the reduction of 4-nitrophenol and organic dyes., 2017, 497: 33–42.
[5] ZOU P P, WANG M S, ZHAO L,. One-step synthesis of Pt@ three-dimensional graphene composite hydrogel: an efficient recyclable catalyst for reduction of 4-nitrophenol., 2016, 30(8): 722–725.
[6] COCCIA F, TNUCCI L, BOSCO D,. One-pot synthesis of lignin-stabilised platinum and palladium nanoparticles and their catalytic behaviour in oxidation and reduction reaction., 2012, 14(4): 1073–1078.
[7] GACEM N, DIAO P. Effect of solvent polarity on the assembly behavior of PVP coated rhodium nanoparticles., 2013, 417: 32−38.
[8] YANG X F, WANG A, QIAO B,Single-atom catalysts: a new frontier in heterogeneous catalysis.,2013, 46(8): 1740–1748.
[9] OH S D, KIM M R, CHOI S H,. Radiolytic synthesis of Pd-M (M=Ag, Au, Cu, Ni and Pt) alloy nanoparticles and their use in reduction of 4-nitrophenol.,2008, 14(5): 687–692.
[10] MUNNIK P, DE JONGH P E, DE JONG K P. Recent developments in the synthesis of supported catalysts., 2015, 46(38): 6687–6714.
[11] YAN X, WANG X, TANG Y,. Unusual loading-dependent sintering-resistant properties of gold nanoparticles supported within extra-large mesopores., 2013, 25(9): 1556–1563.
[12] NAG A, RAIDOGIA K, HEMBRAM K P,. Graphene analogues of BN: novel synthesis and properties.,2010, 4(3): 1539–1544.
[13] LASKOWSKI R, BLAHA P, SCHWARZ K. Bonding of hexagonal BN to transition metal surfaces: andensity-functional theory study.,2008, 78(78): 1436–1446.
[14] HUANG C, CHEN C, YE X,Stable colloidal boron nitride nanosheet dispersion and its potential application in catalysis.,2013, 1(39): 12192–12197.
[15] ZHENG M, LIU Y, GU Y,Synthesis and characterization of boron nitride sponges as a novel support for metal nanoparticles.,2008, 51(3): 205–210.
[16] LIANG H L. Research on the Physical Properties of Fully Hydrogenated Boron Nitride Films. Jinan: Shandong University2012: 1–24.
[17] LI C, WANG T L, WU Y Z,Fabrication of two-dimensional nanosheetswater freezing expansion exfoliation.,2014, 25(49): 1–6.
[18] GUARDIA L, PAREDES J I, ROZADA R,. Production of aqueous dispersions of inorganic graphene analogues by exfoliation and stabilization with non-ionic surfactants.,2014, 4(27): 14115-14127.
[19] LIU Q, KAZUAKI N, KENSUKE K,Effects of reaction parameters on the preparation of submicron Cu particles by liquid phase reduction method and the study of reaction mechanism.,2013, 241(3): 98–104.
[20] SONG H, LI T, ZHANG J,Highly anisotropic Sb2Se3nanosheets: gentle exfoliation from the bulk precursors possessing 1D crystal structurep., 2017, 29(29): 1–7.
[21] SMITH R J, KIBG P J, LOTYA M,Large-scale exfoliation of inorganic layered compounds in aqueous surfactant solutions.,2011, 23(34): 3944–3948.
[22] MA P, SPENCER J T. Non-covalent stabilization and functionalization of boron nitride nanosheets (BNNSs) by organic polymers: formation of complex BNNSs-containing structures., 2015, 50(1): 313–323.
[23] GAO W, ZHAO Y, YIN H. Lateral size selection of liquid exfoliated hexagonal boron nitride nanosheets.,2018, 8: 5976–5983.
[24] HUMINIC G, HUMINIC A. Application of nanofluids in heat exchangers: a review.,2012, 16(8): 5625–5638.
[25] PARK K S, LEE D Y, KIM K J,Observation of a hexagonal BN surface layer on the cubic BN film grown by dual ion beam sputter deposition.,1997, 70(3): 315–317.
[26] WAGNER C D, RIGGS W M, DAVIS L E,Muilenber, handbook of X-ray Photoelectron Spectroscopy. Perkin Elmer Corporation Physical Electronics Division, USA, 1979: 1–190.
[27] ESPINOS J P, MORALES J, BARRANCO A,Interface effects for Cu, CuO, and Cu2O deposited on SiO2and ZrO2. XPS determination of the valence state of copper in Cu/SiO2and Cu/ZrO2Catalysts., 2002, 106(27): 6921–6929.
[28] SUN Q, LI Y, SUN X,Improved photoelectrical performance of single-crystal TiO2nanorod arrays by surface sensitization with copper quantum dots,2013, 1(7): 798–804.
[29] YAN X Y, TONG X L, ZHANG Y F,Cuprous oxide nanoparticles dispersed on reduced graphene oxide as an efficient electrocatalyst for oxygen reduction reaction.,2012, 48(13): 1892–1894.
[30] MICHIKAZU H, TAKESHI K, MUTSUKO K,. Cu2O as a photocatalyst for overall water splitting under visible light irradiation.,1998, 3: 357–358.
[31] HUANG J, VOGEHR S, TANG S,Highly catalytic Pd−Ag bimetallic dendrites., 2010, 114(35): 15005–15010.
Boron Nitride Nanosheets Supported Cu2O Nanoparticles: Synthesis and Catalytic Reduction for 4-nitrophenol
ZHU Meng-Meng, LI Guo-Hua, ZHANG Xue-Ming, ZHAI Jia-Xin, GAN Si-Ping, SONG Xiao
(School of Chemical Engineering, Hebei University of Technology, Tianjin 300130, China)
Despite excellent catalytic capability, Cu2O nanomaterial exhibits weak stability which limits its application. In this study, a novel kind of Cu2O, Cu2O/BNNSs-OH, supported catalyst with highly catalytic efficiency and stability, was facilely fabricateda controllable liquid phase reduction of ascorbic acid and combining with an annealing process. Cu2O/BNNSs-OH catalyst was synthesized by using boron nitride nanosheets (BNNSs), prepared by the “push-pull” effect of polyvinylpyrrolidone (PVP) and water phase change, as a supporter and spherical Cu2O nanoparticles (2–7 nm) prepared by forward titration (ascorbic acid→Cu2+, solution with a pH 11)as active components. Morphology and structure of as-obtained samples were characterized by scanning electron microscopy (SEM), high resolution transmission electronic microscopy (HRTEM), atomic force microscopy (AFM), X-ray powder diffraction (XRD), X-ray photoelectron spectroscopy (XPS), Fourier transform infrared spectroscopy (FT-IR), and Raman spectroscopy. The results of the synthetic method showed that spherical Cu2O nanoparticles were uniformly dispersed on the carrier surface and BNNSs displayed some stabilization effect on Cu2O which could be prevented from being oxidized into CuO. Moreover, the catalytic activity was investigated by catalytic reduction reaction of 4-nitrophenol to 4-aminophenol. Cu2O/BNNSs-OH with high catalytic activity similar to the noble metal catalyst for the reduction of 4-nitrophenol is highly reusable for five successive cycles without significant degradation and activity loss.
boron nitride nanosheets; freeze-thaw method; PVP;Cu2O nanoparticles; 4-nitrophenol;
TQ174
A
1000-324X(2019)08-0817-10
10.15541/jim20180487
2018-10-16;
2019-01-07
朱萌萌(1993–), 女, 硕士研究生. E-mail: zhu_m19930821@126.com
李国华, 副教授. E-mail: ligh@hebut.edu.cn
