茶叶籽油中茶多酚和儿茶素的测定
2019-09-11周晓晴胡立文曾林晖
周晓晴,胡立文,罗 琦,曾林晖,李 晴,兰 伟
(1.江西省食品检验检测研究院,江西南昌,330001;2.南昌大学食品学院,江西南昌,330000;3.江西省产品质量监督检测院,江西南昌,330000)
茶叶籽油是以茶叶树(CamelliaSinensisO.Ktze.)的果实茶叶籽为原料,经物理压榨或溶剂浸出而得的食用油脂,富含不饱和脂肪酸[1]。世界各茶叶产地均对茶叶籽油进行研究和开发[2-4],中国卫生部2009年第18号文件批准茶叶籽油为新资源食品。
茶多酚是以茶叶为原料提取的多酚混合物,由黄酮、黄烷酮、酚酸、花青素等组成,其中儿茶素占60%~80%,儿茶素类有八种结构,分别是儿茶素(catechin,+C)、表儿茶素(epicatechin,-EC)、儿茶素没食子酸酯(catechin gallate,-GC)、表儿茶素没食子酸酯(epicatechin,-ECG)、表没食子儿茶素(epigallocatechin,-EGC)、表没食子儿茶素表没食子酸酯(epigallocatechin gallate,-EGCG)、没食子儿茶素(gallocatechin,+GC)、没食子儿茶素没食子酸酯(gallocatechin gallate,-GCG),其中-GC、-ECG、-EGCG和-GCG具有酯键结构可微溶于油脂[5]。茶多酚可清除自由基,具有抗氧化作用[6]。有研究表明茶多酚可抗结肠癌[7]。
茶多酚中部分成分可微溶于油脂。有报道在橄榄油和油茶(CamelliaoleiferaAbel.)油中测得儿茶素[8-9];梁杏秋等[10]认为茶多酚酯型化合物以稳定状态分散地存在于茶叶籽油中。朱晋萱等[11-12]参照GB/T 8313-2018中福林酚法测定了13个省的茶叶籽油中茶多酚含量,以EGCG为标准物,测得茶多酚含量为19.73~47.61 mg·kg-1。Fazel等[13]以高效液相色谱法(HPLC)测得伊朗地区茶叶籽油中+C、-EC、-ECG、-EGC、-EGCG、+GC和-GCG 7种儿茶素的含量,其中-GC未检出;Wang等[14]以高效液相色谱-质谱联用测得中国多个产地的茶油、红花茶油和茶叶籽油中苯甲酸、肉桂酸、羟基苯乙酸、黄烷醇、黄酮醇、黄酮类化合物和二氢黄酮类化合物含量,其中茶叶籽油儿茶素总含量为2.25~3.31 mg·kg-1。上述文献报道福林酚法测得茶叶籽油中茶多酚含量,按占比60%~80%换算成儿茶素,与HPLC法测得茶叶籽油中儿茶素类总含量相差较大。
本文参照GB/T 31740.2-2015茶制品中茶多酚和儿茶素测定方法,分别对茶叶籽压榨毛油、浸出毛油、粗脂肪和茶叶籽精炼油中茶多酚和儿茶素类进行测定,并进行分析对比,探讨福林酚法测定茶叶籽油中茶多酚含量和HPLC法测定茶叶籽油中儿茶素总含量的合理性。
1 材料与方法
1.1 材料与仪器
茶叶籽 采摘自江西萍乡、兴国和婺源;茶叶籽毛油及精炼油 江西信江特种农副产品开发有限公司;甲醇、乙腈 色谱纯,西陇科学有限公司;C标准品、EC标准品、ECG标准品、EGC标准品、EGCG标准品 纯度≥99%,上海源叶生物科技有限公司;茶多酚对照品 纯度≥98%,北京索莱宝科技有限公司;没食子酸一水合物 阿拉丁试剂;丁基羟基茴香醚(BHA) 食品级,法国丹尼斯克;2,6-二叔丁基-4-甲基苯酚(BHT) 食品级,德国洋樱集团有限公司;叔丁基对苯二酚(TBHQ) 食品级,河南弘成食品添加剂有限公司;维生素E 阿拉丁试剂。
RE-52A旋转蒸发仪 上海亚荣生化仪器厂;Agilent Technologies 1260高效液相色谱仪 美国 Agilent公司;ZORBAX Eclipse XDB-C18色谱柱(4.6×250 mm 5-Micron) 美国 Agilent公司;752S分光光度计 上海精若科学仪器公司;飞鸽TGL-15B高速台式离心机 上海安亭科学仪器厂;AZ-B301榨油机 青岛澳柯玛生活电器有限公司;NAI-ZFCDY-6Z脂肪测定仪 上海那艾精密仪器有限公司。
1.2 实验方法
1.2.1 茶叶籽油制备
1.2.1.1 压榨毛油制备 将茶叶籽去壳,称取4 kg茶叶籽仁,粉碎筛分得到60目的茶叶籽仁粉,并在900 W和80 ℃下微波处理80 s,用榨油机压榨得到压榨茶叶籽毛油,称重,备用。
1.2.1.2 浸出毛油制备 将茶叶籽去壳,称取2 kg茶叶籽仁,粉碎筛分得到60目的茶叶籽仁粉,并在900 W和80 ℃下微波处理80 s,置于烧瓶中,加入石油醚浸出,料液比(w/v)1∶4,浸泡24 h,每隔3 h搅拌1次,分离浸出液;再次以料液比(w/v)1∶2加入石油醚浸出,操作同上,分离并合并两次浸出液,以0.09 MPa 40 ℃旋蒸回收石油醚,旋蒸至冷凝管无液滴流下,得到浸出茶叶籽毛油,称重,备用。
1.2.1.3 茶叶籽粗脂肪制备 将茶叶籽去壳,称取2 kg茶叶籽仁,粉碎筛分得到60目的茶叶籽仁粉,将20 g茶叶籽仁粉加入滤纸筒内,用脂肪测定仪提取粗脂肪,收集提取液,以0.09 MPa 40 ℃旋蒸回收石油醚,旋蒸至冷凝管无液滴流下,得到粗脂肪,称重,备用。
1.2.2 提取茶多酚
1.2.2.1 提取油脂中茶多酚 取压榨毛油、浸出毛油、茶叶籽粗脂肪、厂家提供毛油和精炼油各100 g,分别置于500 mL具塞三角瓶中,加入120 mL正己烷,充分振摇3 min,再加70%的甲醇溶液20 mL,充分振摇5 min,转移至500 mL分液漏斗中静置20 min,分液;再向上层液加入70%的甲醇溶液20 mL,重复提取一次,合并两次下层提取液,以0.09 MPa 72 ℃旋蒸浓缩至约1 mL,收集浓缩液,并用甲醇定容至2 mL,过膜,用于HPLC法测定。
取压榨毛油、浸出毛油、茶叶籽粗脂肪、厂家提供毛油和精炼油各5 g,分别置于250 mL具塞三角瓶中,加入15 mL正己烷,充分振摇3 min,再加70%的甲醇溶液10 mL,充分振摇5 min,转移至250 mL分液漏斗中,静置20 min,分液;再向上层液加入70%的甲醇溶液10 mL,重复提取一次,合并两次下层提取液,以0.09 MPa 72 ℃旋蒸浓缩至约1 mL,收集浓缩液,并用甲醇定容至2 mL,用于福林酚法测定。
1.2.2.2 提取茶叶籽壳、仁及油粕中茶多酚 分别取三个产地茶叶籽的壳、仁、压榨法所得油粕、浸出法所得油粕和索氏抽提所得脱脂茶叶籽仁粉各5 g,分别置于50 mL离心管中,加入预热至70 ℃的70%的甲醇溶液10 mL,于70 ℃水浴锅中提取10 min,5 min振荡一次,然后以6000 r/min离心5 min,分离上层清液;重复上述提取步骤,每个样品提取三次,合并提取液[15],过膜,用于HPLC法测定。
分别取三个产地茶叶籽的壳、仁、压榨法所得油粕、浸出法所得油粕和索氏抽提所得脱脂茶叶籽仁粉各0.5 g,重复上一段所述提取操作,合并提取液,用于福林酚法测定。
1.2.3 茶多酚和儿茶素测定
1.2.3.1 福林酚法测茶多酚 参照GB/T 31740.2-2015茶制品第2部分:茶多酚附录A使用茶多酚做对照品进行测定,将提取的茶多酚样品与福林酚试剂反应1 h,以6000 r/min离心10 min再测定。
1.2.3.2 福林酚法检出限和精密度 分别配制5~100 μg·mL-1的茶多酚和没食子酸标准工作液,按福林酚法测定得到两条标准曲线,以扣除空白吸光度值为0.01时对应的浓度作检出限[16]。取10 μg·mL-1的茶多酚和没食子酸溶液按福林酚法平行测定6次,计算RSD值。
1.2.3.3 HPLC法测儿茶素类 参照GB/T 31740.2-2015茶制品第2部分:茶多酚附录B,修改流动相梯度洗脱程序,色谱条件如下:
流动相A:分别将90 mL乙腈,20 mL冰乙酸,2 mL EDTA-2Na溶液加入1 L定容瓶中,用水定容至刻度,摇匀,过0.45 μm膜;流动相B:分别将800 mL乙腈,20 mL冰乙酸,2 mL EDTA-2Na溶液加入1 L定容瓶中,用水定容至刻度,摇匀,过0.45 μm膜;洗脱程序:0~10 min流动相A比例100%,10~30 min流动相A降至60%,30 min后流动相A恢复至100%,至35 min结束;流速1 mL/min;进样量10 μL;检测器:紫外检测器;检测波长:278 nm;柱温:35 ℃。
1.2.3.4 HPLC法检出限和精密度 将儿茶素类标准液稀释至HPLC峰高信号接近噪音值,以3倍信噪比对应浓度作方法检出限。取200 μg·mL-1的标准液平行测定6次,计算各儿茶素的RSD值。
1.2.3.5 福林酚法干扰物质分析 取维生素E 0.5 g,置于250 mL具塞三角瓶中,加入15 mL正己烷,充分振摇3 min,再加70%的甲醇溶液10 mL,充分振摇5 min,转移至250 mL分液漏斗中,静置20 min,分液;再向上层液加入70%的甲醇溶液10 mL,重复提取一次,合并两次下层提取液,以0.09 MPa 72 ℃旋蒸浓缩至约1 mL,收集浓缩液,并用甲醇定容至2 mL;配制20 μg·mL-1的BHA、BHT和TBHQ甲醇溶液,按福林酚法测定这4个样品的吸光度值。
1.2.4 测定方法重现性实验
1.2.4.1 茶多酚精炼油胶体制备 精确称取0.01 g茶多酚,用乙醇溶解并定容至200 mL,配得0.05 g·L-1的茶多酚乙醇溶液。分别称取3份100 g茶叶籽精炼油,加热至75 ℃,分别加入0.05 g·L-1茶多酚乙醇溶液8、12、16 mL,充分搅拌后,放入旋转蒸发仪,以0.09 MPa 72 ℃旋蒸除去乙醇,旋蒸至冷凝管无液滴流下,再旋蒸0.5 h,制得4、6、8 mg·kg-1茶多酚精炼油胶体,将样品转移至玻璃瓶中待用。
1.2.4.2 福林酚法和HPLC法重现性 取6份厂家提供的茶叶籽毛油,以福林酚法测茶多酚含量,根据6份茶叶籽毛油茶多酚含量计算RSD值。再取6份厂家提供的茶叶籽毛油,以HPLC法测定儿茶素类含量,计算各儿茶素RSD值。
取5 g茶叶籽精炼油以福林酚法测吸光度值作空白,再分别取6份4、6、8 mg·kg-1茶多酚精炼油胶体,以福林酚法测茶多酚含量,计算回收率和4、6、8 mg·kg-1茶多酚精炼油胶体的RSD值。
1.3 数据处理
用Excel 2016分析实验数据,计算RSD值,用Origin 9.0作图。
2 结果与分析
2.1 测定方法的线性范围、检出限和精密度
2.1.1 福林酚法测茶多酚 由表1得以茶多酚对照品和没食子酸作标准曲线的检出限分别为0.149和0.153 μg·mL-1;RSD值分别为1.19%和0.72%,可知实验方法精密度较好,符合实验测定要求。采用茶多酚对照品所得标准曲线与按照GB/T 31740.2-2015附录A中采用没食子酸所得标准曲线不一致,同一样品吸光度值经茶多酚标准曲线计算得到的含量较没食子酸标准曲线所得含量更高。本文以茶多酚对照品所作标准曲线计算茶多酚含量。

表1 茶多酚的线性范围、线性方程、相关系数、检出限和精确度Table 1 Liner ranges,liner equations,correlation coefficients,LODs and precision for tea polyphenols determination
2.1.2 HPLC测儿茶素类 按GB/T 31740.2-2015附录B方法配制10~400 μg·mL-1标准工作液,经测定得五个儿茶素的标准曲线,数据见表2;可知各儿茶素检出限和方法精密度符合测定要求。

表2 儿茶素类的线性范围、线性方程、相关系数、检出限和精确度Table 2 Liner ranges,liner equations,correlation coefficients,LODs and precision for catechins determination
2.2 福林酚法和HPLC法对比
2.2.1 福林酚法测茶多酚含量和HPLC测儿茶素类总量 从表3测定结果可知:同一样品经福林酚法测得茶多酚含量和HPLC法测得儿茶素总含量,茶多酚含量大于儿茶素总含量的10倍。福林酚法测定原理是:在碱性条件下,W6+氧化多酚,得到蓝色的W5+,反映茶多酚含量,但易受其他物质干扰。HPLC法通过标准物质保留时间定性和峰面积定量测定目标物质及其含量,精确度较福林酚法高。色谱图如图1所示。
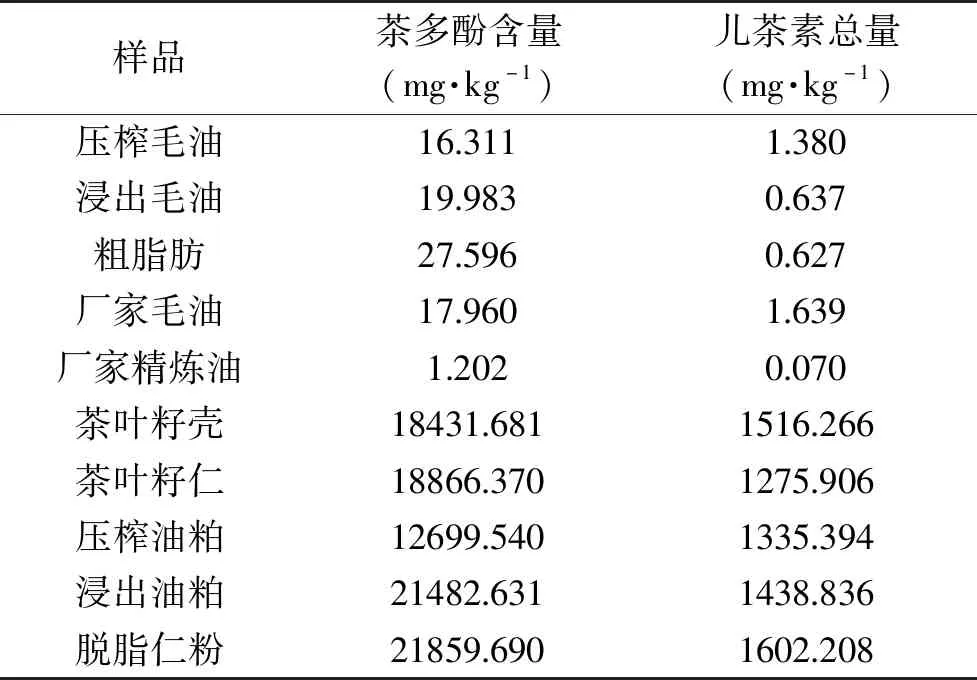
表3 茶叶籽油、茶叶籽和油粕中茶多酚含量和儿茶素总量Table 3 Contents of tea polyphenols and catechins in tea seed oil,tea seed and oil cakes
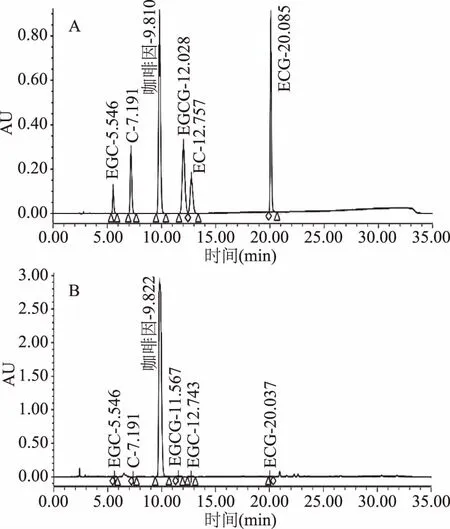
图1 儿茶素标准品(A)和样品(B)色谱图Fig.1 The chromatography of catechin standard(A)and sample(B)
2.2.2 福林酚法干扰物质分析 由表4可知,维生素E、BHA、BHT和TBHQ是含酚羟基的脂溶性物质,在福林酚法测茶叶籽油中茶多酚时均可产生干扰。按茶多酚对照品制作的标准曲线公式换算,对应的茶多酚含量为5.877、4.242、4.440和4.889 mg·kg-1。维生素E为油脂伴随物质,在测定茶叶籽毛油和精炼油中茶多酚含量时可产生干扰;BHA、BHT和TBHQ为常用的食用油抗氧化剂,对测定茶叶籽精炼油中茶多酚含量可产生干扰。油脂中除维生素E外,可能存在其他含酚羟基物质,因此,以福林酚法测茶叶籽油中茶多酚时,不能排除这些物质对测定结果的干扰。

表4 福林酚法测得维生素E、BHA、BHT和TBHQ的吸光度值Table 4 Absorbance values of vitamin E,BHA,BHT and TBHQ were measured by Folin phenol method
2.3 两种方法测定茶多酚含量的重现性
2.3.1 福林酚法测定茶多酚含量的重现性 由表5得RSD值为7.21%,重现性差。GB/T 31740.2-2015附录A要求样品提取液与10%福林酚试剂反应后室温静置1 h后进行测定,验证福林酚法稳定性,取茶叶籽壳提取液按照福林酚法反应后,每10 min测一次吸光度值,反应液吸光度值变化如图2所示,60 min后吸光度值稳定,90 min后略微增加;样品提取液与10%福林酚试剂反应后60~90 min内能完成一批样品测定,则各样品测定先后顺序不影响实验结果准确性和一致性。
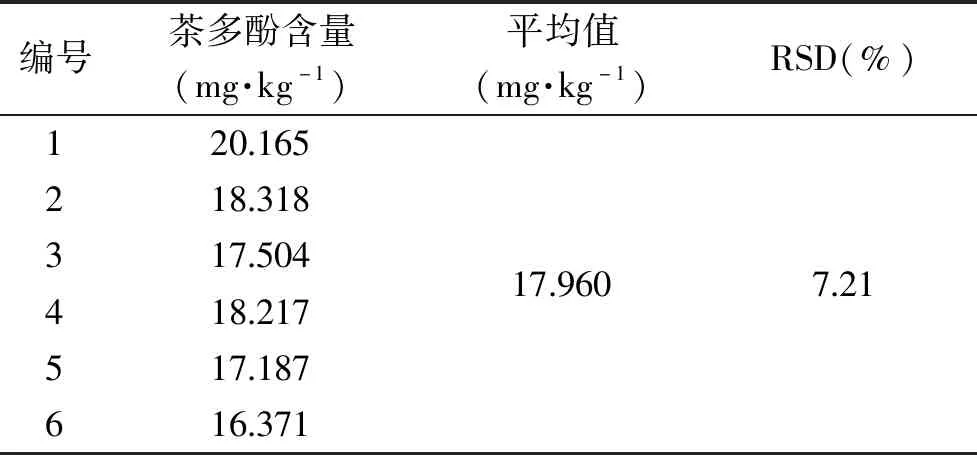
表5 福林酚法测茶叶籽毛油茶多酚含量重现性Table 5 Reproducibility of Folin phenol method for determination of tea polyphenols content in tea seed oil
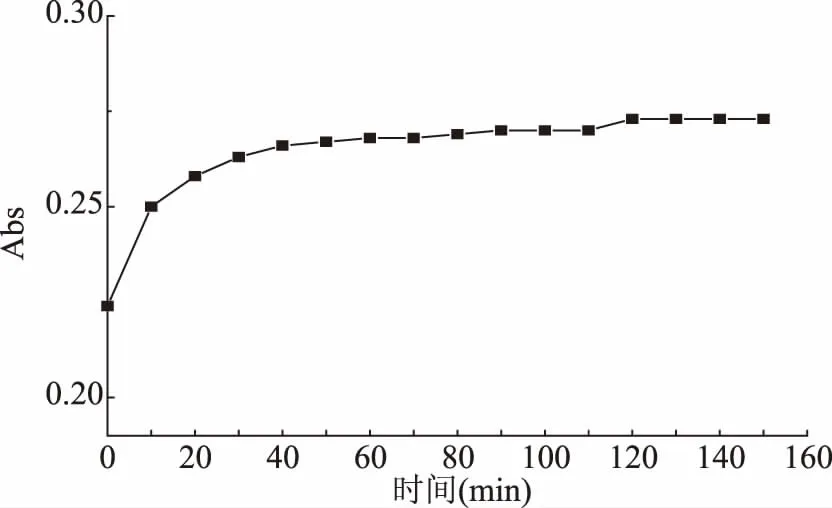
图2 福林酚法样品稳定性Fig.2 Stability of sample measured by Folin phenol method
2.3.2 HPLC法测定儿茶素类含量的重现性 结果如表6所示,各儿茶素的RSD值不同,其中EGCG和ECG重现性差,但儿茶素总含量重现性较好,可满足测定要求。

表6 HPLC法测茶叶籽毛油儿茶素类含量重现性Table 6 Reproducibility of HPLC for determination of catechins content in tea seed oil
2.3.3 以福林酚法测定茶多酚精炼油胶体中茶多酚的回收率和重现性 如图3所示,1号样品是茶多酚精炼油胶体,2号样品是茶叶籽精炼油;制备的茶多酚精炼油胶体在一段时间内澄清透明,不产生沉淀,一束光穿过产生丁达尔效应,表明茶多酚呈纳米级或准纳米级晶体均匀分布于茶叶籽精炼油内。

图3 茶多酚精炼油胶体丁达尔效应Fig.3 Tyndall phenomenon of tea polyphenol colloid
用福林酚法测茶多酚精炼油胶体中茶多酚含量,以茶叶籽精炼油作空白,可扣除福林酚法干扰。精炼油胶体中茶多酚的回收率和重现性测定结果如表7所示,3个加标量平行测定6次的回收率为90.97%~109.00%,可知本实验预处理方法和测定方法可信度较好。测定茶多酚精炼油胶体中茶多酚含量重现性较好,3组实验样品RSD值均小于3%;与表5福林酚法测茶叶籽毛油中茶多酚含量和表6 HPLC法测茶叶籽毛油中儿茶素类含量数据对比,可知茶叶籽毛油中茶多酚分布不均匀。
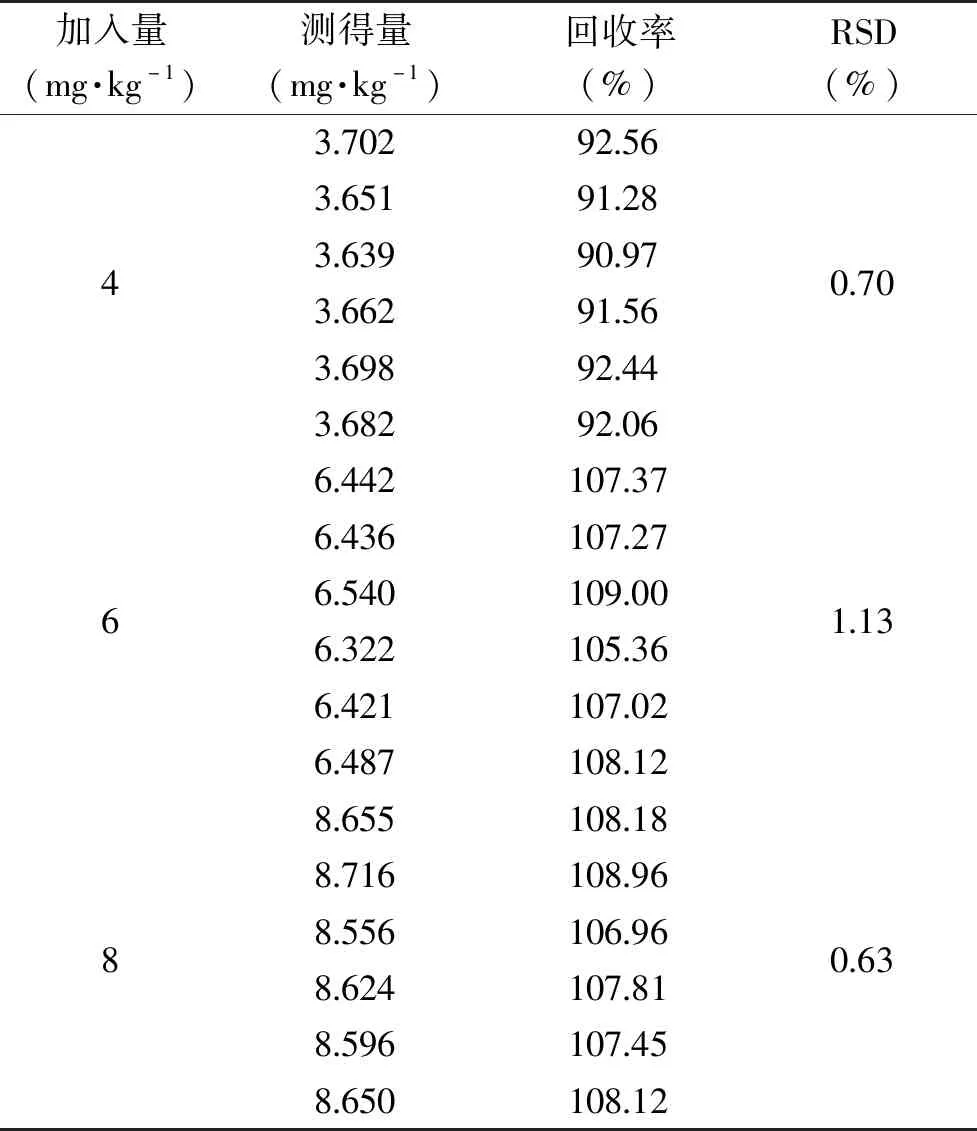
表7 福林酚法测茶多酚精炼油胶体中茶多酚含量回收率和重现性Table 7 Reproducibility and recovery rate of Folin phenol method for determination of tea polyphenols content in tea polyphenol colloid
3 结论
以福林酚法测得茶叶籽毛油中茶多酚含量为16.311~27.596 mg·kg-1,按60%~80%计算所含儿茶素总含量,远超HPLC法测得儿茶素总含量0.627~1.639 mg·kg-1。茶叶籽油中维生素E和带有酚羟基的油脂抗氧化剂对福林酚法测油脂中茶多酚产生干扰,因此,福林酚法不适用于测定油脂中茶多酚含量。
以福林酚法测茶叶籽毛油中茶多酚含量重现性较差;HPLC法测茶叶籽毛油中单一儿茶素重现性差,但测儿茶素总含量重现性较好。用福林酚法测精炼油胶体茶多酚含量,因茶多酚分布均匀,重现性较HPLC法测儿茶素总含量更好。回收率实验中,三组实验样品回收率为90.97%~109.00%,可知本实验中预处理方法和测定方法可信度较好。实验结果证明茶叶籽毛油中茶多酚能以相对稳定状态存在,但分布不均匀。
