杀草丹半抗原及其人工抗原的制备与鉴定
2019-09-11蔡陈芳周常义杨名平苏国成
蔡陈芳,周常义,曾 磊,江 锋,杨名平,苏国成,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.厦门中集信检测技术有限公司,福建厦门 361100)
杀草丹(Thiobencarb)是由日本组合化学公司在上世纪70年代开发的一种具有选择性、内吸传导性除草剂,属于硫代氨基甲酸酯类农药,其化学名为S-(4-氯苄基)-二乙基硫代氨基甲酸酯,中文别名为禾草丹、灭草丹、稻草完,分子式为C12H16ClNOS,结构式如图1所示[1]。杀草丹既可单独用于作业,也可与其它农药试剂混合配制使用,广泛应用在稻麦田、蔬菜田和果园中防除多种杂草。早期,杀草丹农药残留量的检测主要集中在谷物类和蔬菜类产品上。杀草丹农药残留对水生生物、动物机体有显著的毒害作用,并可通过食物链富集对人类健康造成影响[2-5]。近些年来,关于动物源食品中杀草丹农药残留检出限量普遍受到各国的重视。部分国家对于植物源或动物源食品中杀草丹农药残留检出限量值的要求如表1所示[6]。
图1 杀草丹化学结构式Fig.1 Chemical structural formula of thiobencarb

表1 部分国家地区对于植物源和动物源食品中杀草丹农药残留的检出限量值Table 1 Determination limits of thiobencarb residue for food of plant or animal origin in some countries
当前,针对杀草丹农药残留量检测使用的方法主要是气相/液相色谱法[7-8]和气相/液相色谱-质谱联用[9-10],而使用免疫分析方法作为检测手段的文献资料较少。Robert等[11]研究一小部分硫代氨基甲酸类农药与三嗪类农药半抗原的设计要点,为获取高质量特异性抗体提供资料参考。Shiro 等[12]合成了一种杀草丹半抗原并制备出单克隆抗体,利用竞争性酶联免疫法对谷物和水质中杀草丹农药残留量进行检测。
免疫分析方法的建立,关键技术在于能获取到特异性强的抗体[13]。要实现这一目标,前提条件就得合成制备出合适的人工抗原。杀草丹化学结构稳定,直接进行修饰引入活性基团形成半抗原所需反应条件较为剧烈、苛刻[14]。为使分子结构中氯苯环最大限度的暴露出来,本研究利用乙基羟乙胺、升华硫、一氧化碳气体、对氯氯苄和琥珀酸酐等原材料,借鉴羰基化法,通过两步化学反应合成杀草丹半抗原,进而偶联载体蛋白制备出具有免疫原性的杀草丹人工抗原,为下一步动物免疫实验获取抗体奠定基础。
1 材料与方法
1.1 材料与仪器
乙基羟乙胺、升华硫、对氯氯苄、无水碳酸钾、无水吡啶、考马斯亮蓝G250、乙酸乙酯、石油醚、乙腈(色谱级)、溴化钾粉末(光谱级) 均为分析纯(除特殊标注外),国药集团;琥珀酸酐、N,N-二甲基亚酰胺(DMF)、N,N-二环己基碳二亚胺(DCC)、N-羟基琥珀酰亚胺(NHS)、牛血清白蛋白(BSA) Aladdin公司;杀草丹原药(纯度≥98%) 武汉拉那白医药化工有限公司;一氧化碳气体 厦门空分特气实业有限公司;柱层析硅胶(300~400目) 青岛市基意达硅胶试剂厂;GF254硅胶板 青岛海洋化工有限公司。
HH-4数显恒温水浴锅 东莞市普标实验科技有限公司;3-30KS冷冻离心机 德国SIGMA公司;VR10旋转蒸发仪、C-MAG MS7磁力搅拌器 德国IKA公司;高效液相质谱联用仪 美国WARIAN公司;Nicolet iS 50傅里叶变换红外光谱仪 美国Thermo Scientific公司;UV-1800型紫外可见分光光度计 岛津公司;F97 Pro荧光分光光度计 上海棱光技术有限公司;Milli-Q Reference超纯水仪 苏州赛恩斯仪器公司。
1.2 实验方法
1.2.1 溶液配制 羟基化杀草丹溶液配制:称取0.0100 g羟基化杀草丹样品,用色谱级乙腈稀释定容至10 mL,其浓度为1 mg/mL;用乙腈稀释该溶液,配制所需浓度溶液,贮藏于4℃冰箱备用。
杀草丹半抗原溶液配制:称取0.0100 g杀草丹半抗原样品,用色谱级乙腈稀释定容至10 mL,其浓度为1 mg/mL;用乙腈稀释该溶液,配制所需浓度溶液,贮藏于4 ℃冰箱备用。
磷酸盐缓冲液(0.01 mol/L)配制:称取8.00 g氯化钠、2.92 g十二水磷酸氢二钠、0.20 g磷酸二氢钾、0.20 g氯化钾于1000 mL烧杯中,加入900 mL超纯水溶解,并用盐酸溶液调节pH=7.40,最终用超纯水定容至1000 mL,置于4℃冰箱中备用。
牛血清蛋白BSA溶液配制:用pH=7.40、0.01 mol/L磷酸盐缓冲溶液配制浓度为5 mg/mL牛血清蛋白BSA溶液,贮藏于4 ℃冰箱备用。
考马斯亮蓝G250染液配制:称取0.1000 g考马斯亮蓝G250,溶于50 mL 95%的乙醇后,再加入100 mL 85%的磷酸,用超纯水稀释至1000 mL,过0.45 μm滤纸,染液分装于500 mL棕色瓶中。
1.2.2 杀草丹半抗原合成路线 实验以乙基羟乙胺、升华硫、一氧化碳气体和对氯氯苄为原材料,通过化学反应合成羟基化杀草丹;然后在吡啶溶液中与琥珀酸酐反应,制备杀草丹半抗原[15-16]。杀草丹半抗原的合成路线如图2。

图2 杀草丹半抗原合成路线Fig.2 Synthesis of thiobencarb hapten注:1:羟基化杀草丹;2:杀草丹半抗原。
1.2.2.1 羟基化杀草丹合成 称取0.96 g升华硫、3.85 g无水碳酸钾,移取2 mL乙基羟乙胺、15 mL N,N-二甲基甲酰胺溶液于500 mL两口圆底烧瓶内,并将其置于45 ℃水浴锅中反应。同时将一氧化碳气体通入圆底烧瓶中,维持瓶中压力大约0.1 MPa,化学反应进行6 h。称取3.24 g对氯氯苄晶体溶于5 mL N,N-二甲基甲酰胺溶液,将该溶液缓慢滴加入圆底烧瓶,20 min滴毕后,让反应体系保温反应2 h。
反应结束,往圆底烧瓶加100 mL超纯水溶解稠状深褐色反应产物,用60 mL乙酸乙酯萃取水溶液三次,收集有机相,用5 g无水硫酸镁去除有机相溶液中水分,并过0.45 μm滤纸,用旋转蒸发仪浓缩滤液。用25 mL甲醇溶解30 g柱层析硅胶粉末,填充层析柱。配制比例为2∶3的乙酸乙酯-石油醚洗脱液,对浓缩滤液过柱进行洗脱、分离。将收集洗脱物蒸发浓缩得到橙黄色浓稠物,贮藏于4℃冰箱备用。
1.2.2.2 羟基化杀草丹的鉴定 应用薄层层析色谱法分析鉴定该合成产物,用毛细管吸取微量产物样液和杀草丹原药,在硅胶板上点样,放入层析缸中,以三氯甲烷-甲醇(体积比9∶1)混合溶液为展开剂,待溶剂达到硅胶板前言时,取出硅胶板自然条件下晾干,计算产物和杀草丹原药各自比移值Rf,比移值计算公式如下。

应用质谱法分析鉴定该合成产物,取溶解于0.1%甲酸-乙腈溶液中浓度为10 μg/mL羟基化杀草丹溶液进样分析,进样流速为0.2 mL/min,选择ESI正离子模式,电喷雾电压3000 V,毛细管电压为40 V,离子源温度105 ℃,辅助气温度350 ℃,碰撞气为氩气,进行一级质谱扫描和二级质谱扫描,分别获取母离子质荷比与子离子质荷比。
1.2.2.3 杀草丹半抗原合成 称取0.8350 g羟基化杀草丹、1.2080 g琥珀酸酐于250 mL圆底烧瓶中,加入5 mL无水吡啶,将烧瓶置于50 ℃水浴锅中进行反应12 h,保持烧瓶处于轻微振荡状态。室温下氮吹去除无水吡啶,烧瓶中加入10 mL 5%盐酸溶液溶解反应产物,用60 mL乙酸乙酯分两次萃取,收集有机相[17]。用5 g无水硫酸镁粉末去除有机相中水分,过0.45 μm滤纸。40 ℃水浴中氮吹浓缩过滤后的有机相液体,收集晶体物质。用乙酸乙酯二次结晶纯化反应产物,最后干燥反应物,贮藏于4 ℃冰箱备用。
1.2.2.4 杀草丹半抗原的鉴定 应用质谱法分析鉴定该合成物质,取溶解于0.1%甲酸-乙腈溶液中浓度为10 μg/mL杀草丹半抗原溶液进样分析,进样流速为0.2 mL/min,选择ESI负离子模式,电喷雾电压3000 V,毛细管电压为60 V,离子源温度105 ℃,辅助气温度350 ℃,进行一级质谱扫描,获取母离子质荷比。
应用红外光谱法中KBr 压片法分析鉴定该合成物质,红外光谱扫描仪运行参数设置:分辨率为4 cm-1,透光率范围为0~100% T,波数范围为4000~400 cm-1。具体操作方法:采集0.2000 g纯KBr粉末压片的背景红外光谱,扫描0.2000 g纯KBr粉末和0.2000 g合成物质研磨混合压片样品,获取图谱信息,通过特征基团振动频率分析,判断合成物质是否含有羧酸基团。
1.2.3 杀草丹人工抗原制备路线 人工抗原的制备采用碳二亚胺法(DCC法)[18-19],抗原中的载体蛋白选用牛血清蛋白BSA。人工抗原制备路线如图3,先将杀草丹半抗原与N-羟基琥珀酰亚胺、N,N-二环己基碳二亚胺进行反应,获得活性酯,然后再与载体蛋白偶联,制备人工免疫抗原。

图3 杀草丹人工抗原制备路线Fig.3 Synthesis of artificail thiobencarb antigen
1.2.3.1 杀草丹人工抗原的制备 称取0.2 mmol杀草丹半抗原、0.0230 g(0.2 mmol)N-羟基琥珀酰亚胺于100 mL烧杯中,加入2 mL N,N-二甲基甲酰胺溶液,置于26 ℃室温下振荡15 min,溶解反应物质。接着加入0.25 mmol N,N-二环己基碳二亚胺,26 ℃室温下振荡过夜,反应时间达10 h。反应结束,将反应产物离心处理(5000 r/min,5 min),收集上清活性酯液,沉淀物用0.5 mL N,N-二甲基甲酰胺溶液洗涤1次,离心合并上清液。
1.2.3.2 杀草丹人工抗原的鉴定 配制系列浓度梯度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的牛血清蛋白溶液和系列浓度梯度为10、25、50、100、200、250 μg/mL杀草丹半抗原溶液,采用紫外可见分光光度计扫描,测定方式选择吸光值,峰值检测阈值为0.001,扫描速度为中速,确定牛血清蛋白溶液和杀草丹半抗原溶液的最大吸收波长。再设置紫外扫描波长范围200~400 nm,对杀草丹半抗原溶液、牛血清蛋白溶液和杀草丹人工抗原溶液进行光谱扫描,观察对比三种溶液吸收峰,初步判断人工抗原制备情况。
应用荧光光谱法分析鉴定制备的杀草丹人工抗原,设置激发波长为278 nm,激发宽带10 nm,发射波长起止范围200~900 nm,对一定浓度的杀草丹半抗原溶液、牛血清载体蛋白溶液和人工抗原溶液进行荧光光谱扫描,观察对比三种溶液荧光光谱,进一步判断人工抗原制备情况。
1.2.3.3 反应温度对杀草丹人工抗原制备的影响 将一只装有10 mL 5 mg/mL牛血清蛋白BSA溶液的烧杯置于26 ℃室温条件下,往烧杯溶液中滴加入上清活化酯液;将另一只装有10 mL 5 mg/mL牛血清蛋白BSA溶液的烧杯置于冰浴槽内,也往烧杯溶液中滴加入等量的上清活化酯液。磁力搅拌状态下反应8 h。在冰浴和26 ℃室温条件下各做3组平行试验。结束反应后,将反应物全装入经前处理过的透析袋中,置于4 ℃环境下,用磷酸盐缓冲液透析72 h,每8 h更换一次约400 mL的透析液,将获得的人工抗原溶液分装、保存于-20 ℃冰箱备用。
1.2.4 杀草丹人工抗原浓度的测定方法 参考人工抗原合成相关研究[20],通过测定人工抗原中蛋白质浓度,近似估算为人工抗原的浓度。采用考马斯亮蓝法测定人工抗原中蛋白质含量[21]。以牛血清蛋白BSA溶液浓度为横坐标、其吸光度值为纵坐标的蛋白质浓度标准曲线,然后依据标准曲线计算出人工抗原中蛋白质的含量。通过对数据进行线性回归拟合处理,得到了牛血清蛋白BSA浓度标准曲线的线性回归方程式,即Y=10.125X+0.0081(Y为吸光度,X为牛血清蛋白浓度(mg/mL),R2=0.9994),吸光度符合线性要求。
1.2.5 杀草丹人工抗原偶联比计算方法 采用紫外分光光度计对杀草丹半抗原溶液、牛血清载体蛋白溶液和人工抗原溶液进行200~600 nm波长的紫外光谱扫描,观察三种物质溶液吸收峰的变化,根据紫外吸收光谱图初步判断杀草丹半抗原是否与牛血清载体蚕白偶联成功,并运用以下公式计算人工抗原中半抗原与载体蛋白的偶联比[22]。
偶联比计算公式为:

1.3 数据处理
实验中获取的相关数据,采用Microsoft Office Excel 2007软件处理与计算;红外、荧光、紫外等光谱图的绘制利用Origin Pro 8.0软件完成。
2 结果与分析
2.1 羟基化杀草丹的合成及鉴定
羟基化杀草丹样品液与杀草丹原药溶液经薄层层析鉴定,结果图4所示。杀草丹原药溶液(点X1)和羟基化杀草丹样品液(点X2)在点板后均只获得一个明显的黄颜色扩展点,测得杀草丹原药溶液(点X1)比移值Rf=0.29和羟基化杀草丹样品液(点X2)比移值Rf=0.35。杀草丹原药纯度大于98%,其薄层层析扩展良好,扩展点唯一且清晰明显,而羟基化杀草丹样品液薄层层析扩展与其对比,该扩展点也清晰显现,表明羟基化杀草丹样品液分离纯化达到一定要求。

图4 杀草丹原药(X1)与羟基化杀草丹(X2)薄层层析图谱Fig.4 The TLC spectrum of thiobencarb(X1) and hydroxyated thiobencarb(X2)
羟基化杀草丹的分子式为C12H16ClNO2S,经过计算得到相对分子质量为273.8。对其样液进行质谱分析,一级质谱全扫描结果如图5所示,在ESI(+)质谱图中的加H分子量为[M+H]=274.1,与计算分子量相符合。在母离子确定条件下,对样液进行二级质谱扫描,结果如图6所示,羟基化杀草丹碎片子离子的质荷比分别为116.0和124.9,与文献资料报道相符[23]。由此可确定该合成产物为羟基化杀草丹。

图5 羟基化杀草丹一级质谱图Fig.5 MS spectrum of hydroxyated thiobencarb

图6 羟基化杀草丹二级质谱图Fig.6 MS/MS spectrum of hydroxyated thiobencarb
2.2 杀草丹半抗原的合成及鉴定
杀草丹半抗原的分子式为C16H20ClNO5S,相经过计算得对分子质量为373.7。采用毛细管法测定杀草丹半抗原的熔点,3次测定结果显示该物质熔程在182~184 ℃,说明合成的杀草丹半抗原晶体物纯度较高、物质稳定性良好。杀草丹半抗原的ESI(-)质谱图如图7所示,对其样液进行一级质谱全扫描,在ESI(-)质谱图中的减H分子量为[M-H]=372.0,与计算分子量相符合,初步判定该合成物为杀草丹半抗原。

图7 杀草丹半抗原质谱扫描图Fig.7 MS spectrum of thiobencarb hapten
杀草丹半抗原样品经红外光谱仪扫描后,获取谱图信息如图8所示。对合成样品物的红外吸收光谱分析结果如表2所示。样品物在3650~3580 cm-1附近出现明显的-OH基团吸收峰和在1850~1660 cm-1附近出现明显-C=O基团吸收峰,这是具有羧酸基团特征吸收频率的表征,在红外光谱中容易辨认[24],其它基团吸收峰也在相应波数附近出现。因此,进一步证明了该合成物为杀草丹半抗原。
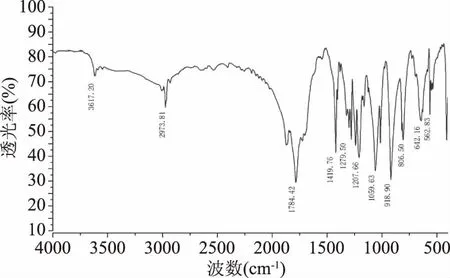
图8 杀草丹半抗原红外扫描谱图Fig.8 IR spectrum of thiobencarb hapten

表2 杀草丹半抗原红外吸收分析表Table 2 IR analysis of thiobencarb hapten
2.3 杀草丹人工抗原的鉴定
2.3.1 牛血清蛋白与杀草丹半抗原紫外光谱中最大吸收波长的确定 采用紫外可见分光光度计分别扫描系列梯度浓度的牛血清蛋白溶液和杀草丹半抗原溶液如图9、图10所示。结果表明,牛血清蛋白最大吸收波长在278 nm、杀草丹半抗原最大吸收波长在221 nm。

图9 牛血清蛋白溶液浓度梯度紫外扫描光谱图Fig.9 Ultraviolet spectrum of the gradient concentration of bovine serum albumin solution
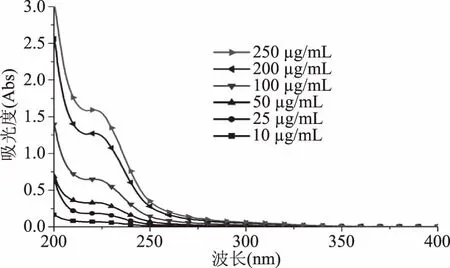
图10 杀草丹半抗原溶液梯度浓度紫外扫描光谱图Fig.10 Ultraviolet spectrum of the gradient concentration of thiobencarb hapten solution
2.3.2 人工抗原紫外可见光谱法分析 采用紫外可见分光光度计对杀草丹半抗原溶液、牛血清蛋白溶液和人工抗原溶液进行光谱扫描,紫外光谱扫描结果可见图11,偶联前杀草丹半抗原在221 nm 处有特征吸收峰,而牛血清载体蛋白在278 nm 处有特征吸收峰,偶联后的人工抗原特征吸收峰出现在260 nm处,明显不同于半抗原和载体蛋白吸收曲线,对比发现其吸收峰发生了偏移,可初步判定牛血清载体蛋白上面偶联上了杀草丹半抗原分子。

图11 杀草丹半抗原、牛血清蛋白和人工抗原紫外扫描光谱图Fig.11 Ultraviolet spectrum of thiobencarb hapten, bovine serum albumin solution and artificial antigen
2.3.3 人工抗原荧光光谱法分析 采用荧光分光光度计对杀草丹半抗原溶液、牛血清载体蛋白溶液和人工抗原溶液进行光谱分析,荧光发射光谱图如图12。从图中可以看出,杀草丹半抗原在扫描波长内没有荧光峰产生;牛血清载体蛋白在340 nm处有荧光峰出现,这与文献[25- 26]报道相一致,由于牛血清蛋白上含有色氨基酸残基,而色氨基酸残基与酪氨酸残基能使蛋白质产生内源荧光,其荧光峰位于341 nm附近;人工抗原在340 nm处的荧光强度明显降低,表明牛血清载体蛋白上偶联了杀草丹半抗原分子,因为杀草丹半抗原是通过与载体蛋白中氨基反应而结合上的,致使载体蛋白上氨基酸残基受到影响[27],进而表现为对牛血清载体蛋白具有一定荧光猝灭作用;同时在560 nm附近产生了新的荧光峰,这可能是杀草丹半抗原分子与牛血清载体蛋白形成的偶合物中有新的共轭体系形成[28],具有一定荧光特性,从而产生新的荧光特征峰。

图12 杀草丹半抗原、牛血清蛋白和人工抗原荧光发射光谱图Fig.12 Fluorescence emission spectrum of thiobencarb hapten,bovine serum albumin solution and artificial antigen
2.3.4 人工抗原中蛋白含量的确定与其偶联比 在冰浴和26℃室温反应温度条件下,制备的杀草丹人工抗原中蛋白质平均浓度分别为(1.963±0.020)和(2.589±0.023) mg/mL。杀草丹人工抗原的偶联比计算结果如表3所示。

表3 不同反应温度下制备的人工抗原偶联比值Table 3 Coupling ratioof artificial antigen prepared under different temperature
由表3可看出,杀草丹人工抗原的偶联比是受反应温度影响的。在26 ℃室温条件下反应获得的杀草丹人工抗原,其偶联比明显高于冰浴条件下反应获得的人工抗原,造成该现象的原因可能是反应温度过低,致使载体蛋白活性下降,并影响载体蛋白空间结构,使载体蛋白上的自由氨基未能充分暴露出来,能够产生偶联作用的点位减少,不利于与活性酯液反应[29]。与此同时,制备的人工抗原偶联比越高大,表明载体蛋白分子上连接上半抗原数目越多,越有利用提高人工抗原的免疫原性[30],因此选择26 ℃室温条件作为制备杀草丹人工抗原的最佳反应温度。
3 结论与讨论
本研究应用薄层层析法和质谱法可准确鉴定羟基化杀草丹合成成功,应用质谱法和红外光谱法可鉴定出杀草丹半抗原成功合成并含有羧酸基团,从而利于后续杀草丹半抗原及杀草丹人工抗原的成功合成。试验结果发现,26 ℃室温条件下制备的杀草丹人工抗原,其紫外可见光谱吸收峰发生了明显蓝移,吸收峰出现在260 nm波长处,异于牛血清蛋白与杀草丹半抗原的吸收峰,其荧光光谱在340 nm处的荧光强度也有显著削弱,并且在560 nm处有新的荧光峰产生,均表明杀草丹人工抗原制备成功;同时该条件下制备出的人工抗原偶联效果较佳,杀草丹半抗原与牛血清载体蛋白的偶联比达6.59∶1,处于适宜偶联比5∶1~25∶1范围内[31]。
试验中研究制备出杀草丹半抗原结构与Shiro等[12]研究制备的杀草丹半抗原结构存在一定的相似特点,即制备出的两种半抗原最大程度上保留了杀草丹分子结构,半抗原上的偶联桥臂均具有3~6个直连碳原子,符合设计要求,可增强杀草丹半抗原与大分子载体蛋白的偶联效率,因此本研究杀草丹半抗原制备方法严格遵循小分子农药半抗原设计合成基本原则,制备杀草丹半抗原的新路径具有可行性。
在人工抗原制备上,目前选用的载体蛋白有牛血清蛋白(BSA)、钥孔血蓝蛋白(KLH)、人血清白蛋白(HAS)、兔血清白蛋白(RSA)、鸡卵清蛋白(OVA)及人工合成的多聚赖氨酸(PLL)等[32]。由于牛血清蛋白具有良好溶解性、理化性质稳定、廉价易得、且自由氨基数量多等优点,故常用作载体蛋白[33]。半抗原偶联上载体蛋白,不仅可增大其自身分子量,还可利用大分子载体蛋白所具有的强免疫原性去刺激、诱导机体发生免疫应答,产生特异性抗体。据研究报道,当前小分子农药半抗原与载体蛋白进行偶联的方法较为多样,有碳二亚胺法、混合酸酐法、琥珀酸酐法、活性酯法、重氮法、戊二醛法、光气法等等,而偶联方法的选择,主要依据半抗原分子上所带活性基团的种类(如-COOH、-OH、-NH2、-SH等)、溶解度、稳定性来决定[34]。试验中合成的杀草丹半抗原具有羧基基团,因此选择操作便捷、反应产率较高的碳二亚胺法进行杀草丹人工抗原制备。
目前国内关于杀草丹人工抗原的制备鲜有报道,市场上相应的免疫分析快速检测试纸条或试剂盒也没有成品销售。本研究中合成制备杀草丹半抗原利用的原材料较易获取、价格便宜,且操作工艺简单,反应条件温和,有益于规模化、产业化生产;制备出的杀草丹人工抗原,可为进一步动物免疫实验获取并筛选出高质量、特异性强的抗体提供参考性技术资料,并推进杀草丹快速免疫分析检测方法的建立。
