人参枳子提取物对小鼠酒精性肝损伤的保护作用
2019-09-11李志满邵紫君李珊珊孙印石
李志满,邵紫君,李珊珊,华 梅,孙印石
(中国农业科学院特产研究所,吉林长春 130112)
酒精性肝病(Alcoholic liver disease,ALD)是由长期过量饮酒或酗酒所引起的肝损伤,包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化[1-2]。目前酒精性肝损伤已成为仅次于病毒性肝炎的第二大类肝病,是发展为肝硬化较为常见的原因。酒精对肝脏的损伤缺乏特异性药物,因此,寻求有效的抗酒精性肝病的药品和食品具有重要的意义。
人参(PanaxginsengC.A.Mey.)是五加科多年生草本植物人参的干燥根及根茎,被证实具有良好的抗癌[3-4]、保护心脑血管系统[5]、保护神经系统[6]和抗衰老[7-8]等活性。近年来的研究表明,人参对各种实验性肝损伤有一定的保护作用[9-10],主要是通过抗氧化、抗炎等作用保护和调节肝功能[11]。枳椇子(HoveniadulcisThunb)为鼠李科拐枣属植物枳椇的种子,具有解酒毒,止呕,清热利尿等功效。有研究表明枳椇子对小鼠过量饮酒导致的酒精性肝损伤有预防作用[12],此外,枳椇子还能够减轻酒精引起的大鼠肝脏脂肪变性及炎症细胞浸润,减少纤维增生[13]。已有研究证实人参和枳椇子合用对小鼠乙醇中毒具有保护作用[14],但两者配伍的研究鲜有报道,并且作用机制等尚未完全明确。
本研究通过建立急性酒精诱导小鼠肝脏损伤模型,观察使用不同配伍比例的人参枳椇子提取物对酒精性肝损伤引起的氧化应激、肝脂质异常沉积、炎症因子释放的影响,检测了小鼠血清和肝脏相关生化指标,探讨人参枳椇子对小鼠肝损伤的预防作用机理,以期为人参和枳椇子的进一步开发利用提供参考依据和理论基础。
1 材料与方法
1.1 材料与仪器
人参 吉林省抚松丰泽农业种植开发有限公司;枳椇子 山东济南秦越人农业发展有限公司;清洁级ICR健康雄性小鼠 50只,体重为20~22 g,辽宁长生生物技术股份有限公司,动物生产许可证SCXK(辽)2015-0001,合格编号211002300023526;无水乙醇 北京化工厂;丙氨酸氨基转移酶(Alanine aminotransferase,ALT)试剂盒、天冬氨酸氨基转移酶(Aspartateaminotransferase,AST)试剂盒、甘油三酯(Triglyceride,TG)、高密度脂蛋白胆固醇(High-density lipoproteins,HDL-C)、低密度脂蛋白胆固醇(Low-density lipoproteins,LDL-C)、丙二醛(Malondialdehyde,MDA)、谷胱甘肽(Glutathione,GSH)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)检测试剂盒和BCA法总蛋白定量测定试剂盒 南京建成生物工程研究所;小鼠TNF-α和IL-1βELISA试剂盒 赛默飞世尔科技有限公司;总RNA提取试剂盒 普洛麦格生物技术有限公司;反转录试剂盒 罗氏公司。
Epoch2型酶标仪 美国博腾仪器有限公司;NanoDrop ND-2000型超微量分光光度计 赛默飞世尔科技有限公司;C1000 Touch PCR仪 美国伯乐公司;EC3型凝胶成像系统 美国UVP公司;DYY-8C型电泳仪电源 北京六一仪器厂;DKT200-4型恒温金属浴 杭州米欧仪器有限公司;MS204S型电子分析天平 瑞士Mettler Toledo公司;XW-80A型微型旋涡混合仪 上海沪西分析仪器厂有限公司;TP-24型快速细胞组织破碎仪 杰灵仪器制造(天津)有限公司。
1.2 实验方法
1.2.1 人参枳椇子提取物的制备 将人参和枳椇子放置于电热恒温鼓风干燥箱中,在60 ℃条件下干燥12 h,分别按质量比1∶1、2∶1和1∶2混合,将干燥的混合物粉碎,过60目筛网,向混合物中加入重量比为8倍量的蒸馏水,浸泡1 h,回流提取1 h,然后以5000 r/min,离心10 min,获得上清液;再向残渣中加入按重量比为5倍量的蒸馏水,回流提取0.5 h,离心,获得上清液,合并两次上清液,将三种水煎液放置于-80 ℃条件下冷冻4 h后,进行冷冻干燥,即为人参枳椇子提取物Ⅰ、人参枳椇子提取物Ⅱ和人参枳椇子提取物Ⅲ,产率分别为23.5%、33.9%和20.6%。采用香草醛-浓硫酸比色法测定提取物中的总皂苷含量分别为4.80%、5.70%和4.72%,以芦丁为标准品采用分光光度法测评黄酮的含量为14.01、10.30和21.39 mg/g。
1.2.2 动物饲养管理 实验动物在控温(22±3) ℃并在相对湿度为55%±15%的环境中饲养,自由进食、饮水适用一周后进行实验。
1.2.3 急性酒精诱导肝损伤模型的建立 ICR小鼠适应一周后随机分为5组,每组10只,即为正常组、模型组、人参枳椇子提取物Ⅰ组、人参枳椇子提取物Ⅱ组和人参枳椇子提取物Ⅲ组。人参枳椇子提取物各组以100 mg/kg·bw的剂量连续灌胃小鼠,正常组及模型组按10 mL/kg·bw灌胃生理盐水,每天灌胃1次,连续灌胃3 d。末次给药30 min后,除正常组外,各组按6 g/kg·bw一次性灌胃50%(v/v)乙醇溶液[15],禁食不禁水,12 h后麻醉摘眼球取血,分离肝脏,肝脏保存于-80 ℃冰箱。
1.2.4 生化指标及炎症因子的测定 各组小鼠取血后,室温静止0.5 h,在4 ℃条件下,以3000 r/min的转速离心30 min,分离得到血清,根据试剂盒说明,检测ALT、AST活力及TG、HDL-C、LDL-C含量。采用ELISA试剂盒检测血清中TNF-α和IL-1β的含量。
1.2.5 肝组织生化指标的测定 肝组织中SOD和GSH-Px的活力及MDA、GSH含量根据试剂盒说明书的方法进行测定。
1.2.6 肝组织中TNF-α,IL-1βmRNA表达水平 根据总RNA提取试剂盒的实验方法提取肝组织中的总RNA,再按照反转录试剂盒说明将分离的RNA逆转录成cDNA,并通过使用表1中所述的基因特异性引物进行RT-PCR,GAPDH的mRNA的表达水平作为内置参数。最后,利用含有溴化乙锭的琼脂糖凝胶电泳观察PCR扩增产物。

表1 实时定量PCR 反应引物序列Table 1 Sequences of primers for RT-PCR amplification
1.3 数据处理
2 结果与分析
2.1 人参枳椇子提取物对小鼠血清转氨酶活力的影响
ALT和AST活力升高是反映肝细胞损伤的重要指标,因此,检测血清中ALT和AST的活性能准确反映早期酒精性肝损伤的程度[16]。如图1所示,与正常组小鼠相比,模型组小鼠血清中ALT和AST活力均极显著升高(p<0.01),说明酒精引起了小鼠肝细胞受损;与模型组小鼠比较,人参枳椇子提取物Ⅰ和Ⅲ显著降低血清中ALT的水平(p<0.05),人参枳椇子提取物Ⅱ极显著降低ALT的水平(p<0.01),且人参枳椇子提取物Ⅰ可显著降低AST的水平(p<0.05),人参枳椇子提取物Ⅱ和Ⅲ极显著降低了AST的水平(p<0.01)。以上结果表明人参枳椇子提取物对酒精致小鼠急性肝损伤具有一定的保护作用。
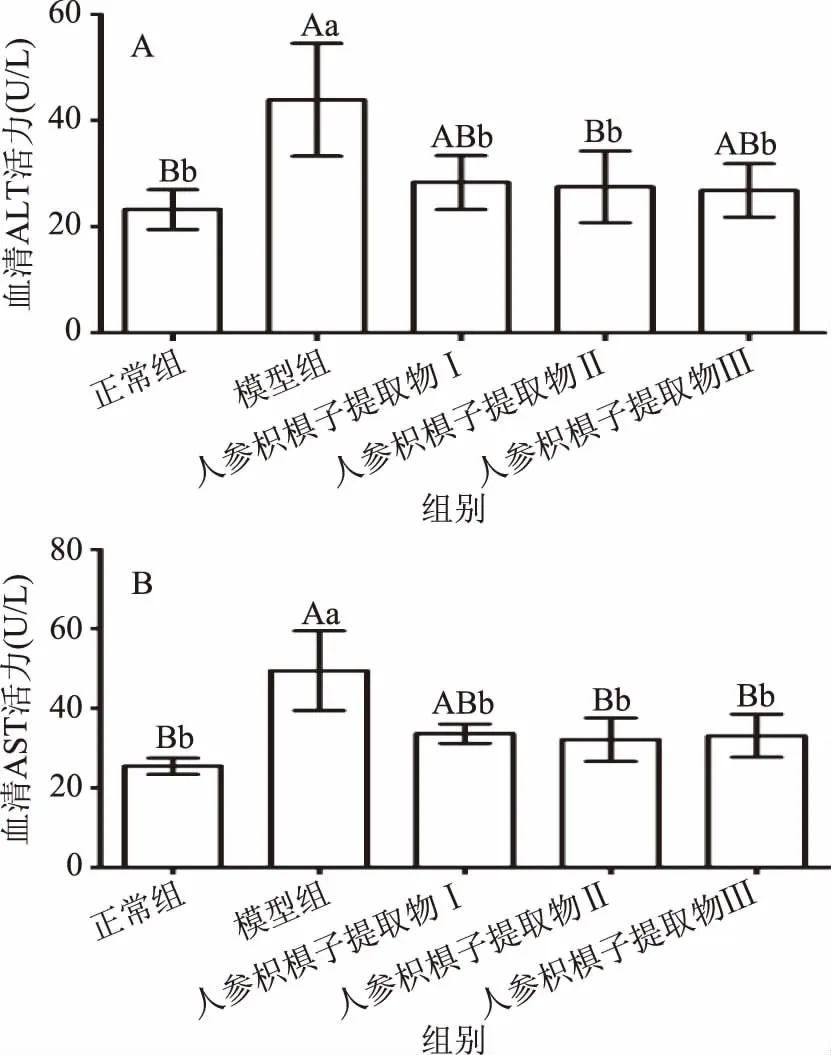
图1 人参枳椇子提取物对小鼠血清ALT和AST的活力的影响Fig.1 Effect of PHE on the activities of serum ALT and AST in mice注:不同小写字母为显著差异(p<0.05), 不同大写字母为差异极显著(p<0.01);相同字母为差异不显著(p>0.05);图2~图4同。
2.2 人参枳椇子提取物对小鼠血清中脂质代谢水平的影响
酒精进入体内导致脂类物质在肝脏过度沉积,促进肝内脂类物质TG合成增加,脂蛋白的合成及分泌受阻[17]。如图2所示,与正常组小鼠相比,给予小鼠酒精12 h后,模型组小鼠血清中TG和LDL-C含量极显著升高(p<0.01),HDL-C含量显著降低(p<0.05),说明酒精诱发肝脏内脂质代谢紊乱;与模型组小鼠相比,人参枳椇子提取物Ⅰ和Ⅲ显著降低小鼠血清中TG的含量(p<0.05),人参枳椇子提取物Ⅱ极显著降低了小鼠血清中的TG含量(p<0.01);进一步对LDL-C和HDL-C水平检测发现,与模型组比较,除人参枳椇子提取物Ⅱ组外,人参枳椇子提取物Ⅰ和Ⅲ处理组中,小鼠血清中的LDL-C含量显著降低(p<0.05),其中人参枳椇子提取物Ⅲ可显著恢复由酒精引起的HDL-C水平降低(p<0.05)。结果表明,人参枳椇子提取物对酒精引起小鼠肝脏中脂质代谢的紊乱具有良好的缓解作用。

图2 人参枳椇子提取物对小鼠血清TG、LDL-C和HDL-C水平的影响Fig.2 Effects of PHE on the levels of serum TG,LDL-C,and HDL-C in mice
2.3 人参枳椇子提取物对小鼠肝组织抗氧化能力的影响
酒精进入机体中可增加活性氧的水平,降低细胞抗氧化能力,减轻细胞的氧化防御作用,导致氧化应激[18-19]。SOD和GSH-Px是重要的内源性抗氧化酶,是防御氧化损伤的第一道防线[20]。GSH是一种非酶抗氧化物,具有抗氧化作用,可作为直接活性氧的清除剂[21]。MDA是脂质过氧化的产物,可反应体内脂质过氧化反应程度[22-23]。如图3所示,与正常组小鼠比较,模型组小鼠肝组织中抗氧化酶和SOD活力显著降低(p<0.05),GSH-Px的活力和GSH含量极显著降低(p<0.01),MDA含量极显著升高(p<0.01),说明酒精进小鼠入体内后造成了氧化应激;与模型组小鼠比较,人参枳椇子提取物Ⅰ处理组小鼠肝组织中GSH-Px活力显著升高(p<0.05),SOD活力、GSH含量均极显著升高(p<0.01),MDA水平显著降低(p<0.05),人参枳椇子提取物Ⅱ组的小鼠肝组织中GSH-Px、SOD活力和GSH含量显著升高,MDA水平显著降低(p<0.05),人参枳椇子提取物Ⅲ组的小鼠肝组织中GSH-Px活力极显著升高(p<0.01),SOD活力及中GSH的含量显著升高(p<0.05),MDA水平极显著降低(p<0.01)。结果说明人参枳椇子提取物可提高机体抗氧化能力,降低氧化应激水平。
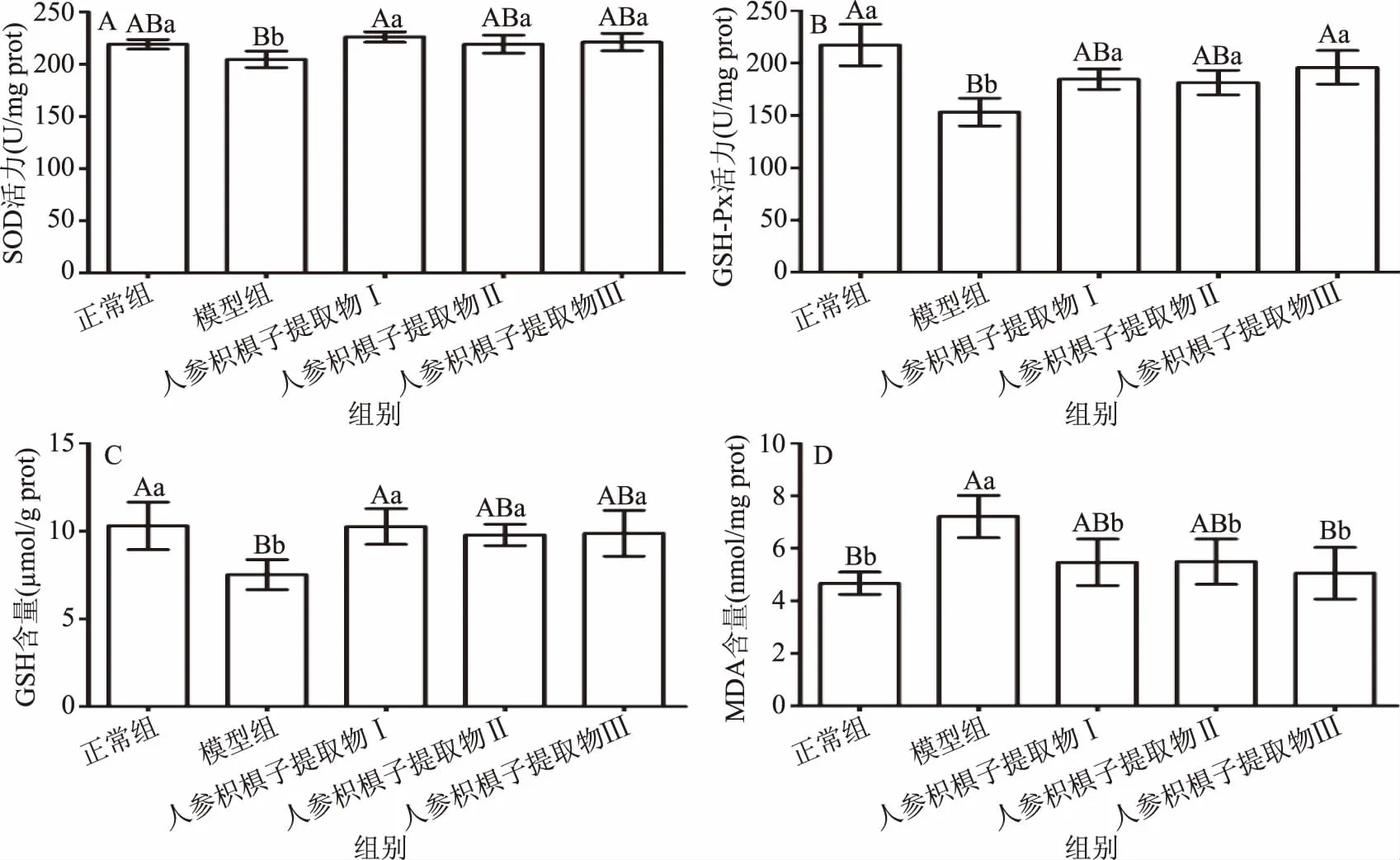
图3 人参枳椇子提取物对小鼠肝组织中GSH-Px、SOD活性和MDA、GSH含量的影响Fig.3 Effects of PHE on GSH-Px,SOD activity and MDA,GSH content of liver tissure in mice
2.4 人参枳椇子提取物对小鼠血清中炎症因子分泌的影响
酒精摄入导致的脂质过度积累引起肝细胞直接或间接损伤,诱发炎症的产生,促炎细胞因子表达增加,TNF-α和IL-1β是两种主要促炎细胞因子[24]。如图4所示,与正常组小鼠相比,模型组小鼠血清中TNF-α和IL-1β分泌量均显著升高(p<0.05),说明两种促炎因子参与了酒精引发小鼠肝损伤过程;与模型组小鼠比较,人参枳椇子提取物Ⅱ和Ⅲ能显著降低IL-1β的含量(p<0.05),人参枳椇子提取物(Ⅰ、Ⅱ、Ⅲ)可以显著下调血清中TNF-α的水平(p<0.05)。结果说明人参枳椇子提取物能够有效抑制TNF-α等促炎症因子的分泌。
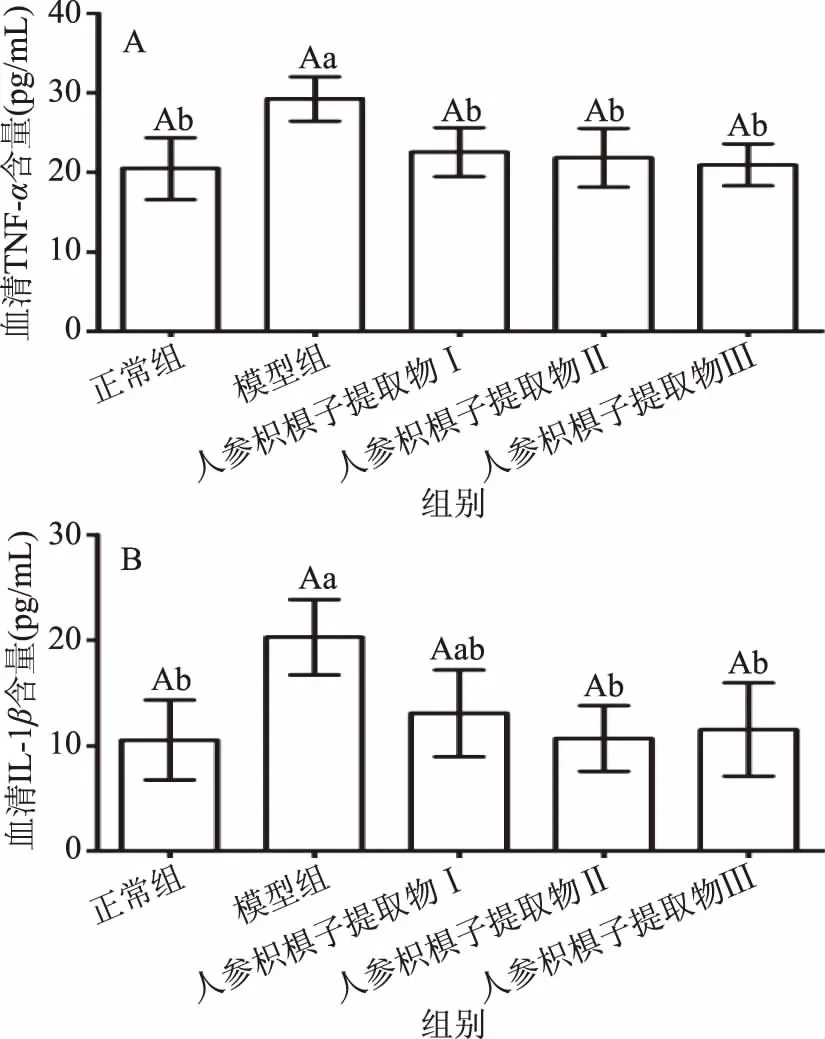
图4 人参枳椇子提取物对小鼠血清中TNF-α和IL-1β含量的影响Fig.4 Effects of PHE on the content of TNF-α and IL-1β in the serum of mice
2.5 人参枳椇子提取物对小鼠肝脏中炎症因子TNF-α和IL-1β mRNA表达的影响
通过RT-PCR检测肝组织中炎症因子TNF-α、IL-1βmRNA的变化情况。如图5所示,与正常组小鼠相比,模型组小鼠肝组织中TNF-α和IL-1βmRNA的表达均显著增强;人参枳椇子提取物Ⅰ、Ⅱ和Ⅲ可抑制TNF-α和IL-1βmRNA表达水平的升高,进一步说明人参枳椇子提取物能够抑制酒精诱导产生的炎症因子的释放。

图5 人参枳椇子提取物对小鼠肝组织中TNF-α和IL-1β mRNA表达的影响Fig.5 Effects of PHE on the expression of TNF-α and IL-1β mRNA of liver tissure in mice
3 结论
酒精性肝病是慢性肝病的主要原因之一,已有研究报道,酒精性肝病的进展与肝内血清转氨酶异常、肝细胞受损造成细胞内脂质过氧化和炎性浸润等密切相关[25-30]。本实验结果显示人参枳椇子提取物能够明显降低由急性酒精摄入引起的ALT、AST活力升高,表明人参枳椇子提取物通过修复和维持肝细胞膜的完整性从而抵抗酒精所致的急性肝损伤。人参枳椇子提取物还能够不同程度的降低TG、LDL-C的水平,升高HDL-C的含量,对酒精造成的脂质代谢紊乱有一定的调节作用。此外,人参枳椇子提取物不同程度的升高肝组织中SOD、GSH-Px活力和GSH含量,抑制了脂质过氧化的标志物MDA的产生,增强了机体的抗氧化能力,改善肝组织损伤程度。并且人参枳椇子提取物能够降低由酒精诱导的炎症因子TNF-α、IL-1β水平的升高,增强机体的抗炎能力。在检测的各指标中,人参枳椇子提取物Ⅲ处理组与模型组比较,对减轻血清中转氨酶、肝脏中脂质积累、抑制氧化应激、肝脏炎症均呈现出显著性差异。由以上结果可以说明人参枳椇子提取物对酒精诱导的肝损伤具有一定的保护作用,为进一步开发利用提供依据。
