青稞籽粒富硒发芽条件优化及其抗氧化能力分析
2019-09-11李粟晋韩永斌朱筱玉谢广杰叶明儒
宋 妍,李粟晋,陶 阳,韩永斌,*,朱筱玉,2,*,谢广杰,叶明儒
(1.南京农业大学食品科技学院,江苏南京 210095;2.西藏农牧学院食品科学学院,西藏林芝 860000;3.镇江市智农食品有限公司,江苏镇江 212000)
硒是一种人体必需的微量元素。近年来,有较高生物活性和较低毒性的有机硒受到了人们越来越多的关注[1]。硒对人体健康的作用以硒蛋白和硒氨基酸的形式体现,如硒代蛋氨酸、硒代半胱氨酸和甲基硒代半胱氨酸等,但是它们在食物中的含量通常较低[2]。硒的缺乏会引起大骨节病、克山病、甲状腺功能衰退等一系列相关的疾病,尤其是在土壤普遍缺硒的西藏地区,硒的缺乏已经严重影响了该区居民的健康[3-4]。青稞(HordeumvulgareLinn. var. nudum Hook.f)是无壳大麦的一种,是唯一能在4200~4500 m的高海拔地区生长的农作物,在青藏高原地区拥有最大的种植面积[5],同时青稞也是藏区居民的主要碳水化合物来源。因此开发硒强化青稞食品具有重要意义。曲航等[4]通过研究西藏青稞生产现状和青稞硒含量,建议通过土壤施用硒肥方式生产富硒青稞,并针对富硒青稞生产存在的问题提出了相应的解决措施。然而,文章并没有给出具体的方法,富硒青稞的生产工艺还需进一步研究。
发芽是一种提高谷物营养价值的传统方式,通过发芽可提高谷物中叶酸、γ-氨基丁酸、酚类化合物等生物活性物质的含量[6]。同时,发芽也是谷物富硒的一种有效手段。Lazo-Vélez等[7]通过优化大豆富硒发芽条件发现,添加不同浓度的亚硒酸钠溶液后富硒发芽大豆的总硒含量均显著增加,其总硒含量至少为未富硒发芽大豆的100倍。虽然国内外对大麦、小麦和糙米等谷物材料富硒已有研究[8-10],但对富硒青稞的研究目前还鲜有报道。
酚类物质是青稞的主要抗氧化物质,黄酮醇是酚类物质的一个类别,具有抗氧化、抗病毒和抗癌等特性[11-12]。Gąsecka等[13]研究发现,硒能促进食用白腐菌中酚类化合物和黄酮类化合物的合成,并显著提高其自由基清除能力。β-葡聚糖是青稞重要的生物活性物质,具有降血糖、降血脂、降低血清胆固醇浓度、降低患心脏病风险等功效,但发芽后青稞籽粒中β-葡聚糖含量显著降低[14-15]。目前富硒对青稞籽粒发芽过程中总酚、总黄酮醇和β-葡聚糖含量的影响还鲜有报道。
因此,本文通过研究青稞籽粒发芽过程中发芽时间、培养液pH和亚硒酸钠浓度对青稞有机硒含量的影响,得到最佳青稞籽粒富硒发芽工艺条件。在此基础上,研究青稞籽粒富硒发芽过程中总酚、总黄酮醇、β-葡聚糖、有机硒四类物质含量以及抗氧化能力的变化,以明确外源添加亚硒酸钠对青稞籽粒发芽过程中抗氧化物质含量及抗氧化能力的影响,以期为开发硒强化青稞食品提供一定理论依据。
1 材料与方法
1.1 材料与仪器
青稞(品种藏青2000) 2017年8月采收于西藏自治区林芝市;硒单元素标准溶液(1000 μg/mL) 国家有色金属及电子材料分析测试中心;硝酸(优级纯) 国药集团化学试剂有限公司;盐酸(优级纯) 南京化学试剂股份有限公司;亚硒酸钠、β-葡聚糖标准品 美国Sigma公司;其他试剂 均为分析纯。
隔水式电热恒温培养箱 上海跃进医疗器械有限公司;IKA A11型分析研磨机 德国IKA公司;微波消解系统 美国CEM公司;SA-10原子荧光形态分析仪 北京吉天仪器有限公司;LSHZ-300冷冻水浴恒温振荡器 江苏太仓市实验设备厂;UV5100B型紫外可见分光光度计 上海元析仪器有限公司;GL-20G-Ⅱ高速冷冻离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 青稞籽粒富硒发芽工艺 参考文献[6,16],按如下工艺进行:选种(大小均匀,健康饱满)→消毒(1%次氯酸钠溶液浸泡15 min)→冲洗→浸泡(用亚硒酸钠溶液在25 ℃的条件下浸泡10 h)→发芽(将青稞籽粒均匀铺于垫有两层滤纸的培养皿中,置于25 ℃恒温培养箱中)→冲洗沥干→70 ℃热风干燥→磨粉→过80目筛→置于-18 ℃冰箱保存。
1.2.2 响应面法优化青稞富硒发芽工艺 通过前期预实验的结果并结合文献[9,16],确定三个自变量(发芽时间、培养液pH和亚硒酸钠浓度)的取值范围,以有机硒含量为响应值,应用Design-Expert 8.0.6软件进行中心组合试验设计与优化,响应面试验的因素与水平见表1。
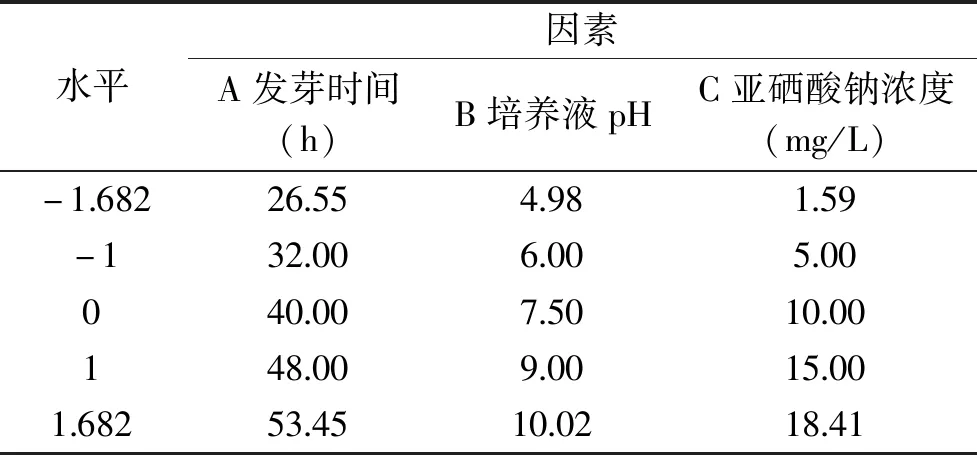
表1 中心组合试验因素及水平Table 1 Test factors and levels of central composite design(CCD)
1.2.3 青稞籽粒发芽过程研究 根据优化得到的最佳工艺条件进行富硒发芽青稞籽粒的培育,并以蒸馏水培养的青稞籽粒为对照,每隔12 h取样,研究青稞籽粒发芽过程中形态和含水率变化。
1.2.3.1 形态 在青稞籽粒发芽过程中,每隔12 h观察青稞籽粒的形态并拍照记录。
1.2.3.2 含水率 在青稞籽粒发芽过程中,每次取出5 g萌发样品,经蒸馏水冲洗后擦干表面水分,置于105 ℃干燥箱中干燥至恒重,计算前后质量差,即得到样品的含水率,计算公式如下:
式中:m1为新鲜发芽样品的质量,g;m0为烘干后的质量,g;W为不同发芽时间下发芽青稞籽粒的含水率,%。
1.2.4 青稞籽粒萌发过程中抗氧化物质变化 根据优化得到的最佳工艺条件进行富硒发芽青稞籽粒的培育,并以蒸馏水培养的青稞籽粒为对照,每隔12 h取样于70 ℃烘箱中烘至恒重,经粉碎过80目筛后于-18 ℃冰箱保存。
1.2.4.1 总酚含量 称取样品0.5 g(精确到0.001 g)于10 mL离心管中,加入5 mL 50%的乙醇溶液,于25 ℃条件下浸提三次,每次1.5 h,浸提过程中不断进行搅拌。离心后合并三次上清液,储存于-18 ℃冰箱。
总酚含量的测定按照Tao等[17]的方法,得到标准曲线方程为:y=0.003x+0.0051,R2=0.9911。其中y为吸光值,x为没食子酸浓度(mg/L)。总酚含量用没食子酸当量表示,即mg GAE/g DW。
1.2.4.2 总黄酮醇含量 按照Cliff等[18]的方法测定1.2.4.1中样品提取液的总黄酮醇含量,得到标准曲线方程为:y=0.4397x-0.0216,R2=0.9956。其中y为吸光值,x为槲皮素浓度(mg/mL)。总黄酮醇含量用槲皮素当量表示,即mg QE/g DW。
1.2.4.3β-葡聚糖含量β-葡聚糖的提取按照Limberger-Bayer等[19]的方法。将干燥后的β-葡聚糖提取物储存于-18 ℃的冰箱。
β-葡聚糖含量的测定参考Nitschke等[20]的方法,并稍作修改。将按上述方法提取出的β-葡聚糖,用蒸馏水溶解并定容至10 mL,制备成β-葡聚糖样品溶液。取2.1 mL样品溶液于离心管中,加入1.8 mL pH为7.0的0.2 mol/L的柠檬酸/氢氧化钠缓冲液和0.3 mL刚果红溶液(将0.08 g刚果红溶解于100 mL缓冲液中),于523 nm处测量吸光值。β-葡聚糖标准曲线方程为:y=0.0001x+0.0043,R2=0.9946。其中y为吸光值,x为β-葡聚糖浓度(mg/L)。β-葡聚糖含量以g/100 g DW表示。
1.2.4.4 有机硒含量 总硒含量测定:按照GB 5009.93-2017《食品中硒的测定》[21]中的第一法氢化物原子荧光光谱法测定样品的总硒含量,总硒含量结果以mg/kg DW(干物质)表示。
无机硒含量测定:按照DB3301/T 117-2007《稻米中有机硒和无机硒含量的测定:原子荧光光谱法》[22]测定样品的无机硒含量,无机硒含量结果以mg/kg DW表示。
有机硒含量:以总硒含量和无机硒含量的差值表示有机硒含量。
1.2.5 萌发过程中青稞籽粒抗氧化能力变化
1.2.5.1 ABTS+自由基清除能力 按照Liang等[23]的方法测定1.2.4.1中样品提取液的ABTS+自由基清除能力,得到标准曲线方程为:y=0.4624x-0.006,R2=0.9984。其中y为抑制率:(1-Asample/Ablank),x为Trolox浓度(mmol/L)。ABTS+自由基清除能力用Trolox当量表示,即μmol TE/g DW。
1.2.5.2 铁离子还原能力(FRAP) 按照Tao等[19]的方法测定1.2.5.1中样品提取液的铁离子还原能力,得到标准曲线方程为:y=0.6101x-0.016,R2=0.9991。其中y为吸光值,x为亚铁离子浓度(mmol/L)。铁离子还原能力(FRAP)用亚铁离子浓度表示,即μmol Fe2+/g DW。
1.3 数据处理
每组实验重复进行3次,采用Design-Expert 8.6软件对响应面试验进行设计和分析,采用Excel 2007对实验数据进行作图及统计分析,通过SPSS 20.0进行显著性分析及相关性分析。
2 结果与分析
2.1 青稞籽粒富硒发芽工艺优化试验结果
2.1.1 回归模型的建立与显著性分析 由表2可知,在实验所选条件下,有机硒含量的变化范围是0.622~1.502 mg/kg DW。利用Design-Expert软件进行拟合得到发芽时间(A)、pH(B)和亚硒酸钠浓度(C)与青稞芽中有机硒含量(R)的二次多项回归方程如下:
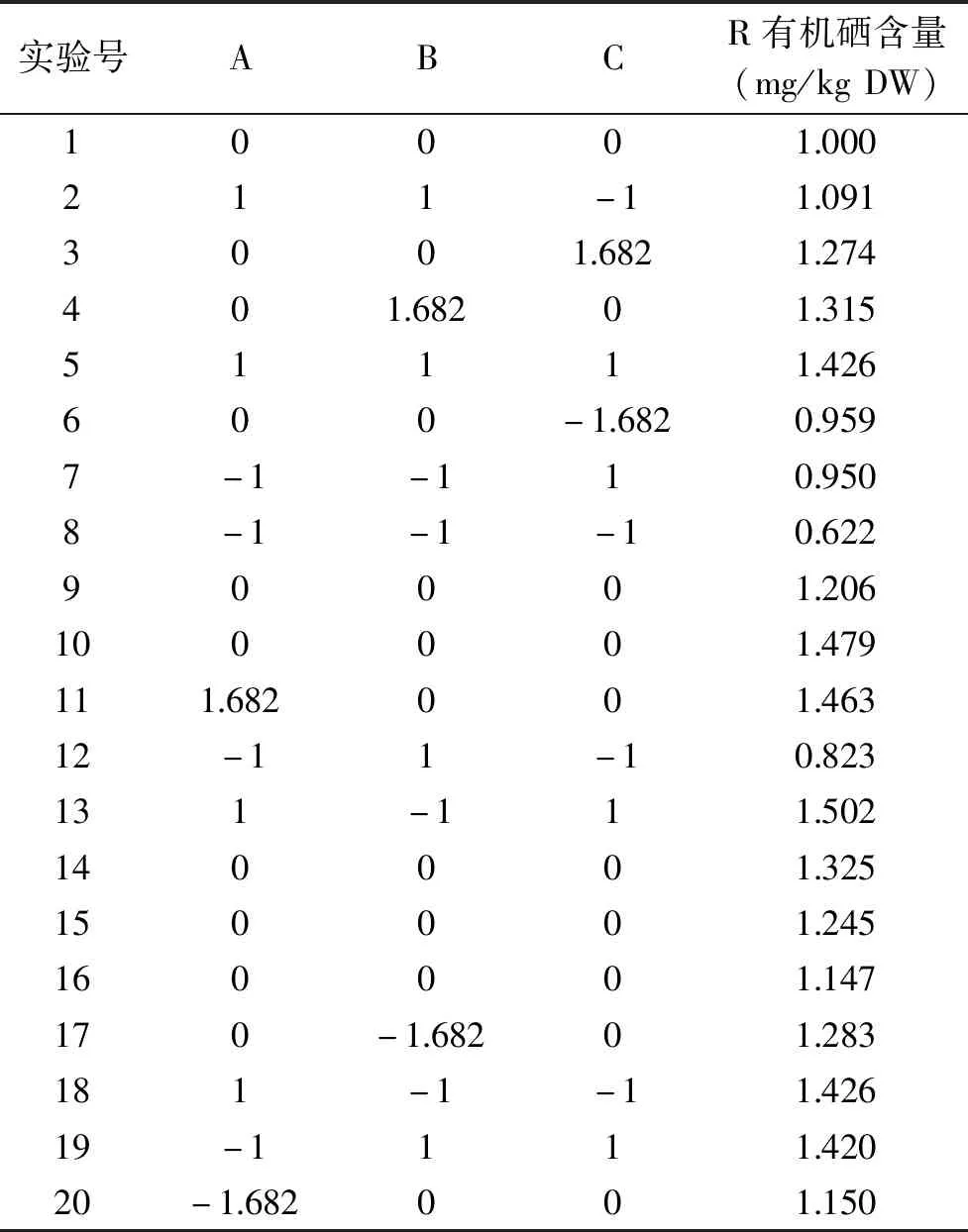
表2 中心组合试验设计方案及结果Table 2 Central composite design arrangement and experimental results
R=1.24+0.16A+0.023B+0.14C-0.14AB-0.064AC+0.066BC+8.111×10-3A2+5.459×10-3B2-0.059C2
进一步对回归方程进行分析,所得方差分析结果见表3。
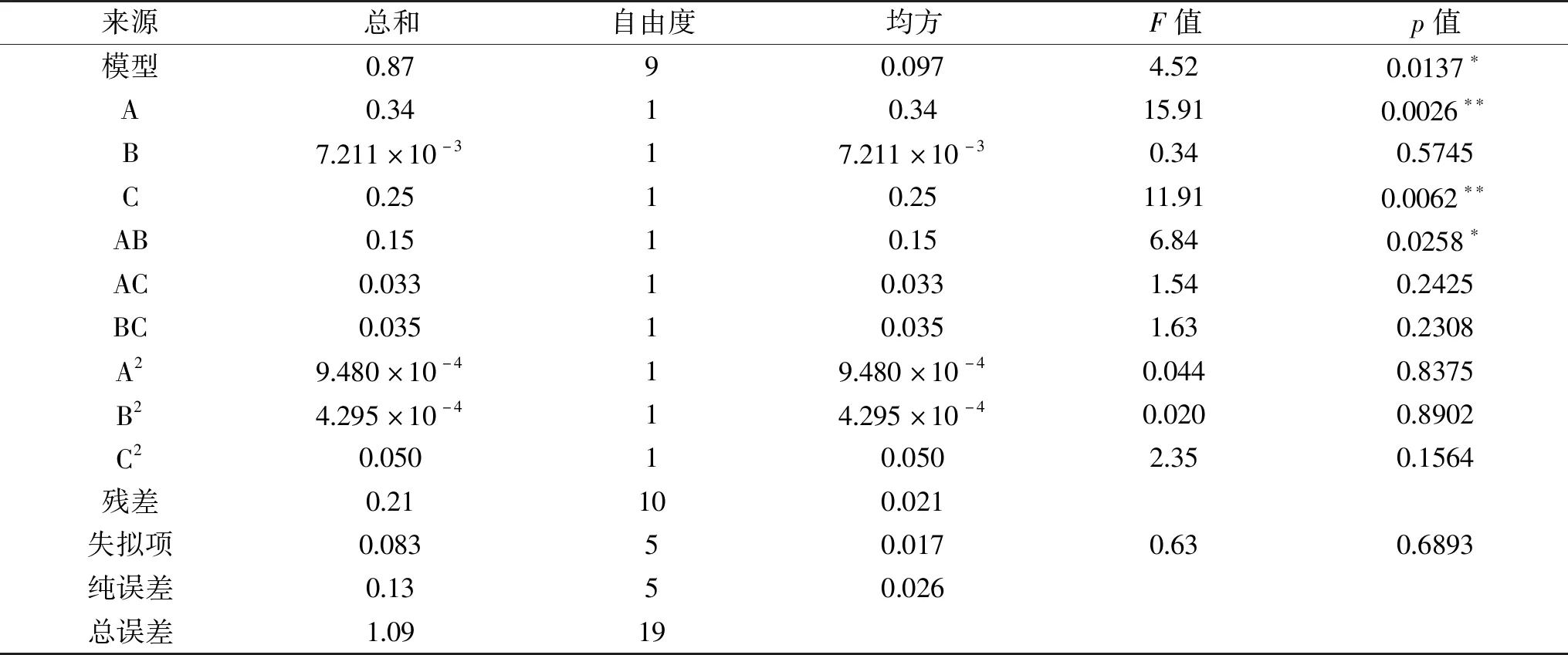
表3 回归模型方差分析Table 3 Analysis of variance of regression equation
由表3可知,该二次方程模型的p=0.0137<0.05,表明该模型差异显著;失拟项p=0.6893>0.05,表明失拟不显著。本研究得到的R2为0.8028,表明试验结果与数学模型拟合程度较好,可用此模型来分析和预测富硒青稞发芽的工艺条件。此外,由F检验可知三个因素对有机硒含量的影响按主次排位顺序为A>C>B,即发芽时间>亚硒酸钠浓度>培养液pH。其中发芽时间和亚硒酸钠浓度对有机硒含量的影响极显著(p<0.01),发芽时间和培养液pH的交互作用显著(p<0.05)。
2.1.2 响应面交互作用分析 由图1(a)可知,当发芽时间小于40 h,有机硒含量随着pH的增大而增加,当发芽时间大于40 h,有机硒含量随着pH的增大而减少;当pH一定时,有机硒含量随着发芽时间的延长而增加。响应曲面走势较陡峭,且等高线为类似于椭圆形的曲线,这表明发芽时间和培养液pH的交互作用对有机硒含量影响显著(p<0.05)。由图1(b)可知,当发芽时间一定时,有机硒含量随着亚硒酸钠浓度的增加而增加;当亚硒酸钠浓度一定时,有机硒含量随发芽时间的延长而增加。响应曲面走势较平缓,等高线较稀疏,这表明发芽时间和亚硒酸钠浓度的交互作用对有机硒含量影响不显著。由图1(c)可知,当pH一定时,有机硒含量随着亚硒酸钠浓度的增加而增加;当亚硒酸钠浓度较低时,有机硒含量随着pH的增大而减少,当亚硒酸钠浓度较高时,有机硒含量随着pH的增大而增加。响应曲面走势较平缓,等高线虽为类似于椭圆形的曲线但较稀疏,这表明培养液pH和亚硒酸钠浓度的交互作用对有机硒含量影响不显著。响应曲面的结果表明,在较长的发芽时间和较高的亚硒酸钠浓度下可以得到较大的有机硒含量。
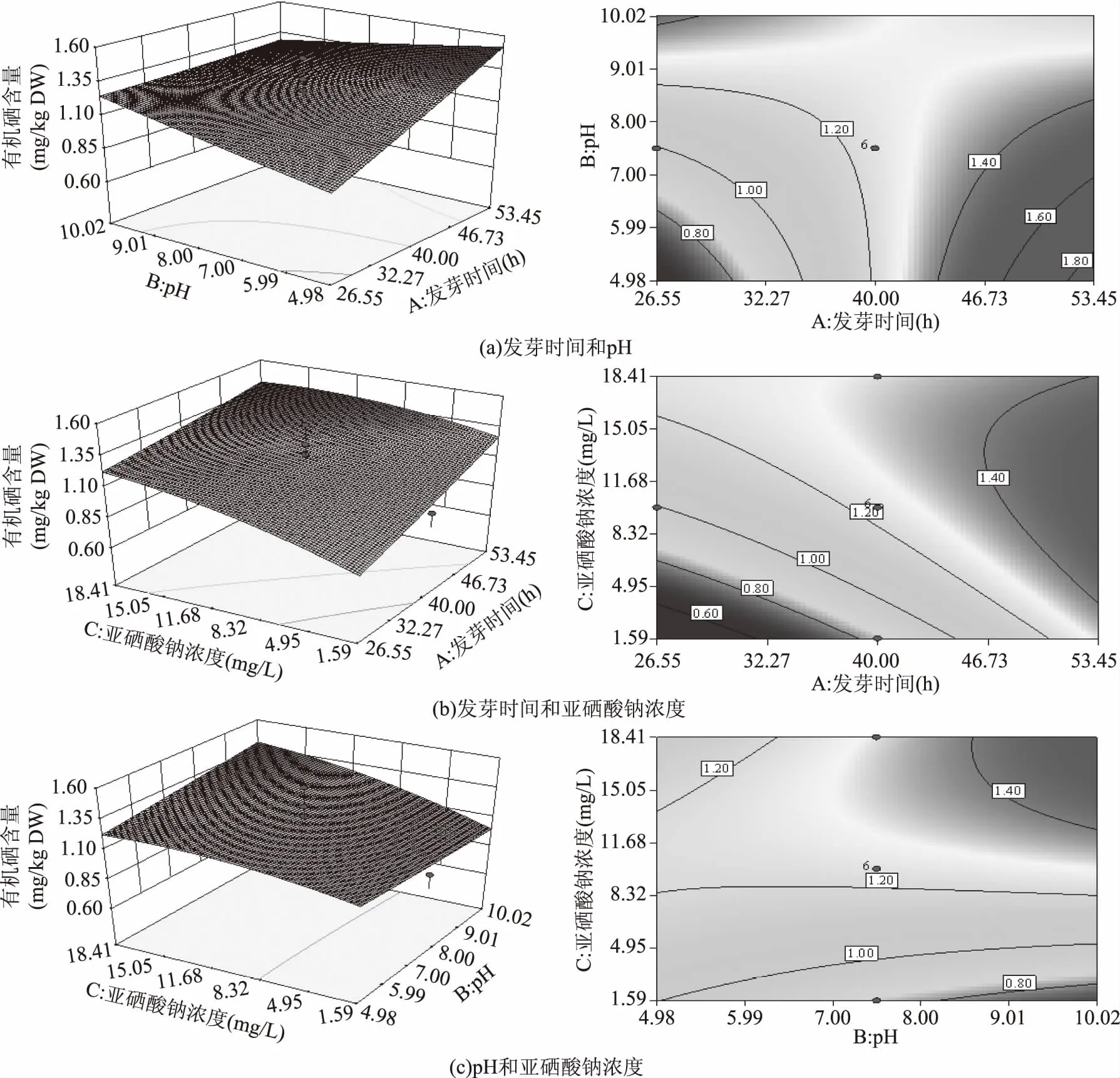
图1 各因素交互作用对有机硒含量影响的响应面和等高线图Fig.1 Response surface and contour plots showing the effects of operating parameters on organic selenium content
2.1.3 最佳工艺的确定与验证 由Design-Expert软件可知,最佳青稞籽粒富硒发芽条件为发芽时间48.00 h、pH6.00、亚硒酸钠浓度10.28 mg/L,此时有机硒含量的预测值为1.520 mg/kg DW。但考虑到实际操作,将富硒发芽条件修正为发芽时间48.00 h、pH6.00、亚硒酸钠浓度10.00 mg/L,在修正条件下对响应面模型的可靠性进行验证,验证实验重复进行3次,可得有机硒含量的平均值为1.572 mg/kg DW,与预测值相对误差为3.42%。因此,利用响应面法优化青稞籽粒富硒发芽工艺是可行的。
2.2 青稞籽粒发芽过程中的形态及含水率变化
2.2.1 青稞籽粒发芽过程中的形态变化 由图2可知,发芽过程中籽粒表面的粉色逐渐褪去,变为常见的黄色,并且有明显的吸水膨胀现象。发芽时间为0、12、24 h,两组籽粒均未发芽。发芽时间为36 h,对照组的平均芽长为(6.21±0.97) mm,富硒组的平均芽长为(4.85±0.71) mm;发芽时间为48 h,对照组的平均芽长为(9.18±0.97) mm,富硒组的平均芽长为(7.52±0.36) mm,这表明10 mg/L的亚硒酸钠溶液对青稞籽粒的发芽具有明显的抑制作用。Lazo-Vélez等[9]研究发现,亚硒酸钠浓度增加会影响小麦籽粒的发育,减缓胚根的生长,这与本研究结果相似,一定浓度的亚硒酸钠溶液会抑制植物籽粒的生长。
普通本科院校的建设归根结底是应用型本科专业的建设。旅游管理专业的特点要求在教学环节及人才培养过程中加大实践教学力度,增加实践教学内容,构建系统的实践教学体系。

图2 青稞籽粒发芽过程中的形态Fig.2 Morphology of highland barley seeds during germination
2.2.2 青稞籽粒发芽过程中含水率变化 如图3所示,随着发芽时间的增加,富硒组与对照组的含水率都逐渐增加。当发芽时间为48 h时,富硒组和对照组的含水率均显著高于发芽时间为0 h的含水率(p<0.05)。Lazo-Vélez等[9]通过优化小麦富硒发芽条件发现,当亚硒酸钠浓度和发芽温度一定时,小麦籽粒的含水率随着发芽时间的延长而增大,与本研究的结果一致。
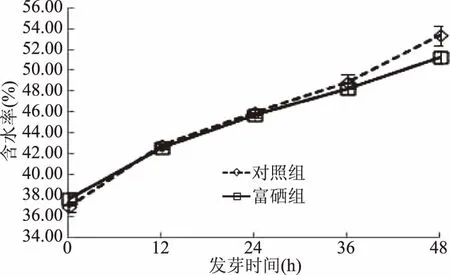
图3 发芽时间对青稞籽粒含水率的影响Fig.3 Influence of germination time on the water content in highland barley seeds
2.3 青稞籽粒发芽过程中抗氧化物质及抗氧化能力变化
2.3.1 青稞籽粒发芽过程中总酚和总黄酮醇含量变化 当发芽时间为0 h时,富硒组与对照组的总酚含量均小于原料中的总酚含量(3.73 mg GAE/g DW)(图4a)。富硒组总酚含量下降可能有以下几方面原因:水溶性酚类化合物浸出到浸泡液中导致其损失;低分子量的酚类化合物聚合变得不溶于水;多酚与其他有机物如碳水化合物或蛋白质结合;亚硒酸钠浸泡过程中多酚氧化酶的作用导致了多酚的降解和损失[24]。富硒组和对照组中总酚含量均随着发芽时间的增加而逐渐增加,发芽48 h后,富硒组青稞籽粒总酚含量比原料增加了4.56%,而对照组增加了7.24%。Chen等[6]通过对比不同小麦品种发芽期间总酚含量的变化发现,不同品种小麦在发芽过程的总酚含量均显著增加,与本研究结果一致。发芽过程中酚类物质的增加有利于植物保护自身结构和适应环境因素的变化[25]。硒对总酚含量的影响,可能是由于硒促进了葡萄糖等一些糖类物质的积累,而糖是许多代谢途径中的重要底物,进而影响酚类物质的合成[13]。而本研究结果却表明,硒抑制了总酚含量的增加,其作用机理仍需进行进一步探究。

图4 发芽时间对青稞籽粒总酚(a)和总黄酮醇(b)含量的影响Fig.4 Influence of germination time on total phenolics(a) and total flavonols content(b)in highland barley seeds
由图4b可知,随着发芽时间的增加,对照组中总黄酮醇含量逐渐增加,发芽后的总黄酮醇含量为9.82 mg QE/g DW;富硒组的总黄酮醇含量则呈现先增加后下降的趋势,发芽时间为24 h总黄酮醇含量达到最大值(11.37 mg QE/g DW),发芽48 h后,总黄酮醇含量降低至9.71 mg QE/g DW,但仍显著高于原料中的总黄酮醇含量(6.61 mg QE/g DW)(p<0.05),发芽结束后富硒组与对照组的总黄酮醇含量无显著差异(p>0.05)。发芽过程中对照组的总黄酮醇含量逐渐增加,可能是由于种子发芽过程中的生化反应导致一些酶被激活,生成了黄酮类化合物和糖苷等次级植物代谢产物[26]。Zhu等[27]以番茄为材料,采用1 mg/L亚硒酸钠对叶片进行预处理,研究发现番茄收获后富硒组的黄酮含量显著高于对照组,其黄酮含量是对照组的1.5倍,而本研究表明发芽48 h时,富硒组与对照组的总黄酮醇含量没有显著差异。
2.3.2 青稞籽粒发芽过程中β-葡聚糖含量变化 由图5可知,随着发芽时间的增加,青稞籽粒中β-葡聚糖含量不断降低,发芽48 h后,富硒组的β-葡聚糖含量为对照组的1.08倍,有效地延缓了β-葡聚糖降解。发芽过程中,β-葡聚糖酶活性随着发芽时间的增加而增强,从而降解β-葡聚糖,使其含量降低[28]。Marconi等[29]和唐珊珊等[15]的研究也表明发芽可导致谷物中β-葡聚糖的降解。另一方面,亚硒酸钠作用下的青稞β-葡聚糖在整个发芽过程中损失率均低于对照组青稞,表明亚硒酸钠可有效延缓β-葡聚糖含量的降低,可能是由于亚硒酸钠溶液对青稞籽粒的发芽具有显著地抑制作用,进而减缓了β-葡聚糖的降解速率,导致富硒组的β-葡聚糖含量高于同一发芽时期的对照组。

图5 发芽时间对青稞籽粒β-葡聚糖含量的影响Fig.5 Influence of germination time on β-glucan contents in highland barley seeds
2.3.3 青稞籽粒发芽过程中有机硒含量变化 由于发芽过程中对照组的有机硒均未检出,因此仅研究富硒组的有机硒含量变化。由图6可知,随着发芽时间的增加,亚硒酸钠作用下的青稞籽粒有机硒含量显著增加(p<0.05),发芽48 h后富硒青稞籽粒的有机硒含量是原料的17.46倍。Liu等[10]研究发现,糙米能够从环境中吸收无机硒,并在发芽过程中将这种元素转化为含硒蛋白,实现无机硒到有机硒的转化。可能是亚硒酸盐被植物吸收后,在谷胱甘肽催化下生成硒化物,硒化物进一步在氨基酸合成酶的催化下生成硒代氨基酸如SeCys、SeMet等,从而参与蛋白质的合成[30]。
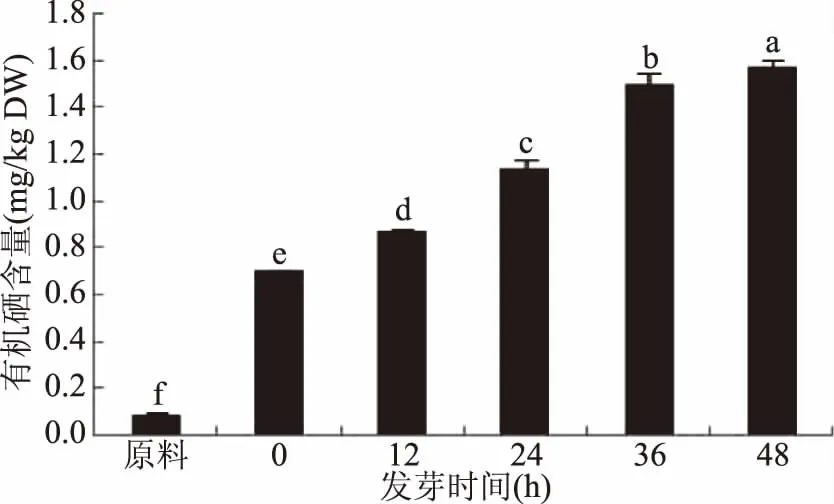
图6 发芽时间对富硒青稞籽粒有机硒含量的影响Fig.6 Influence of germination time on organic selenium content in selenium enriched highland barley seeds注:不同小写字母表示数值间差异显著(p<0.05)。
2.3.4 青稞籽粒发芽过程中抗氧化能力变化 如图7a所示,青稞籽粒发芽过程中富硒组与对照组的ABTS+自由基清除能力均逐渐增加,发芽48 h后富硒组和对照组的ABTS+值分别为原料(122.26 μmol TE/g DW)的1.50和1.58倍。Gawlik-Dziki等[31]探究了发芽对波兰冬小麦ABTS+自由基清除能力的影响发现,发芽小麦粉经化学提取和缓冲液提取后,ABTS+自由基清除能力均显著增加,并且发芽后对羟基苯甲酸、丁香酸和对香豆酸等酚类物质含量也有所增加。发芽过程中ABTS+自由基清除能力的增强可能是由于酚类物质含量增加导致的[6]。本研究也表明,青稞籽粒发芽过程中,富硒组与对照组的总酚含量和ABTS+自由基清除能力都显著增加(p<0.05)。Giese等[32]通过研究发现真菌β-D-葡聚糖表现出较强的抗氧化活性,是一种具有有效抗氧化活性的新型生物活性化合物来源。因此,虽然富硒组的总酚含量低于对照组,但由于富硒组有较高的β-葡聚糖含量,导致富硒组与对照组的ABTS+自由基清除能力无显著差异(p>0.05)。
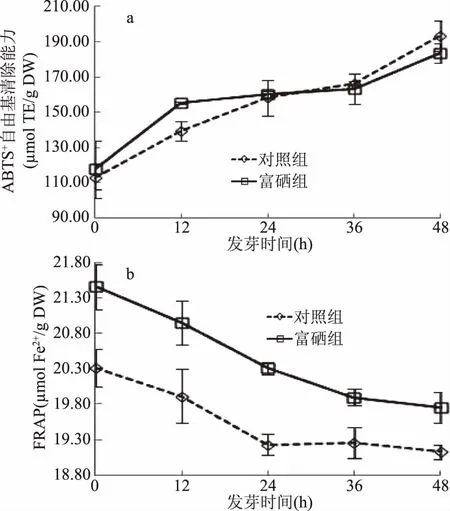
图7 发芽时间对青稞籽粒ABTS+自由基清除能力(a)和铁离子还原能力(FRAP)(b)的影响Fig.7 Influence of germination time on ABTS+ radical scavenging activity(a)and ferric reducing antioxidant power(b)in highland barley seeds
随着发芽时间的增加,富硒组的铁离子还原能力逐渐降低(图7b);发芽24 h内,对照组的铁离子还原能力下降速率较快,但发芽时间为24~48 h时,对照组的铁离子还原能力基本保持不变。在整个发芽过程中富硒组的铁离子还原能力均显著高于对照组(p<0.05),发芽结束后富硒组的FRAP值为对照组的1.03倍。研究表明,β-葡聚糖可以使Fe3+转化为Fe2+,从而导致溶液的颜色由黄色变为普鲁士蓝[33]。富硒组的铁离子还原能力显著高于对照组(p<0.05),一方面可能是因为富硒组的β-葡聚糖含量高于同一发芽时期的对照组,导致富硒组的铁离子还原能力也高于同一发芽时期的对照组;另一方面可能是由于富硒发芽青稞蛋白中硒以硒代半胱氨酸的形式存在,能有效除去起催化作用的金属离子[34],也导致了富硒组的铁离子还原能力高于同一发芽时期的对照组。
2.4 青稞籽粒富硒发芽过程中主要抗氧化物质与抗氧化能力的相关性分析
酚类物质被认为是谷物、蔬菜和其它植物抗氧化能力的主要来源,黄酮醇是酚类物质的重要组成,具有较强的抗氧化能力。β-葡聚糖可以使Fe3+转化为Fe2+,具有铁离子还原能力。含硒有机物是合成抗氧化酶的关键物质,可有效预防氧化应激[9]。ABTS+自由基清除能力和铁离子还原能力(FRAP)可用于评价发芽青稞的抗氧化能力。为进一步研究富硒发芽青稞籽粒主要抗氧化物质与抗氧化能力之间的关系,采用Pearson法分析以上抗氧化物质与抗氧化能力、以及各物质之间的相关性(表4)发现,总酚含量与β-葡聚糖含量呈显著的负相关性(p<0.05)、与铁离子还原能力(FRAP)呈极显著的负相关性(p<0.01)、与有机硒含量和ABTS+自由基清除能力呈极显著的正相关性(p<0.01);总黄酮醇含量与β-葡聚糖含量和铁离子还原能力(FRAP)呈显著的负相关性(p<0.05);β-葡聚糖含量与有机硒含量呈极显著的负相关性(p<0.01)、与ABTS+自由基清除能力呈显著的负相关性(p<0.05)、与铁离子还原能力(FRAP)呈极显著的正相关性(p<0.01);有机硒含量与ABTS+自由基清除能力呈极显著的正相关性(p<0.01)、与铁离子还原能力(FRAP)呈极显著的负相关性(p<0.01)。其他指标间的相关性不显著。
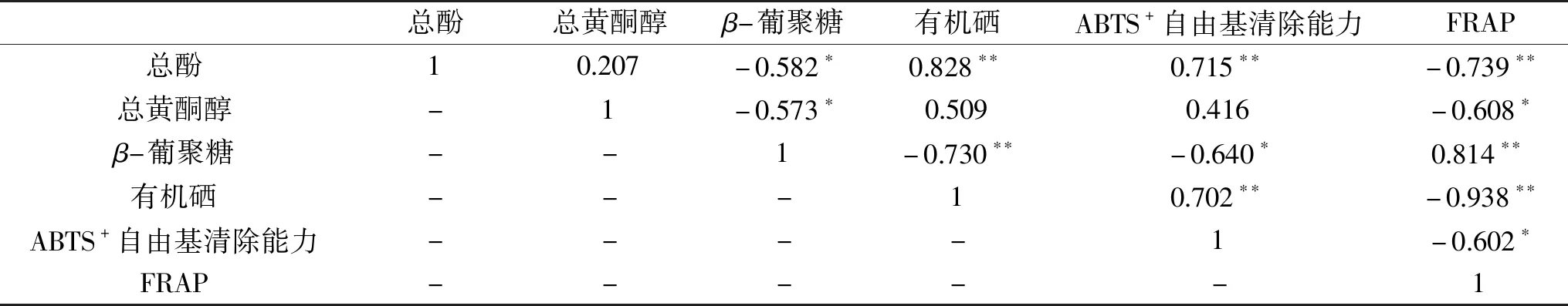
表4 富硒青稞主要抗氧化物质含量与抗氧化能力的相关性分析Table 4 Correlation analysis of antioxidant substances and antioxidant capacity of highland barley seeds enriched with selenium
以上分析表明,富硒发芽过程中酚类物质的增加可以有效提高发芽青稞的ABTS+自由基清除能力;由于总酚含量和总黄酮醇含量在富硒发芽过程中不断升高,而β-葡聚糖含量和铁离子还原能力在发芽过程中不断降低,因此总酚含量和总黄酮醇含量均与β-葡聚糖含量和铁离子还原能力呈负相关;硒元素的富集有效地延缓了β-葡聚糖的降解进而提高了发芽青稞的铁离子还原能力,与此同时有机硒的富集也提高了发芽青稞的ABTS+自由基清除能力。
3 结论
本研究采用响应面优化试验得到修正后的最佳青稞籽粒富硒发芽条件为发芽时间48.00 h、培养液pH6.00、亚硒酸钠浓度10.00 mg/L。在此条件下,青稞籽粒发芽后的有机硒含量为1.572 mg/kg DW,是原料的17.46倍。
在青稞籽粒发芽过程中,富硒组和对照组的总酚、总黄酮醇含量和ABTS+自由基清除能力均显著增加(p<0.05);富硒组的有机硒含量显著增加(p<0.05),对照组的有机硒含量未检出;富硒组和对照组的β-葡聚糖含量和铁离子还原能力(FRAP)均显著下降(p<0.05)。发芽结束后,富硒组的总酚含量显著(p<0.05)低于对照组;总黄酮醇含量和ABTS+自由基清除能力与对照组无显著差异(p>0.05);有机硒、β-葡聚糖含量和铁离子还原能力(FRAP)均显著高于对照组(p<0.05)。
相关性分析表明,总酚含量与有机硒含量和ABTS+自由基清除能力、β-葡聚糖含量与铁离子还原能力(FRAP)以及有机硒含量与ABTS+自由基清除能力均呈极显著正相关(p<0.01);铁离子还原能力(FRAP)与总酚含量和有机硒含量以及β-葡聚糖与有机硒含量均呈极显著负相关(p<0.01);β-葡聚糖含量与总酚含量和ABTS+自由基清除能力、总黄酮醇含量与β-葡聚糖含量和铁离子还原能力(FRAP)均呈显著负相关(p<0.05),其他指标间无明显相关性。综上所述,富硒青稞籽粒可以作为优质的硒源添加到膳食中去,而且硒元素的富集有效地延缓了β-葡聚糖含量降低,增强了青稞籽粒的抗氧化能力。
